3.3.3 Mn-SOD的活性中心
目前已知,任何生物来源的Mn-SOD参与形成活性中心的分子及与金属连接的氨基酸在生命进化过程中都是保守的,它们是3个组氨酸、1个天冬氨酸和1个水分子。
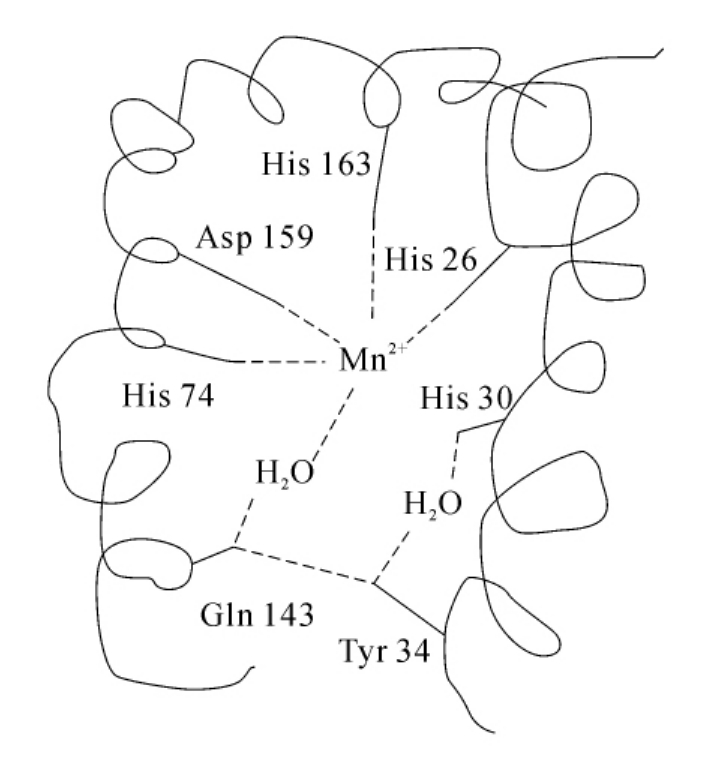
图3-22 人Mn-SOD的活性中心保守氨基酸残基
ESR和NMR研究揭示了Mn-SOD中的金属离子是处于高自旋状态的三价锰Mn3+。Mn-SOD的金属辅基上结合有1个水分子,这1个水分子的存在可能与催化机理有关。金属辅基对蛋白质结构有稳定作用,而且与Mn-SOD的活性直接相关。其活性中心(以人Mn-SOD为例)如图3-22所示。
表3-4 E.coli Mn-SOD活性中心的主要几何结构参数
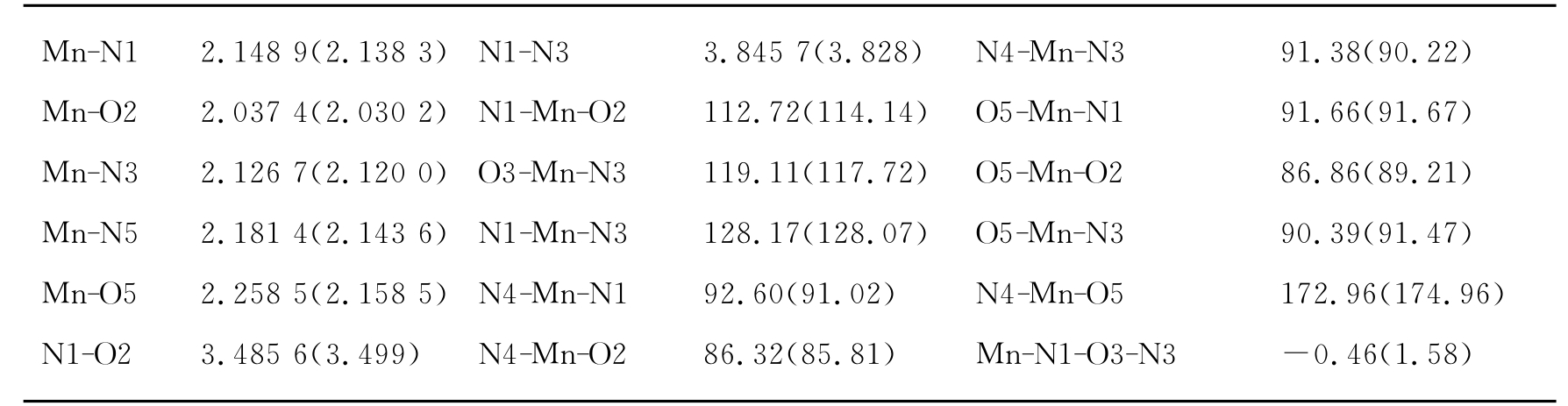
注:键长单位为;角度单位为°(度);括号外数字为MnSOD-1(1IXB);括号内数字为MnSOD-2(1IX9)。
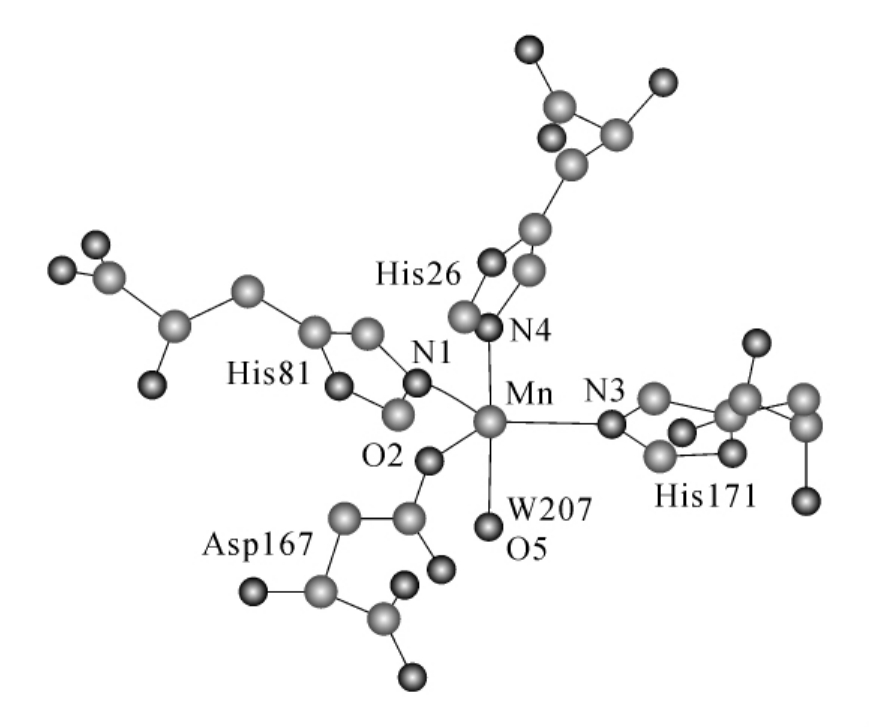
图3-23 E.coli Mn-SOD单体活性中心的结构
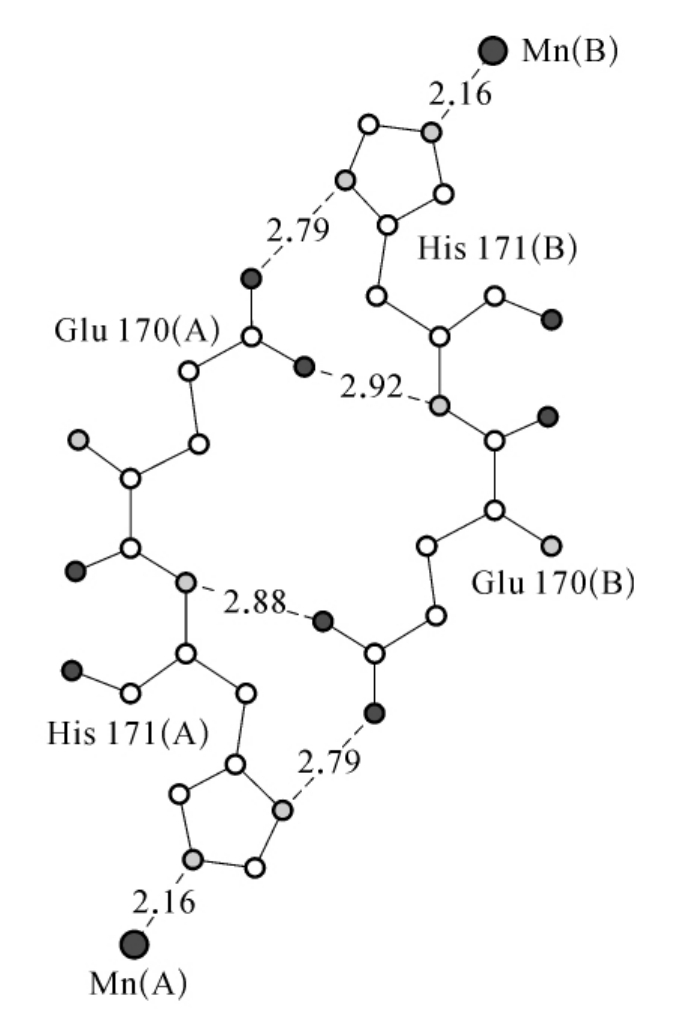
图3-24 E.coli Mn-SOD二聚体的两个活性中心的连接示意图
(摘自EN Baker.J Biol Inorg Chem,1998)
图示包括17个键,3个残基,谷氨酰胺桥连接Mn-SOD二聚体的两个活性中心,氢键以断续连接线表示。
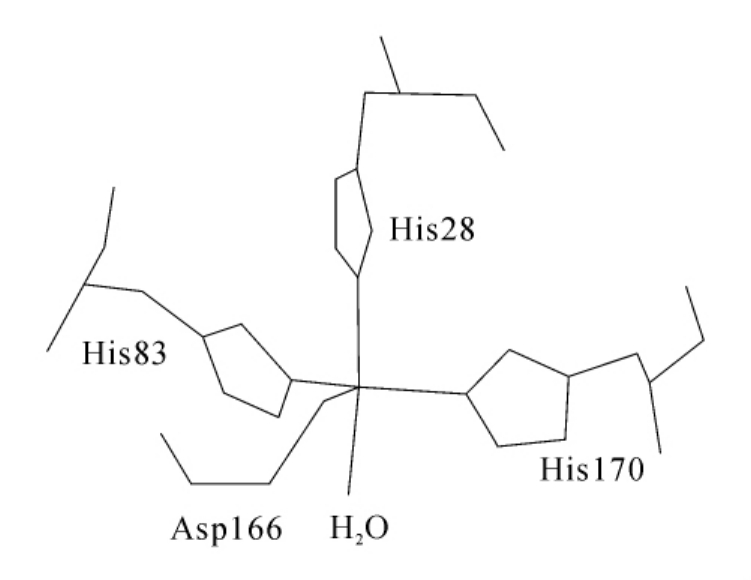
图3-25 T.thermophilus的Mn-SOD活性中心的结构
Stallings与其合作者先后于1984年、1985年、1991年分别以0.44nm,0.24nm和0.18nm不断精密的分辨率对来自T.thermophilus的Mn-SOD进行了X射线结构研究,从而使该酶成为Mn-SOD中结构研究最为精确的一种。他们的研究表明,来自T.thermophilus的Mn-SOD中,每个Mn(Ⅲ)都具有五配位的三角双锥结构,其中一个轴向配体为水分子,来自蛋白质辅基的4个配位基为His28,His83,Asp166和His170。后3个配位基位于赤道平面,His28的咪唑基则占据着另一个轴向位置,图3-25是T.thermophilus Mn-SOD活性部位的结构图。由图3-25可见,活性部位处在一个主要由疏水残基构成的疏水壳子里,两个亚基链共同形成一个通道,该通道终止于金属离子附近的Tyr36和His32残基,是底物或其他配体接近Mn(Ⅱ)经由之路。His33,Trp87,His83和Tyr36形成一个疏水口袋,该口袋构成底物结合部位。其他来源Mn-SOD活性部位的Mn(Ⅲ)离子的配位情况基本相似。
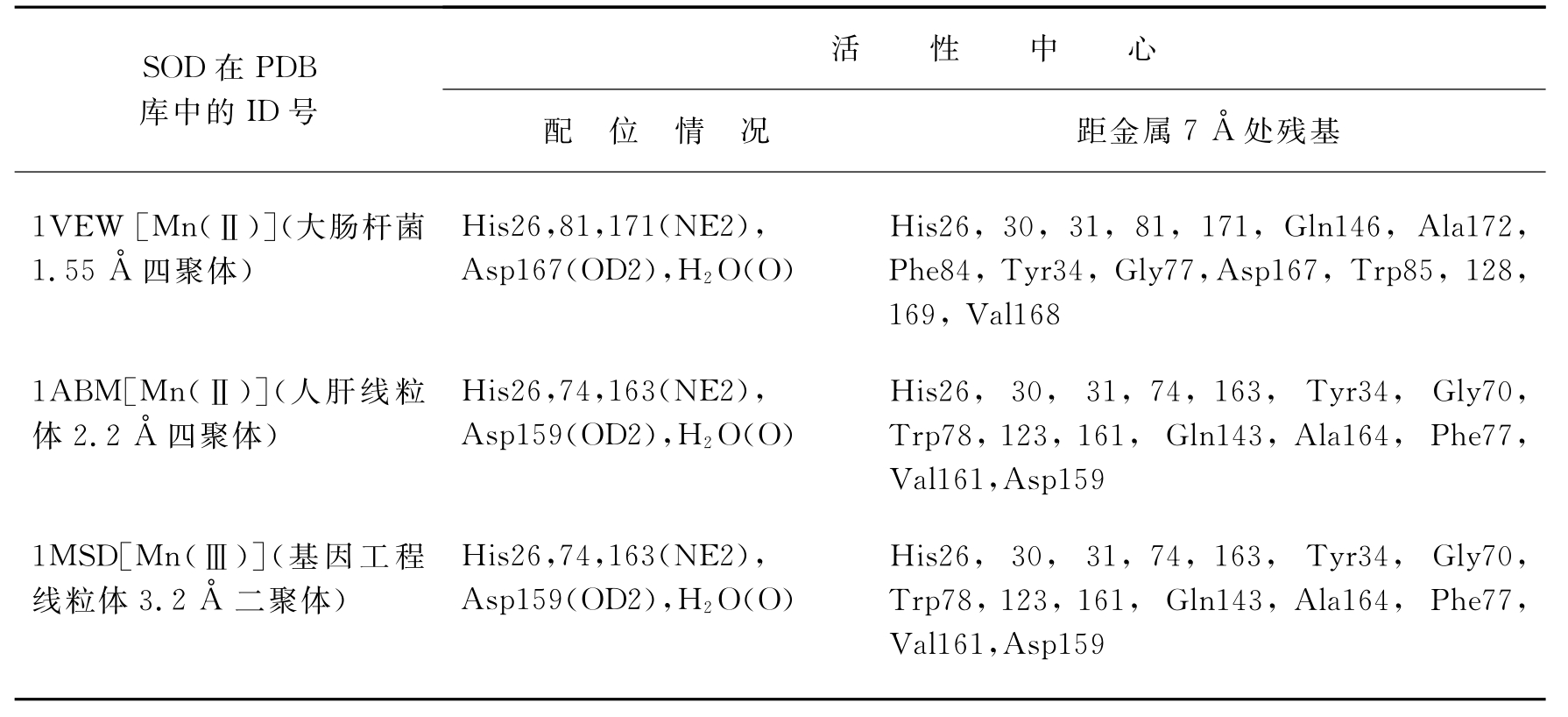
表3-5 Mn-SOD活性中心部分处残基情况
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















