皮肤组织工程学是一门新兴学科,从培养的表皮细胞膜片到体外构建的复层皮肤向我们展示了组织工程技术与方法在皮肤重建中的巨大潜能。虽然目前的皮肤替代物还存在着各种各样的缺点,但新技术与新方法的不断出现,将为这一领域的研究注入新的活力与希望。
组织工程皮肤的体外构建包括真皮及表皮的构建,下面以利用聚羟基乙酸构建组织工程复层皮肤为例介绍组织工程皮肤的体外构建和鉴定方法。
聚羟基乙酸(ployglycolic acid,PGA)是最典型的合成可降解聚合物,PGA由乙交酯开环聚合制取,降解后生成羟基乙酸。由于羟基乙酸是体内三羧酸循环的中间代谢物,且吸收和代谢机制已经明确并具有可靠的生物安全性,因而聚羟基乙酸作为第一批可降解吸收材料被美国FDA批准用于临床,是迄今研究最广泛、应用最多的可降解生物材料之一。
杨光辉、曹谊林等采用聚羟基乙酸为培养支架,在体外静态培养模式下用组织工程方法构建出双层、有活性人工皮肤,并且构建的组织工程皮肤具有和正常皮肤相似的组织学特征及生化成分,真皮层是由PGA和成纤维细胞及其分泌的基质蛋白共同组成,表皮是由接种在表面的角质形成细胞不断增殖、分化形成。但构建的组织工程皮肤修复创面的能力以及远期移植效果仍须进一步的实验研究。
在组织工程皮肤表皮鉴定方面可用角蛋白(keratin)和外皮蛋白(Involucrin)。角蛋白是上皮细胞主要的结构蛋白和分化的标志性产物。几乎所有的上皮细胞都含有角蛋白,因此可以用于鉴别上皮性细胞和非上皮性细胞。外皮蛋白是一种可溶性的细胞角蛋白前体蛋白质,在表皮基底层以上的各层表达,是角质形成细胞终末分化的标志物之一,通过免疫组织化学染色可以进一步证明体外构建的组织工程皮肤的双层结构并且表皮复层分化已比较成熟。
一、实验试剂及方法
(一)种子细胞培养液及其他试剂
1.成纤维细胞培养液 DMEM培养基,添加10%胎牛血清、100U/ml青霉素、100μg/ml链霉素。
2.表皮角质形成细胞培养液 为DMEM与F12的混合培养基,按3∶1(V/V)比例混合,添加10%胎牛血清、4mM谷氨酰胺、100U/ml青霉素、100μg/ml链霉素、0.4μg/ml氢化可的松、10-10 M霍乱毒素、5μg/ml转铁蛋白、2×10-11 M三碘甲腺原氨酸、1.8×10-4 M腺嘌呤、5μg/ml胰岛素和10ng/ml表皮生长因子。DMEM与F12的基础培养基4℃保存,添加剂以浓缩液的形式-20℃保存,新鲜配用,一般不超过2周。
3.其他培养用液
(1)PBS液:无钙镁磷酸盐缓冲液,成分1%(W/V)NaCl,0.025%KCl,0.144% Na2HPO4,0.025%KH2PO4,调整溶液的pH为7.2,高温、高压消毒灭菌,室温下贮存备用。
(2)胰蛋白酶消化液:按0.25%的浓度配制胰蛋白酶溶液。
(3)中性蛋白酶(Dispase)液:用PBS配制,浓度为2mg/ml,过滤消毒,即配即用。
(4)大豆胰酶抑制剂:浓度为10mg/ml,溶解于无钙、镁PBS缓冲盐溶液中,过滤消毒,-20℃冷冻保存。
(二)聚羟基乙酸的保存和消毒
1.聚羟基乙酸避光、室温,在真空干燥器中保存备用。
2.接种细胞前,首先用75%的乙醇浸泡30min。
3.PBS液冲洗3次。
4.成纤维细胞培养液浸洗10min。
5.吸干聚羟基乙酸上吸附的培养液,备用。
二、体外构建组织工程双层皮肤
(一)构建方法
1.构建成纤维细胞-PGA复合物 酶消化法收集真皮成纤维细胞,以20×106/ml的浓度将其接种于PGA。2h后,加入含10%胎牛血清的DMEM培养液,直至液面超过复合培养物的表面,培养液3d换1次,培养1周。
2.接种表皮角质形成细胞 用吸管吸干培养液,收集表皮角质形成细胞,以0.2× 106/cm2的密度将其接种在成纤维细胞-PGA复合物表面,待细胞贴附后,加入表皮角质形成细胞培养液,共培养5d。
3.双层皮肤的成熟 共培养5d后,用无菌镊子将复合物放在可渗透滤膜(Millicell-CM,USA)上,制造气-液界面,促进表皮角质形成细胞的进一步分化。再培养1周后,即可形成包含真皮与表皮两层结构的组织工程皮肤(图15-1,彩图58)。

图15-1 气-液界面培养
(二)组织工程双层皮肤的检测及实验结果
1.于复合培养后固定时间留取标本,剪成两块,一块用10%中性甲醛溶液固定,石蜡包埋,制成4μm厚的切片,作常规HE染色。另一小块组织用2%戊二醛、1%锇酸固定,梯度乙醇逐级脱水,EPON包埋后,行透射电镜观察。
2.组织学 成纤维细胞在PGA上生长良好并分泌大量基质(图15-2,彩图59);接种表皮角质形成细胞1周后可见1~2层连续的表皮细胞在“成纤维细胞-PGA”复合物上生长良好(图15-3,彩图60);4周时PGA已部分降解,表皮分层分化较完善,可见基底层、棘细胞层及角化层,与正常皮肤结构相似(图15-4,彩图61)。
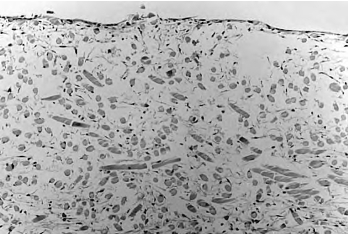
图15-2 培养1周的人工真皮(HE,100×)
3.超微结构 扫描电镜显示表皮角质形成细胞、成纤维细胞在PGA上黏附生长并分泌大量基质蛋白成分(图15-5)。
4.透射电镜观察 组织工程皮肤经过气-液界面培养2周时可见表皮细胞分层分化良好,细胞质中可见分散、纤细的角蛋白丝,细胞的相邻面有桥粒连接,人工真皮层中成纤维细胞形态正常,分布有大量胶原纤维,尚可见未完全降解的PGA,在两层细胞交界处可见不连续的基底膜成分(图15-6,图15-7)。
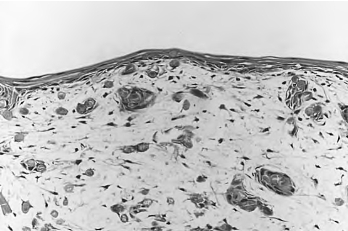
图15-3 人工真皮上接种角质形成细胞一周(HE,100×)

图15-4 气-液界面培养两周(HE,100×)
5.免疫组织化学 气-液培养2周的组织工程皮肤的表皮层抗广谱角蛋白(Keratin)染色(图15-8,彩图62)及抗外皮蛋白(Involucrin)染色(图15-9,彩图63)阳性。
三、实验要点
1.聚羟基乙酸在空气中会缓慢降解,必须保存在真空干燥器中备用。
2.聚羟基乙酸经乙醇浸泡消毒后须用PBS充分冲洗,在接种细胞前尽量吸干聚羟基乙酸上黏附的液体,以利于细胞黏附、生长。
3.接种成纤维细胞后观察基质分泌情况,待基质已布满PGA纤维之间空隙时,接种表皮角质形成细胞。

图15-5 表皮角质形成细胞(左)、成纤维细胞(右)在PGA上黏附生长情况(扫描电镜)
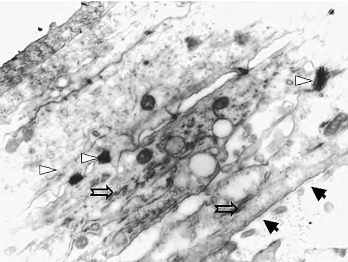
图15-6 气-液界面培养两周的组织工程皮肤的透射电镜观察(6 000×)
注:Δ示角质形成细胞间桥粒连接;示角蛋白丝;↑示不连续的基底膜形成)
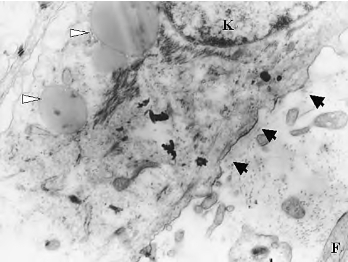
图15-7 气-液界面培养两周的组织工程皮肤的透
射电镜观察(10 000×)
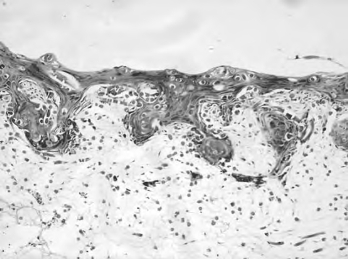
图15-8 抗角蛋白免疫组织化学染色(100×)
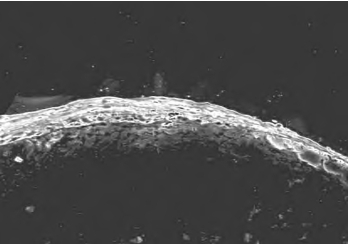
图15-9 抗外皮蛋白免疫荧光化学染色(100×)
参 考 文 献
1Naughton GK.Skin and Epithelia.In:Lanza RP,Langer R,Chick WL.Principles of Tissue Engineering.R.G.Landes Company and Academic Press,Inc.1997,769
2Tompkins RG,Burke JF.Burn wound closure using permanent skin replacement materials.World J.Surg,1992;16:47
3Pruitt BA,Jr,Levine NS.Characteristics and uses of biologic dressing and skin substitutes.Arch.Surg,1984;119:312
4Rheinwald JG,Green H.Serial cultivation of strains of human epidermal keratinocytes:the formation of keratinizing colonies from single cells.Cell,1975;6:331
5Green H,Kehinde O,Thomas J.Growth of cultured human epidermal cells into multiple epithelia suitable for grafting.Proc.Nat.Acad.Sci.U.S.A.,1979;76:5665
6O′Connor NE,Mulliken JB,Banks-Schlegel S,et al.Grafting of burns with cultured epithelium prepared form autologous epidermal cells.Lancet,1981;75
7Herndon DN,Rutan RL.Comparison of cultured epidermal autograft and massive excision with serial autografting plus homograft overlay.J Burn Care Rehabil,1992;13(2):154
8YannasⅣ,Burke JF.Design of an artificial skin:I.Basic design principles.J.Biomed.Mater.Res,1980;14:65
9YannasⅣ,Burke JF,Gordon PL,et al.Design of an artificial skin:Ⅱ.Control of chemical composition.J.Biomed.Mater.Res,1980;14:107
10Gentzkow GD,Iwasaki SD,Hershon KS,et al.Use of dermagraft,a cultured human dermis,to treat diabetic foot ulcers.Diabetes Care.1996 Apr;19(4):350-354
11Bell E,Ehrlich HP,Buttle DJ,et al.Living tissue formed in vitro and accepted as skin-equivalent tissue of full thickness.Science,1981;211:1052
12Falanga V,Margolis D,Alvarez O,et al.Rapid healing of venous ulcers and lack of clinical rejection with an allogeneic cultured human skin equivalent.Arch Dermatol,1998;134:293
13 杨光辉,崔 磊,刘 伟,等 .利用聚羟基乙酸构建组织工程皮肤的实验研究 .中华实验外科杂志,2003;20(11):984-985
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














