将通过聚丙烯酰胺凝胶电泳分离的蛋白质转移到硝酸纤维素或PVDF膜上,然后与能特异性识别待检蛋白的抗体进行反应,洗涤去除没有结合的特异性抗体后,加入标记的、能识别特异性抗体的种属特异性抗体,反应一段时间后再次洗涤去除非特异性结合的标记抗体,加入适合标记物的检测试剂进行显色或发光等,观察有无特异性蛋白条带的出现,也可通过条带的密度大小来进行特异性蛋白的半定量。
实验流程如下:

一、样品制备
蛋白质的样品制备是western blotting的第一步,样品制备是关键步骤,要求尽可能的获得所有蛋白质,应注意以下问题。
1.在合适的盐浓度下,应保持蛋白质的最大溶解性和可重复性。
2.选择合适的表面活性剂和还原剂,破坏所有非共价结合的蛋白质复合物和共价键二硫键,使其形成一个各自多肽的溶液。
3.尽量去除核酸、多糖、脂类等干扰分子。
4.防止蛋白质在样品处理过程中的人为修饰,制备过程应在低温下进行,以避免细胞破碎释放出的各种酶类的修饰(建议加入合适的蛋白酶抑制剂)
5.样品建议分装成合适的量,然后冷冻干燥或直接以液体状态置-80℃中保存,但要注意不要反复冻融。
【材料】
1.试剂
(1)1×SDS上样缓冲液:62.5mmol/L Tris-HCl(pH6.8),2%(w/v)SDS,10% 甘油50mmol/L DTT或5% β-巯基乙醇,0.01%(w/v)溴酚蓝。
(2)其他试剂:PBS缓冲液。
2.设备 移液器、离心机、冰箱、水浴锅、摇床、超声破碎仪、细胞刮子等。
3. 体外培养的细胞
【操作步骤】
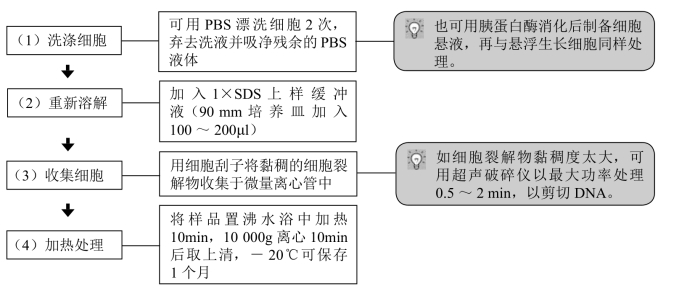
1. 悬浮生长细胞的处理

2. 贴壁生长细胞的处理
二、SDS-PAGE
【材料】
1.试剂
(1)30%丙烯酰胺:丙烯酰胺29g,N',N'-亚甲叉双丙烯酰胺1g,加水至100 ml,避光保存于棕色瓶内。
(2)1.5mol/L Tris-HCl pH 8.8:18.165g Tris用80ml水溶解后,HCl调pH至8.8,加水至100ml。
(3)1.0mol/L Tris-HCl pH 6.8:12.14g Tris用80ml水溶解后,HCl调pH至6.8,加水至100ml。
(4)Tris-甘氨酸电泳缓冲液:25mmol/L Tris,250mmol/L 甘氨酸,0.1%SDS。可配成5×储备液,900ml水中溶解15.1g Tris碱和94g 甘氨酸,然后加入50ml(w/v)10%SDS,用水补至1 000ml。
(5)其他试剂:10%过硫酸铵(去离子水配制,4℃储存,1周内使用)、TEMED、10%SDS、70%乙醇。
2.设备 离心机、冰箱、摇床、电泳系统。
【操作步骤】
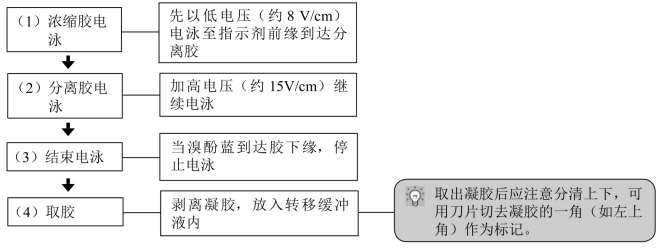
1.制备凝胶
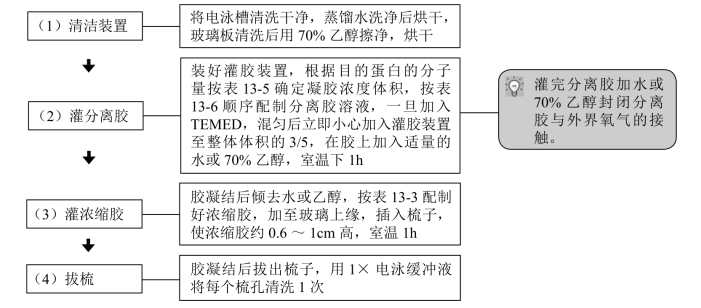
表13-5 SDS-PAGE胶的有效分离范围
注:丙烯酰胺与N',N'-亚甲叉双丙烯酰胺摩尔比为29∶1
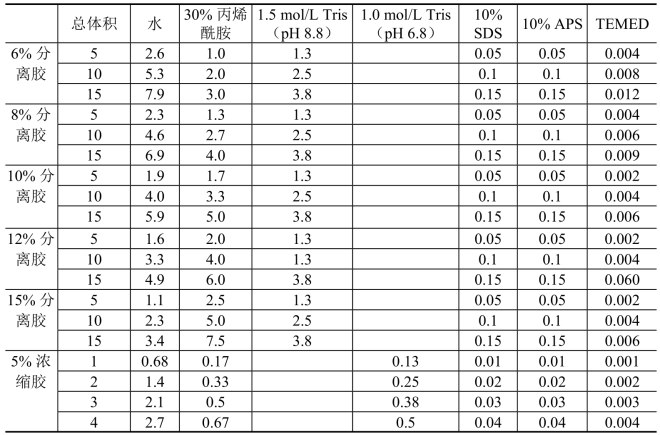
表13-6 Tris-甘氨酸SDS-PAGE电泳分离胶与浓缩胶所用溶液(ml)
2.上样
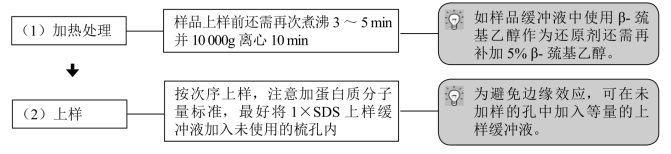
3.电泳
【注意事项】
1.未聚合的丙烯酰胺具有神经毒性,可以经皮肤、呼吸道等吸收,操作时应该戴手套等防护。
2.形成凝胶的试剂要有足够的纯度,激活剂的浓度适当,不仅可以决定凝胶聚合的速度,也将影响凝胶的质量,聚胶时的温度也将影响凝胶聚合的速度。因此,建议要根据不同温度适量增减激活剂的用量,以保证分离胶从加入激活剂起至开始出现凝胶凝聚的时间为15~20min最佳,对于浓缩胶,最佳聚合时间为8~10min。
3.梳子插入浓缩胶时,应确保没有气泡,可将梳子稍微倾斜插入以减少气泡的产生,梳子拔出来时应该小心,不要破坏加样孔,如加样孔上的凝胶歪斜,可用针头插入加样孔中纠正,但要避免针头刺入胶内。
4.电泳槽内加入电泳缓冲液冲洗清除黏附在凝胶底部的气和未聚合的丙烯酰胺,同时建议低电压短时间的预电泳,清除凝胶内的杂质,疏通凝胶孔径以保证电泳过程中电泳的畅通(恒压10~20V,20~30min)。
5.加样的量要合适,避免超载。免疫印迹杂交的敏感与检测系统有关。因此,凝胶电泳时的蛋白上样量应该保证被检测抗原量(即蛋白量)不至于太低,如果过低应该重新纯化和浓缩使用,或者建议做一次梯度稀释,上样电泳后,直接考马斯亮蓝染色选择最佳上样量(图13-3),纯化和浓缩的蛋白质样品必须注意盐的浓度过高,可平衡一下盐的浓度,如透析。
6.对许多蛋白质而言,电泳速度越大则电泳条带越清晰,但电流太大,玻璃板会受热而破裂。
7.为减少蛋白质条带的扩散,上样后应尽快进行电泳,电泳结束后也应直接染色或者转印。

图13-3 不同上样量的电泳结果图
a. 上样量太多;b. 上样量太少;c. 上样量合适
三、电转移
【材料】
1.试剂
(1)转移缓冲液:含25mmol/L Tris碱,0.2mol/L 甘氨酸,20%甲醇(pH 8.5)。
(2)1 000ml转移缓冲液的配制:称取2.9g甘氨酸、5.8g Tris碱、0.37g SDS,加入200ml甲醇,加水至总量为1 000ml。
2.设备 电转移系统。
【操作步骤】
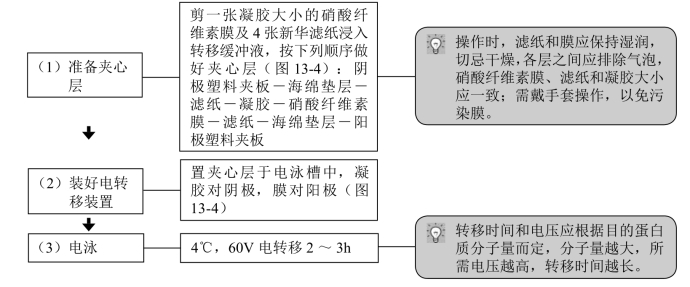
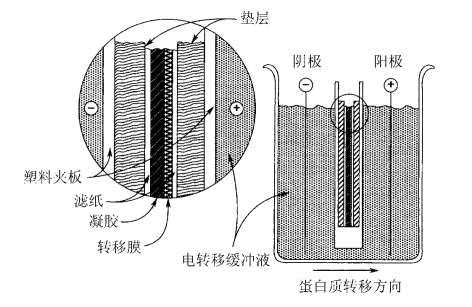
图13-4 夹心层示意图
【注意事项】
1.戴手套,避免用手接触滤纸、凝胶和膜,因为手上的油脂会阻断转印。
2.滤纸和膜的尺寸与凝胶大小一致,并要精确对齐,防止短路。并要排去滤纸、胶和膜间的气泡。
3.以适量的转移缓冲液室温平衡滤纸、凝胶和膜15~30min,如果是PVDF膜,必须先用甲醇激活后浸泡。
4.方向正确:转膜时应依次放好凝胶与膜所对应的电极,即凝胶对应负极,膜对应正极。
5.电转时间:100V 1~2h,可根据蛋白分子量的大小灵活选择。
6.转移结束后,凝胶用考马斯亮蓝染色以确定转移效率。
7.膜可用丽春红染色观察蛋白分子量标准的位置。
8.转膜时可以对膜剪去一角(如左上角)做上标记,以分清正反面和上下关系。
四、抗体反应和显色反应
【材料】
1.试剂
(1)10×TBS:24.2g Tris碱,80g NaCl,加入800ml 水,用HCl调pH至7.6,加水至1 000 ml。
(2)封闭缓冲液:1×TBS,0.1% Tween-20,5%(w/v)脱脂奶粉。
(3)TBST:1×TBS,0.1% Tween-20。
(4)抗体孵育液:封闭缓冲液中按抗体说明书的效价比加入相应的一抗或二抗。
(5)其他试剂:待测蛋白质的抗体、HRP标记的二抗、化学发光试剂(使用前0.5 h将A、B液混合)、显影液、定影液。
2.设备 X线胶片、带增感屏的X线暗盒、暗室与安全灯等。
【操作步骤】
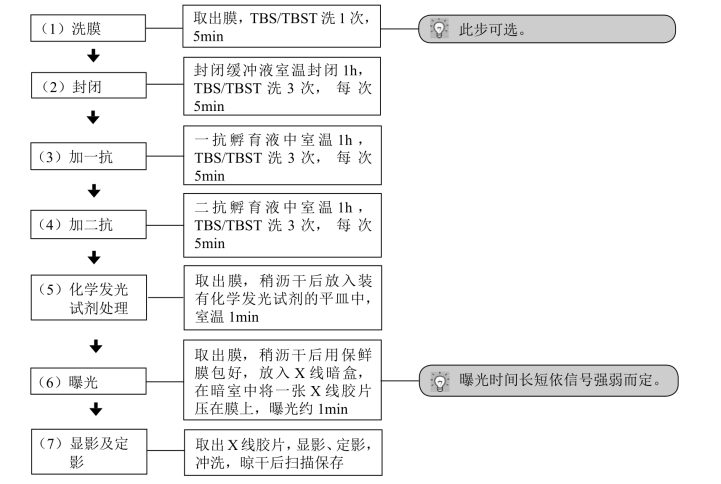
【注意事项】 辣根过氧化物酶(HRP)-标记的二抗显色系统有多种,目前最常用的是鲁米诺(luminol)化学发光系统,其灵敏度高、结果稳定,有商品供应。
五、结果分析
(一)实验结果分析
根据曝光显示的条带的有无、强弱,对照蛋白质分子量标准参照物的迁移距离,可判定目的蛋白的有无及量的多少。利用“自动灰度扫描仪”扫描条带,计算积分光密度值,以内参照(如管家基因β-actin)蛋白质条带的积分光密度为校正值,可以进行半定量分析。
图13-5是转膜前后的Western blotting实验结果图,图中箭头所指即为目的蛋白所在位置,分子量约为75kD。
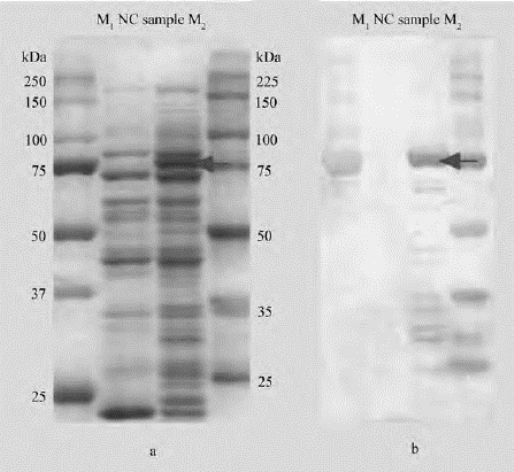
图13-5 蛋白质Western blotting实验图
a. 转膜前;b. 转膜后M1:Color Marker;NC:阴性对照;sample:样品;M2:His-Tag Marker
(二)常见问题及解决方案
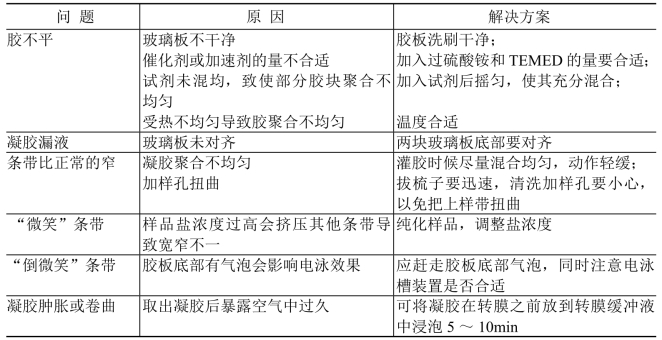
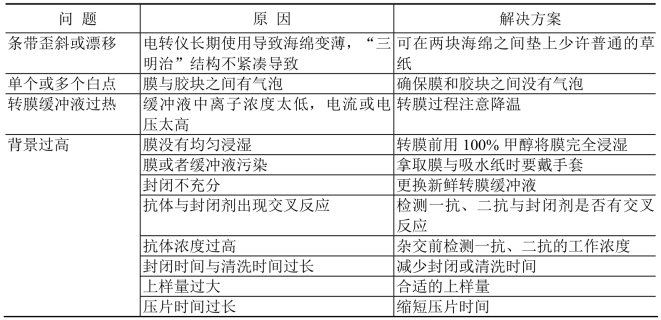
见表13-7。
表13-7 Western Blotting常见问题及解决方案
(续表)
(刘安玲)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














