一、双缩脲法
(一)实验目的
1.了解双缩脲法测定蛋白质浓度的基本原理。
2.熟悉双缩脲法测定蛋白质浓度的实验方法。
(二)实验原理
凡具有两个或两个以上肽键的化合物,均能在碱性溶液中与Cu2+形成紫红色络合物,即双缩脲反应,此络合物颜色的深浅与该化合物浓度成正比。蛋白质分子具有多个肽键,因此具有双缩脲反应,故可以通过比色来测定蛋白质的浓度。双缩脲反应见实验三中双缩脲反应。
(三)实验药品、实验设备
1.鸡蛋清:鸡蛋清用蒸馏水稀释,使其蛋白质浓度在标准曲线测试范围内。
2.10g/L酪蛋白标准液:酪蛋白要预先用微量凯氏定氮法测定蛋白质含量,再根据其纯度称量,用0.05mol/L氢氧化钠溶液配制。
3.双缩脲试剂:精确称取五水合硫酸铜(CuSO4·5H2O)3.0g、酒石酸钾钠(NaKC4H4O6·4H2O)9.0g及碘化钾(KI)5.0g,各自分别溶于25mL蒸馏水中。将酒石酸钾钠溶液和碘化钾溶液倒入1000mL容量瓶中,加24%氢氧化钠溶液100mL混匀。再加五水合硫酸铜溶液,边加边摇,最后加水定容至1000mL。贮存于塑料瓶内(或内壁涂石蜡的瓶中)。此试剂可长期保存。若贮存瓶中有黑色沉淀出现,则需重新配制。
4.电热恒温水浴箱(37℃)。
5.分光光度计。
6.15mm×150mm试管8支。
7.1mL、2mL、5mL刻度吸管。
8.试管架。
9.1000mL容量瓶。
(四)实验方法
1.标准曲线的绘制
取6支试管编号,按表2-9所示顺序和剂量加入试剂。
表2-9 标准曲线的绘制
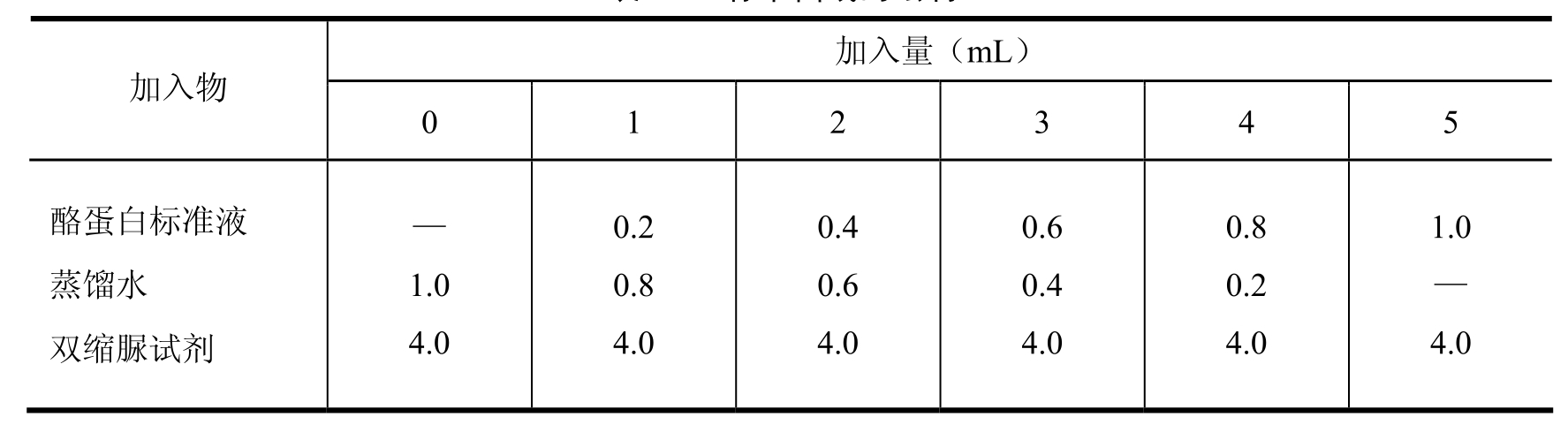
加完上述试剂后混匀,在37℃或室温下放置20min后,用分光光度计在波长540nm下,以“0”管作空白,测定各管吸光度。
以各吸光度为纵坐标,各标准蛋白浓度为横坐标,绘制吸光度-蛋白质浓度标准曲线。
2.样品测定
取两支试管编号,按表2-10所示顺序和剂量加入试剂。
充分混匀,在37℃或室温下放置20min,用分光光度计在波长540nm下,以空白管调零,测定测定管吸光度。
表2-10 样品测定

3.结果处理
根据测定管吸光度,从标准曲线上查出蛋白质的浓度,再乘以血清稀释倍数10,即为血清中的蛋白质浓度。
4.注意事项
(1)须于显色后30min内比色,30min后有雾状沉淀产生。同时注意各管从显色到比色的时间应尽可能一致。
(2)避免硫酸铜过量,否则生成氢氧化铜蓝色而掩盖紫红色,影响测定结果。
(3)待测样品若含有大量脂肪物质,会产生混浊的反应混合物,亦影响测定结果。这时可用乙醇或石油醚使溶液澄清后离心,取上清液再测定。
(4)双缩脲反应并非蛋白质特有的颜色反应,凡有肽键的物质均干扰此反应。
(五)实验记录
1.吸光度-蛋白质浓度标准曲线的绘制。
2.实验记录:

(六) 思考题
1.干扰本实验的因素有哪些?
2.双缩脲法有何特点?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















