第五节 DNA和蛋白质互作的研究方法
DNA和蛋白质是自然界中的两大生命物质,二者之间相互作用的研究是21世纪生命科学领域的研究热点。研究DNA与蛋白质相互作用有助于深入地探讨基因启动子的结构与功能,研究DNA与蛋白质转录因子之间的相互作用,揭示mRNA转录起始和终止的调控机制,对于阐明在个体生物生长发育过程中基因表达的时空调节机制以及外源基因在转基因植株中表达的分子机理等方面具有重要作用。常用的分析DNA和蛋白质相互作用的方法有酵母单杂交、染色质免疫共沉淀、凝胶阻滞试验、DNaseⅠ足迹试验、甲基化干扰试验以及体内足迹试验等。
一、酵母单杂交技术
酵母单杂交体系自1993年由Wang和Reed创立以来,在生物学研究领域中已显示出巨大的威力。应用酵母单杂交体系已验证了许多已知的DNA与蛋白质之间的相互作用,同时发现了新的DNA与蛋白质的相互作用,并由此找到了多种新的转录因子。
酵母单杂交技术通过对酵母细胞内报告基因表达状况的分析来鉴定DNA顺式作用元件与转录因子的结合情况,通过筛选DNA文库获得与靶序列特异结合的蛋白质基因序列。大多数转录因子含有DNA结合结构域(DNA-bindingdomain,BD)和转录激活结构域(activation domain,AD),两结构域可独立发挥作用。据此设计携带有编码“靶蛋白”的文库质粒,将文库蛋白编码基因置换酵母原有转录因子GAL4的DNA结合结构域,并通过表达的“靶蛋白”与目的基因相互作用来激活RNA聚合酶,启动下游报告基因的转录。
该系统的优点是方法简单,仅需基因操作,无需蛋白质分离、纯化操作;筛选到的蛋白质是在体内相对天然条件下有结合功能的蛋白质,更能体现真核内基因表达调控的真实情况;表型和基因型结合,可直接获得基因;方法灵敏,可鉴定到以微弱亲和力相互结合的DNA和蛋白质。局限性表现为DNA与蛋白质的相互作用定位于核内,易产生假阳性和假阴性;某些与靶基因相互作用的蛋白质可能对酵母本身有毒性;不能研究与内源性酵母激活蛋白相互作用的结合位点。
酵母单杂交的基本操作过程:
(1)设计含目的基因(称为诱饵)和下游报告基因的质粒,并将其转入酵母细胞。
(2)将文库蛋白的编码基因片段与GAL4转录激活域融合表达的cDNA文库质粒转化入同一酵母中。
(3)若文库蛋白与目的基因相互作用,可通过报告基因的表达将文库蛋白的编码基因筛选出来。在这里作为诱饵的目的基因就是启动子DNA片段,文库基因所编码的蛋白就是启动子基因结合蛋白。
二、染色质免疫沉淀技术
染色质免疫沉淀技术(chromatin immunoprecipitation)简称CH IP技术,是研究体内蛋白质与DNA相互作用的一种技术。其基本原理是:在生理状态下把细胞内的DNA与蛋白质交联在一起,通过超声或酶处理将染色质切为小片段后,利用抗原抗体的特异性识别反应,将与目的蛋白相结合的DNA片段沉淀下来。
染色质免疫沉淀技术一般包括细胞固定、染色质断裂、染色质免疫沉淀、交联反应的逆转、DNA的纯化以及DNA的鉴定。
1.细胞固定:一般使用甲醛进行固定和交联。甲醛终浓度为1%,交联时间通常为5分钟到1小时,具体时间根据实验而定。
2.染色质断裂:固定交联后的染色质可被超声波或Micrococcal nuclease切成约500bp的片段,用琼脂糖凝胶电泳检测。目的是为了暴露目标蛋白,利于抗体识别。
3.染色质免疫沉淀:在进行免疫沉淀前,首先需要取一部分断裂后的染色质做Input对照。目的是验证染色质断裂的效果,根据Input中靶序列的含量以及染色质沉淀中靶序列的含量,按照取样比例换算出CH IP的效率。
利用目的蛋白质的特异抗体通过抗原-抗体反应形成DNA-蛋白质-抗体复合物,然后使用Agarose beads或Magna beads沉淀其复合物,特异性地富集与目的蛋白质结合的DNA片段。再经过多次洗涤,除去非特异结合的染色质,用SDS和NaHCO3洗脱免疫沉淀复合物。
染色质免疫沉淀所选择的目的蛋白质的抗体是CH IP实验成功的关键。只有经过CH IP实验验证后的抗体才能确保实验结果的可靠性。
在ChIP实验中,一定要做好实验对照。阳性抗体通常选择与已知序列相结合的、比较保守的蛋白抗体,常用组蛋白抗体或RNA Polymerase II抗体等。阴性抗体通常选择目的蛋白抗体宿主的IgG或血清。将目的蛋白抗体的结果与阳性抗体和阴性抗体的结果相比较,才能得出正确结论。另外,还应考虑目的蛋白抗体与DNA非特异性结合的可能,所以通常还会选择一对阴性引物,即目的蛋白肯定不会结合的DNA序列,作为该抗体的阴性对照。最佳的阴性对照引物是在靶序列上游的一段与目的蛋白肯定不能结合的序列。
4.交联反应的逆转和DNA的纯化:用不含DNase的RNase和Proteinase K,65℃保温6小时逆转交联,经DNA纯化柱回收DNA或用酚氯仿抽提、乙醇沉淀纯化DNA。
5.DNA的鉴定:最常用的DNA的鉴定方法是PCR和凝胶电泳。
三、凝胶阻滞试验
凝胶阻滞试验又叫DNA迁移率变动试验,是20世纪80年代初出现的用于在体外研究DNA与蛋白质相互作用的一种特殊的凝胶电泳技术。其方法简单、快捷,是当前被选作分离纯化特定DNA结合蛋白质的一种典型的实验方法。
凝胶阻滞试验的基本原理:在凝胶电泳中,由于电场的作用,裸露的DNA朝正电极移动的距离与其分子量的对数成反比,如果DNA分子已结合一种蛋白质,那么由于分子量加大,在凝胶中的迁移作用便会受到阻滞,朝正电极移动的距离也就相对缩短。所以当特定的DNA片段同细胞提取物混合后,若其在凝胶电泳中的移动距离变小,这就说明它已同提取物中的某种特殊蛋白质分子发生了结合作用。
凝胶阻滞试验方法(图3-12):
(1)用放射性同位素标记待检测的DNA片段(亦称探针DNA);
(2)标记的DNA片段同细胞蛋白质提取物一同温育;
(3)非变性的凝胶中电泳,控制使蛋白质仍与DNA保持结合
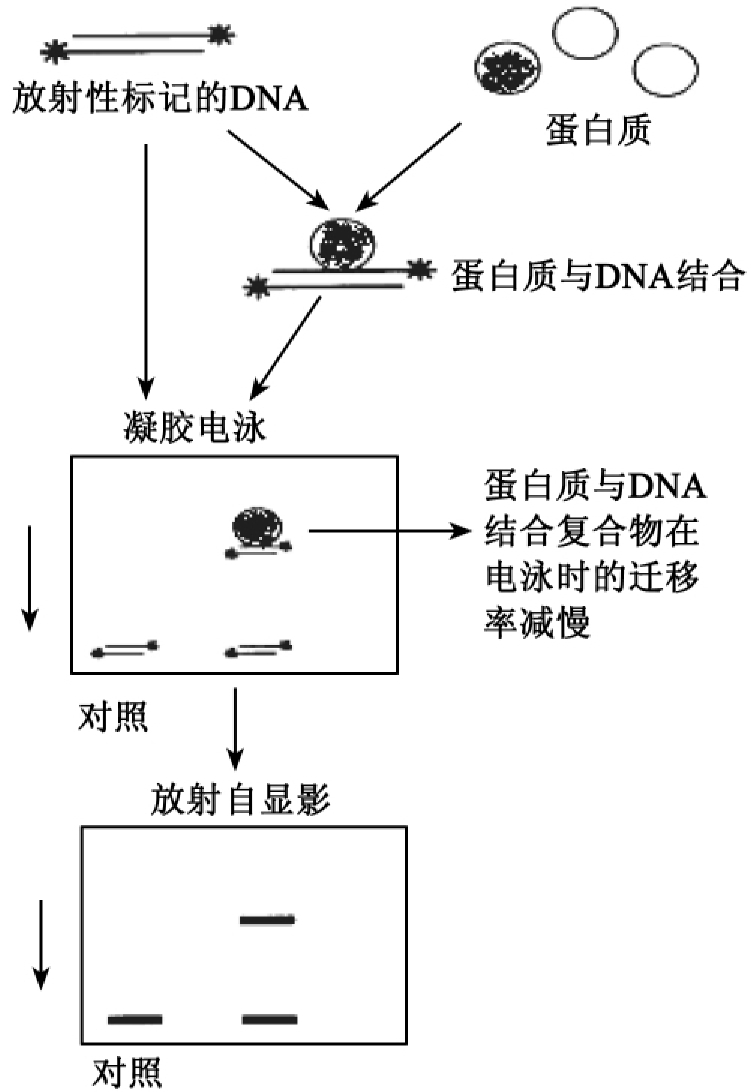
图3-12 凝胶阻滞试验流程图
状态的条件下进行电泳分离;
(4)放射自显影技术显现具放射性标记的DNA条带位置。
该实验的注意事项有以下几点:①高质量核蛋白的获得是实验的关键。实验中各个步骤均要求在冰上进行,同时缓冲液要求现用现配。②DNA与蛋白质在体外结合的时间不宜过长,一般在30分钟左右,避免假阳性产生。③溴酚蓝会影响蛋白质与DNA之间的相互作用,建议只在阴性对照中加入溴酚蓝作为指示剂。④电泳时电压不宜过高,最好在冰上进行,避免电泳时产生的热量导致蛋白质与DNA的解离。
四、DNaseⅠ足迹试验
凝胶阻滞试验能够揭示出在体内发生的DNA和蛋白质之间相互作用的有关信息,但是无法确定两者结合的准确部位。DNaseⅠ足迹试验(footprinting assay)是一类用于检测与特定蛋白质结合的DNA序列的部位及特性的专门实验技术。
DNaseⅠ足迹试验的步骤:首先将待检测的双链DNA分子用32 P作末端标记,并用限制酶去掉其中的一个末端,得到仅一条单链末端标记的双链DNA分子,体外与细胞蛋白质提取物混合。之后,加入少量的DNaseⅠ消化DNA分子。如果蛋白质提取物中不存在与DNA结合的特异蛋白质,经DNaseⅠ消化后便会产生出距放射性标记末端1个核苷酸、2个核苷酸、3个核苷酸等一系列前后长度仅相差一个核苷酸的、不间断的、连续的DNA片段梯度群体。去除混合物中的蛋白质,将DNA片段群体在变性聚丙烯酰胺凝胶上电泳分离,经放射自显影后便可显现出相应于DNaseⅠ切割产生的不同长度DNA片段组成的序列梯度条带。如果有蛋白质结合到DNA分子的某一特定区段上,在该蛋白质的保护下,这一区段的DNA将免受DNaseⅠ的消化,因而也就不可能产生出相应长度的切割条带。所以在电泳凝胶的放射自显影图片上,相应于蛋白质结合的部位是没有放射标记条带的,出现了一个空白的区域,人们形象地称为“足迹”(图3-13)。
五、甲基化干扰实验(DMS足迹实验)
硫酸二甲脂(DMS)足迹实验的原理: DMS能够促进DNA中裸露的G甲基化,而六氢吡啶又会对甲基化的G残基作特异的化学切割。如果蛋白质同DNA分子中的某一区段结合,在它的保护下,区域内的G碱基将免受六氢吡啶的切割。于是在DNA片段的序列梯中,便不存在具有这些G残基末端的DNA片段,故出现空白区域——足迹。由于DMS足迹试验中被切割的是G残基,因此,可用来鉴定同转录因子蛋白质结合的DNA区段中的特异碱基。

图3-13 DNaseⅠ足迹试验原理的图解
DMS足迹实验的基本步骤:首先用硫酸二甲脂(DMS)处理靶DNA,控制反应条件,使平均每条DNA分子只有一个G甲基化,然后将这些局部甲基化的DNA群体同蛋白质温育,并做凝胶阻滞试验。经电泳分离后,从凝胶中切取出具有结合蛋白质的DNA条带和没有结合蛋白质的DNA条带,并用六氢吡啶处理,于是甲基化的G残基被切割,非甲基化的G残基则不被切割。六氢吡啶只能切割没有同蛋白质结合的DNA。图3-14显示的是该方法的基本原理和操作步骤。
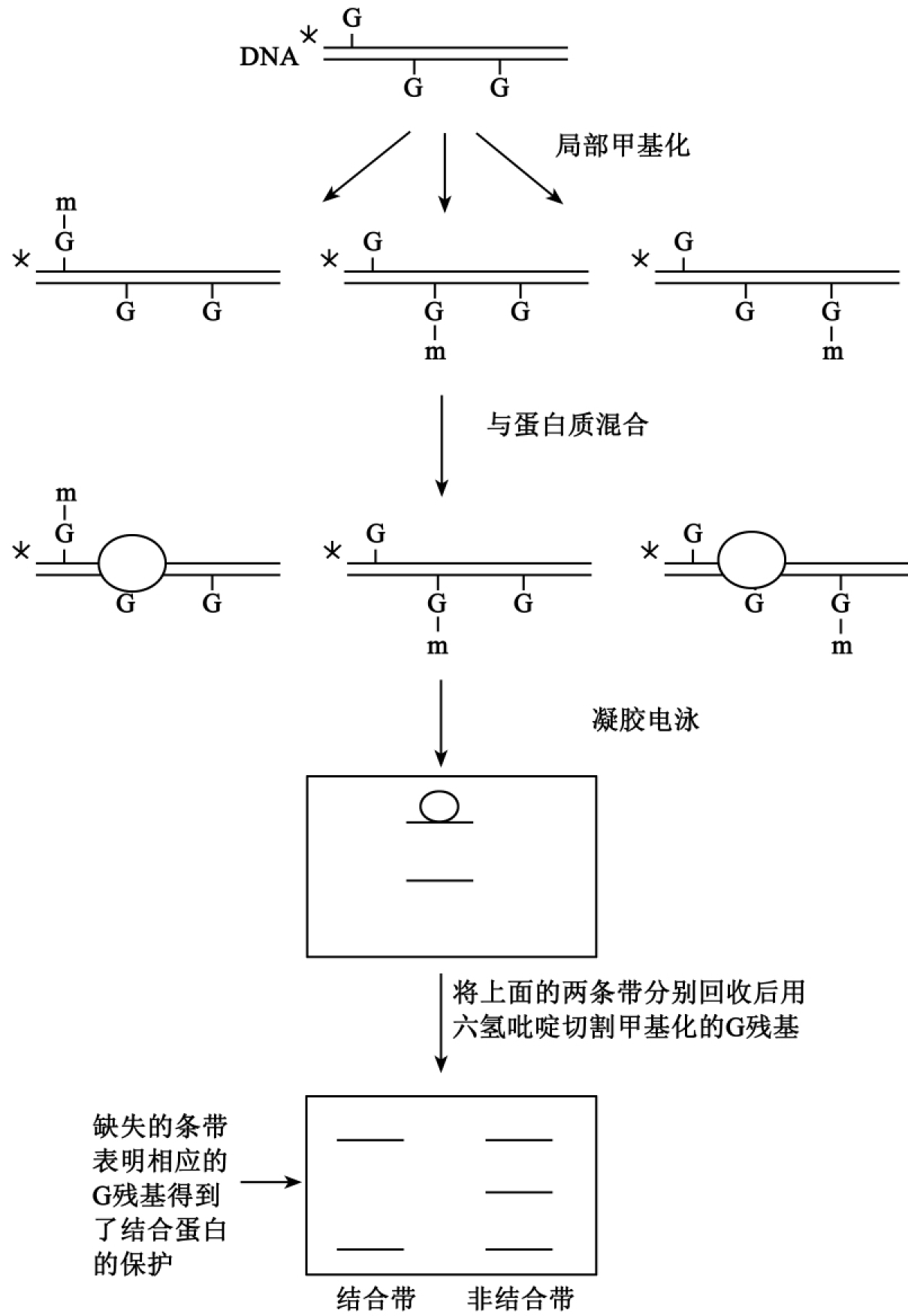
图3-14 硫酸二甲脂(DMS)足迹实验图解
六、体内凝胶阻滞实验
体内凝胶阻滞实验的基本原理与DMS足迹实验原理相似。
体内凝胶阻滞实验的方法:用DMS处理完整的游离细胞,并使其渗透到细胞内的浓度恰好导致天然染色质DNA中的G残基发生甲基化。之后提取DNA,并加入六氢吡啶作体外消化。结果是同蛋白质结合的DNA区段上的G残基不会被DMS甲基化,因而也就不会被六氢吡啶所切割。但是经体内足迹试验从染色质总DNA中所获得的任何一种特异DNA的数量都很少,需要通过PCR扩增才会获得足够数量的DNA样品。
在本节中将集中介绍CH IP技术在DNA与蛋白质相互作用研究中的应用。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















