第四节 基质金属蛋白酶及其抑制剂在肿瘤侵袭转移中的作用
(一)基质金属蛋白酶家族
基质金属蛋白酶(matrix metalloproteinases,MMPs)是根据它们的作用底物和发现先后顺序来命名的,最初对它们的认识是它们能广泛降解细胞外基质蛋白,各种MMPs都有相对不同的底物,但存在一定的作用底物的重叠。MMPs有相同的基本结构:信号肽,引导MMPs进入分泌途径;前导肽,掩盖MMPs的活性中心,使酶不能接近底物,成为无活性的酶原形式;含锌离子的活性中心;介导与底物相互作用并决定底物特异性的血红素结合蛋白结构域;连接活性中心与血红素结合蛋白的铰链区。
目前已知有24种基质金属蛋白酶(matrix metalloproteinase,MMP),有的根据它们的底物分为5类(表11-1):①间质胶原酶类,包括MMP-1,MMP-8,MMP-13,MMP-18。②明胶酶类,包括MMP-2,MMP-9。③膜型金属蛋白酶类,包括MMP-14,MMP-15,MMP-16,MMP-17。④基质溶解素类,包括MMP-3,MMP-7,MMP-10,MMP-11,MMP-12。⑤其他,包括MMP-19,MMP-20等。也有的按功能结构域分成4类:典型的MMPs(archetypal),Matrilysins,明胶原酶(gelatinase)和convertase-activatable MMPs。虽然大多数MMPs是一类分泌蛋白,但有一类膜型MMPs(MT-MMPs)它们通过跨膜结构域或糖基磷酸肌醇锚定于细胞表面。
表11-1 肿瘤相关的基质金属蛋白酶(MMP)*
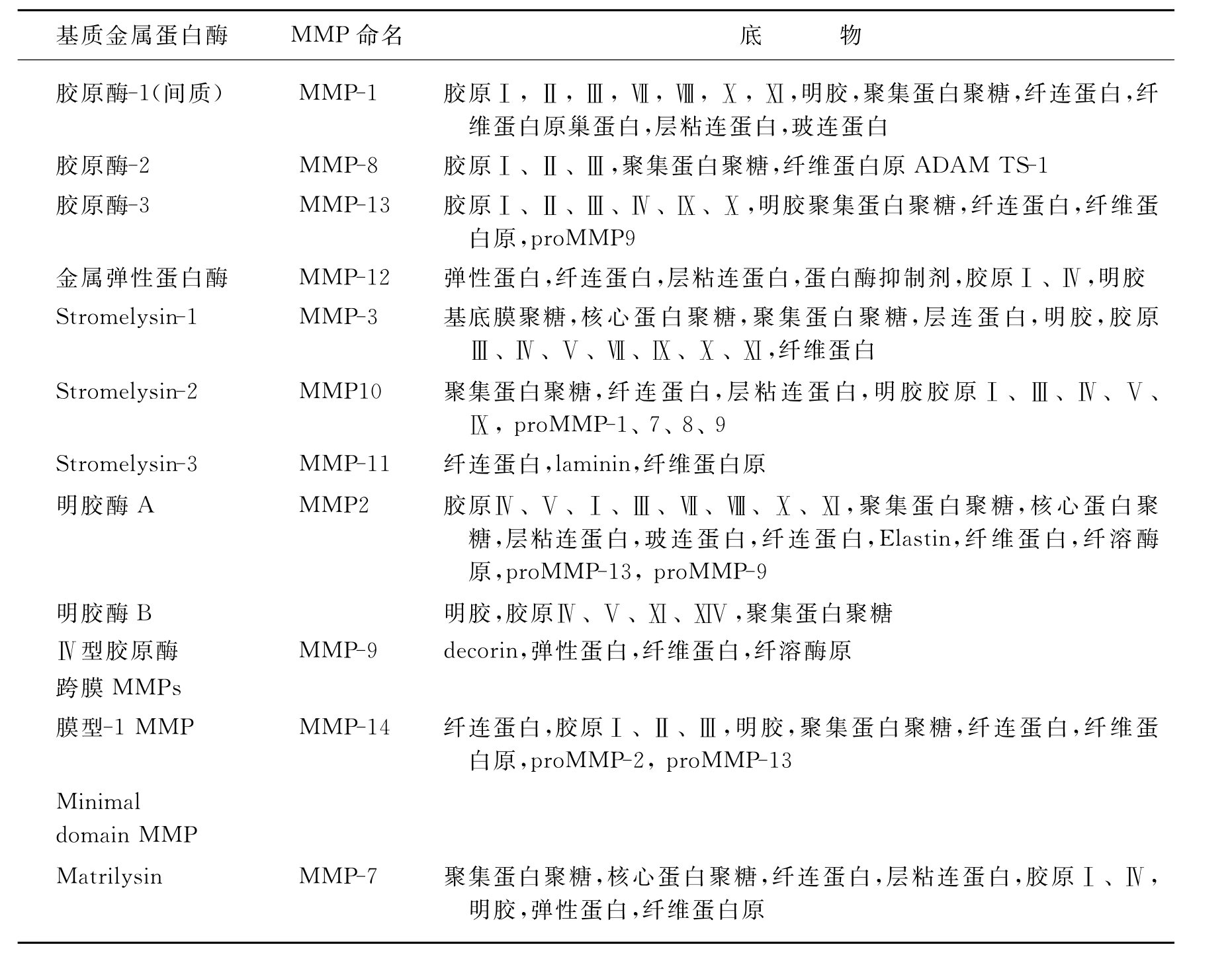
注:*本表所列的是主要几种涉及侵袭转移的MMPs。
另外有2个称为disintegrin与metalloproteinase(ADAM)和具有thrombospondin基元的ADAM(ADAMTS)也含有金属蛋白酶活性,并能降解细胞外基质成分。虽然ADAMs是细胞膜蛋白,作用于细胞表面分子,但ADAMTS是分泌型内肽酶。
(二)基质金属蛋白酶抑制剂家族
TIMP是MMPs的特异性抑制剂(tissue inhibitor of MMP)、抑制MMPs水解细胞外基质降解活性。目前已知TIMP有4个成员,分别称为TIMP-1、TIMP-2、TIMP-3和TIMP-4,通常TIMP与酶原形式的proMMPs结合成1∶1复合物,从而阻止proMMPs的激活,也能直接抑制MMP的活性。
(三)MMPs活性的调节
有3种方式:①MMPS活性的调节发生在转录水平,通过生长因子、细胞因子、肿瘤促进因子,例如TNF-α、IL-1、TGF-β和retinoids。②也发生在翻译后水平即酶原激活水平。MMPs激活是复杂的,需要协调细胞内、细胞表面和细胞外蛋白酶的家族成员,大多数MMPS都以无活性的酶原形式被细胞合成,要通过另一些MMPs(MT1-MMPs、MMPs)或其他蛋白酶(纤溶酶,Chymase、Tryptase)在细胞外切开肽键而激活。③MMPs调节的另一种方式,是通过它们的内源性抑制剂、MMPs组织抑制剂(TIMP)。
蛋白酶活性的调节是通过对蛋白酶的精确定位、细胞和器官特异性表达和分泌的蛋白酶重新定位到细胞的特异部位。由于分泌的MMPs与细胞表面的MT-MMPs之间形成复合物和MMPs结合于细胞黏附分子,使MMPs水解蛋白质的活性高度局限在肿瘤细胞与基质之间的接触表面。最近研究发现TIMP-2可以作为MMP-2的激活剂,当一分子MT1-MMPs与一分子TIMP-2结合,再与pro-MMPs-2结合形成三分子复合物,然后,后者被邻近的未结合的TM1-MMPs(可能以寡聚体)激活。三分子复合物机制是MMP-2激活的主要机制,MMP-2是一种明胶酶(称Ⅵ型胶原酶或明胶酶A),在许多肿瘤中都增强表达。MT1-MMPs和TIMP-2基因敲除的小鼠其pro-MMP-2的激活受损,在功能上,MMPs的过表达能增强转基因小鼠原发肿瘤的发展和生长,MMP敲除小鼠常显示成瘤后的发展减弱,例如,无MMP表达的小鼠,HPV诱发的鳞状细胞癌的发生和SV-40引起的胰岛细胞癌的生长减弱,无MMP-2小鼠的血管生成和肿瘤的进展减弱。
除了MT-MMPs外,在细胞基质接触表面,细胞黏附分子可以作为MMP定位的锚。首先在新生成的血管和肿瘤侵袭前沿观察到αvβ3和MMP-2的共定位。αvβ3与MMP-2的这种相互作用提示它们涉及在细胞表面与另一个整合素α2β1相结合的MMP-2的激活调节,α2β1与MMP-2和胶原相结合,提供随后的膜激活的储备库。据报道透明质酸结合蛋白CD44,促进肿瘤细胞的移动和侵袭,能将MMP-9锚定到细胞表面双双被定位在细胞侵袭前沿,这些细胞黏附分子是否在功能上贡献于转移过程中界面间的蛋白水解作用,还没有确定。用模拟转出血管过程的内皮细胞移动试验的研究证明,黏附分子和MMPs参与肿瘤细胞转出血管过程中,产生蛋白水解酶聚焦区带,MMPs的定位和MMP介导的基质降解在肿瘤细胞侵袭前沿,可见MT1-MMP是一个关键分子,肿瘤细胞中蛋白水解作用的定位需要存在于不同部位的(细胞内、膜结合和细胞外基质)多种蛋白酶和黏附分子活性的协调作用。许多实验研究和临床观察证据都表明MMPs与肿瘤细胞的侵袭转移存在密切关系。
(四)金属蛋白酶(MMPs)和它的抑制剂(TIMPs)在肿瘤侵袭转移中的作用
MMPs对肿瘤侵袭转移的作用表现在几个方面,最主要的是直接降解细胞外基质,其次是影响肿瘤细胞新生血管的形成,第三是影响细胞黏附。
1.MMPs降解细胞外基质成分 肿瘤细胞向周围组织侵袭和随后的远处转移,首先要破坏起固定作用的细胞外基质网络,才能向其周围进行侵袭、移动。MMPs能够降解所有的细胞外基质成分,在癌症中,特别强调MMP-2和MMP-9对Ⅳ型胶原的降解,因为Ⅳ型胶原是基膜的主要成分。
proMMP-2在正常组织中有广泛表达,但几乎都是没有活性形式的MMP-2,相反在恶性肿瘤中活性MMP-2显著升高。1992年Parsons等用原位杂交分析检测了活检样品,发现12例肿瘤标本10例有MMP-2表达,而在非肿瘤区域没有MMP-2的表达,而且肿瘤细胞周围的基质MMP-2染色比肿瘤细胞更强。
北京大学基础医学院的方伟岗等多年来对基质金属蛋白酶与肿瘤侵袭转移的关系进行了比较系统的研究,他们发现不同转移能力的癌细胞系产生MMP-2和MMP-9的能力与其侵袭转移能力相关。他们用反义cDNA技术抑制MMP-9基因的表达能够逆转肿瘤侵袭转移表型,他们用转移能力强的黑色素瘤细胞WM451作模型,转染MMP-9的反义cDNA后,其MMP-9的活性和体外侵袭能力都显著降低。他们用正义MMP-9cDNA四环素负调控反转录病毒表达载体转染原先不表达MMP-9、也无转移能力的黑色素瘤WM35细胞,用Western Blot、Zymography和体外侵袭模型进行分析,结果发现转入正义MMP-9cDNA的WM35细胞其MMP-9的表达和活性从阴性转为阳性,软琼脂集落形成数目增加,体外侵袭试验中穿越Matrigel的细胞数明显增多,而转染反义MMP-9cDNA、MMP-9高表达、高转移能力的黑色素瘤WM451细胞正好相反。在加入四环素以后,无论是正义还是反义MMP-9cDNA的表达都受到抑制,转染正义与反义MMP-9cDNA细胞的表型都回复到与未转染的对照细胞相同的表型,说明MMPs在肿瘤侵袭转移中的重要作用。
Powell等用MMP-7cDNA转染无转移能力的人前列腺癌细胞DU-145使其过表达MMP-7,并以空载体转染DU-145作对照,然后将它们分别接种到裸小鼠腹腔内,观察其转移情况发现,9只接种转染空载体的细胞的小鼠仅有1只小鼠有转移(占11%),而18只接种转染MMP-7cDNA的细胞的小鼠有12只小鼠有转移(占66%)。
最近,Soulie P等报道将四环素可调控的人MT1-MMP cDNA表达质粒转染狗肾上皮细胞,在没有四环素存在的条件下,MT1-MMP被诱导表达,出现外源MMP-2的激活,大囊肿形成和在胶原基质上的侵袭性增加。将转染细胞皮下接种到两组裸鼠体内,其中给予四环素的一组裸鼠,MT1-MMP的表达受到抑制,一组裸鼠不给予四环素,MT1-MMP表达没有受到抑制,没有给予四环素的一组接种17只裸鼠,结果有11只(65%)裸鼠出现移植瘤,而接受四环素一组接种9只裸鼠,结果仅有2只(22%)裸鼠出现移植瘤(P<0.05)。移植瘤有散布在高细胞基质中的管状结构组成,并侵袭到邻近的肌肉层,没有确定的边界。这一结果显示在非恶性狗肾上皮细胞中单就MT1-MMP的条件表达就足以使侵袭的肿瘤形成。
2.MMPs对血管新生的作用 新生血管形成是一个非常复杂的过程,包括毛细血管内皮层下基膜降解、内皮细胞迁移和增殖、新生血管和新的基膜的形成等一系列过程。基膜的降解和新的基膜的形成都涉及到蛋白水解酶系统,在新生血管形成和肿瘤侵袭转移过程中,无论是内皮细胞还是肿瘤细胞都增强分泌蛋白水解酶。Fang J等用外源性的MMP-2的抑制剂或反义核酸均能导致肿瘤细胞蛋白水解能力下降和新生血管形成能力的丧失,使肿瘤体积减小70%。
Hajitou A等用反转录病毒载体介导的基因转移技术研究了TIMP-2过表达对乳腺肿瘤发生发展的影响,用的肿瘤细胞是EGF43.Fgf-4,能过表达血管内皮生长因子,在体外TIMP cDNA转染的FGF43.fgf-4,生长率增加,但是当接种到纯种小鼠后,TIMP过表达细胞的生长受到阻滞,接种后17天移植瘤的体积比对照组小鼠减少了80%,在体内体外都发现TIMP过表达引起VEGF表达的下调,在诱发肿瘤中,血管大小、密度和血液供应都减少。表明TIMP过表达阻滞乳腺肿瘤的生长和血管生成。
Plaisier M等分析了人子宫内膜微血管和包皮微血管内皮细胞(hEMEEC和hFMVEC)蛋白酶包括u-PA、MMPs和TIMP的表达以及它们在毛细血管形成中的作用。发现u-PA和MMP表达的抑制能减少在纤维蛋白或纤维蛋白/胶原中管状结构的形成,hEMVEC表达各种MMP mRNA和蛋白质,特别是MMP-1、MMP-2、MT1-MMP、MT3-和MT4-MMP,hEMVEC表达的MT3-和MT4-MMP显著高于FMVEC。免疫组化证实子宫内膜组织内皮细胞中存在MT3-MMP、TIMP-1或TIMP-3,与腺病毒表达载体转染hEMVEC减少管状结构形成的程度相当,而仅有TIMP-3能够抑制hFMVEC形成管状结构。
3.MMPs对细胞黏附的作用 在本章第三节中已经讨论过肿瘤细胞之间及肿瘤细胞与宿主细胞之间、肿瘤细胞与周围细胞基质之间的黏附在肿瘤侵袭转移中的重要作用,在第四节(三)中讨论MMPs激活的机制时也已经提到整合素在MMPs激活中的作用。
(五)测定MMPs的临床意义
Torii A等研究胃癌患者的MMP-9血浆浓度后发现,胃癌患者血浆中MMP-9的浓度显著高于正常人对照组,手术后的浓度低于手术前,早期胃癌患者的MMP-9检出阳性率的平均值显著高于正常人,因此,他们认为测定血浆MMP-9的浓度可以作为原发或胃癌复发的指标,也可用于估计胃癌的进展程度。
Berend KR等对16例石蜡包埋的软骨肉瘤的标本用RT-PCR测定MMP-1/TIMP-1和MMP-2/TIMP-2的cDNA,并计算MMP-1/TIMP-1和MMP-2/TIMP-2cDNA的比率,复发患者的MMP-1/TIMP-1比率平均为0.939无复发患者平均为0.703(P<0.003);MMP-2/TIMP-2比率平均为1.814,无复发患者平均为1.473(P<0.05)。高比率有较差的预后。
有的研究显示MMP的特异性抑制剂TIMP具有更强的预后价值。Ree AH等分析了34例原发性乳腺癌患者TIMP-1和TIMP-2mRNA表达与几种预后参数和临床治疗效果之间的关系,发现高水平的TIMP-1mRNA与淋巴结转移(P=0.0067)、远距离转移(P=0.014)、早期死亡率(P=0.02)显著相关联;高TIMP-2mRNA表达同远距离转移瘤的发展相关联(P=0.0055)。然而TIMPS的mRNA水平与肿瘤的大小、甾体激素受体状态、患者年龄、肿瘤演进分期之间都没有发现有相关性,这些结果提示TIMP-1和TIMP-2mRNA高表达水平与乳腺癌转移的发生存在紧密关系。
(朱运松)
参考文献
1.徐韶华,廖劲晖,朱运松.尿激酶受体反义RNA抑制人乳腺癌细胞的侵袭作用.中国生物化学与分子生物学报,2000,16(6):814~819
2.廖劲晖,徐韶华,朱运松,等.尿激酶受体反义RNA抑制人肺癌细胞的侵袭作用.中华病理学杂志,2001,30(5):357~360
3.方伟岗,李红梅,孔灵玲,等.肿瘤侵袭转移过程中基质金属蛋白酶作用机制系列研究.北京大学学报(医学版),2003,35(4):441~443
4.Schmitt M,Wilhelm O G,Reuning U.et al.The urokinase plasminogen activator system as a novel target for tumor therapy.Fibrinolysis,2000,14(2/3):114~132
5.Sasaki H,Moriyama S,Nakashima Y,et al.Expression of the MTA-1mRNA in advanced lung cancer.Lung Cancer,2002,35(2):149~154
6.Ow K,Delprado W,Fisher R,et al.Relationship between expression of the KAI-Ⅰmetastasis suppressor and other markers of advanced bladder cancer.J Pathol,2000,191(1):39~47
7.Mahoney MG,Simpson A,Jost M,et al.Metastasis-associated protein(MTA)1enhances migration,in-vasion,and anchorage-independent survival of immortalized human keratinocytes.Oncogene,2002,28:21(14):2161~2170
8.Hartsough MT,Steeg PS.Nm23/nucleoside diphosphate kinase in human cancers.J Bioenerg Biomembr,2000,32(3):301~308
9.Geradts J,Maynard R,Birrer MJ,et al.Frequent loss of KAI-Ⅰexpression in squamous and lymphoid ne-oplasms.An immunohistochemical study of archival tissues.Am J Pathol,1999,154(6):1665~1671
10.Yang X,Wei L,Tang C,et al.KAI-Ⅰprotein is down-regulated during the progression of human breast cancer.Clin Cancer Res.2000,6(9):3424~3429
11.Bremnes RM,Veve R,Gabrielson E,et al.High-throughput tissue microarray analysis used to evaluate biology and prognostic significance of the E-cadherin pathway in non-small-cell lung cancer.J Clin Oncol,2002,20(10):2417~2428
12.Jackson P,Kingsley EA,Russell PJ.Inverse correlation between KAI-ⅠmRNA levels and invasive be-haviour in bladder cancer cell lines.Cancer Lett,2000,156(1):9~17
13.Cambier S,Mu DZ,O’Connell D,et al.A role for the integrin alphavbeta8in the negative regulation of epithelial cell growth.Cancer Res,2000,60(24):7084~7093
14.Shimizu H,Koyama N,Asada M,et al.Aberrant expression of integrin and erbB subunits in breast cancer cell lines.Int J Oncol,2002,21(5):1073~1079
15.Kitajiri S,Hosaka N,Hiraumi H,et al.Increased expression of integrin beta-4in papillary thyroid carci-noma with gross lymph node metastasis,Pathol Int,2002,52(7):438~441
16.Blasi P,Carmeliet P.u-PAR:A versatile signalling orchestrator.Nat Rev Mol Cell Biol,2002,3(12):932~943
17.Andreasen PA,Egelund R,Petersen HH.The plasminogen activation system in tumor growth,invasion,and metastasis.Cell Mol Life Sci,2000,57(1):25~40
18.Reuning U,Magdolen V,Hapke S,et al.Molecular and functional interdependence of the urokinase-type plasminogen activator system with integrins.Biol Chem,2003,384(8):1119~1131
19.Soulie P,Carrozzino F,Pepper MS,et al.Membrane-type-1matrix metalloproteinase confers tumorige-nicity on nonmalignant epithelial cells.Oncogene,2005,24(10):1689~1697
20.Guo Y,Higazi AA,Arakelian A,et al.A peptide derived from the nonreceptor binding region of uroki-nase plasminogen activator(u-PA)inhibits tumor progression and angiogenesis and induces tumor cell death in vivo.FASEB J,2000,14(10):1400~1410
21.Zhu F,Jia S,Xing G,et al.cDNA transfection of amino-terminal fragment of urokinase efficiently inhibits cancer cell invasion and metastasis.DNA Cell Biol,2001,20(5):297~305
22.Rabbani SA,Gladu J.Urokinase receptor antibody can reduce tumor volume and detect the presence of oc-cult tumor metastases in vivo.Cancer Res,2002,62(8):2390~2397
23.Hapke S,Kessler H,de Prada N A,et al.Integrin alpha(v)beta(3)/vitronectin interaction affects ex-pression of the urokinase system in human ovarian cancer cells.J Biol Chem,2001,276(28):26340~26348
24.Adachi Y,Lakka SS,Chandrasekar N,et al.Down-regulation of integrin alpha(v)beta(3)expression and integrin-mediated signaling in glioma cells by adenovirus-mediated transfer of antisense urokinase-type plasminogen activator receptor(u-PAR)and sense p16genes.J Biol Chem,2001,276(50):47171~47177
25.Plaisier M,Kapiteijn K,Koolwijk P,et al.Involvement of membrane-type matrix metalloproteinases(MT-MMPs)in capillary tube formation by human endometrial microvascular endothelial cells:Role of MT3-MMP.J Clin Endocrinol Metab,2004,89(11):5828~5836
26.Wang X,Hou M,Zhu Y,et al.A hybrid protein of the amino-terminal fragment of urokinase and mutant plasminogen activator inhibitor-2efficiently inhibits tumor cell invasion and metastasis.J Cancer Res Clin Oncol,2005,131(2):129~136
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















