第三节 蛋白质结构、性质与功能
虽然因技术的限制,近几十年对蛋白质的研究进展远远落后于核酸,但蛋白质作为生命活动的主要功能分子,其重要性无论如何强调都不过分。随着对遗传信息表达调控理解的深入和蛋白质功能的不断发现,已十分清楚“基因决定论”是片面的和需要修改的。中心法则可以简单说明遗传信息从DNA到RNA再到多肽链的传递过程,但对如何从多肽链到有功能蛋白质的了解还十分有限,而从功能蛋白质到生物性状则存在许多未解之谜。同时越来越多的新进展说明蛋白质和非编码RNA在遗传信息的传递过程所起的作用远比人们的预想要复杂,并有着十分关键的作用。因此,有理由相信在未来的几十年,蛋白质将会是分子生物学的主要研究对象,本节对蛋白质的结构与功能及其进展作简单介绍,相信会有助于对后面技术的理解和应用。
一、蛋白质的结构
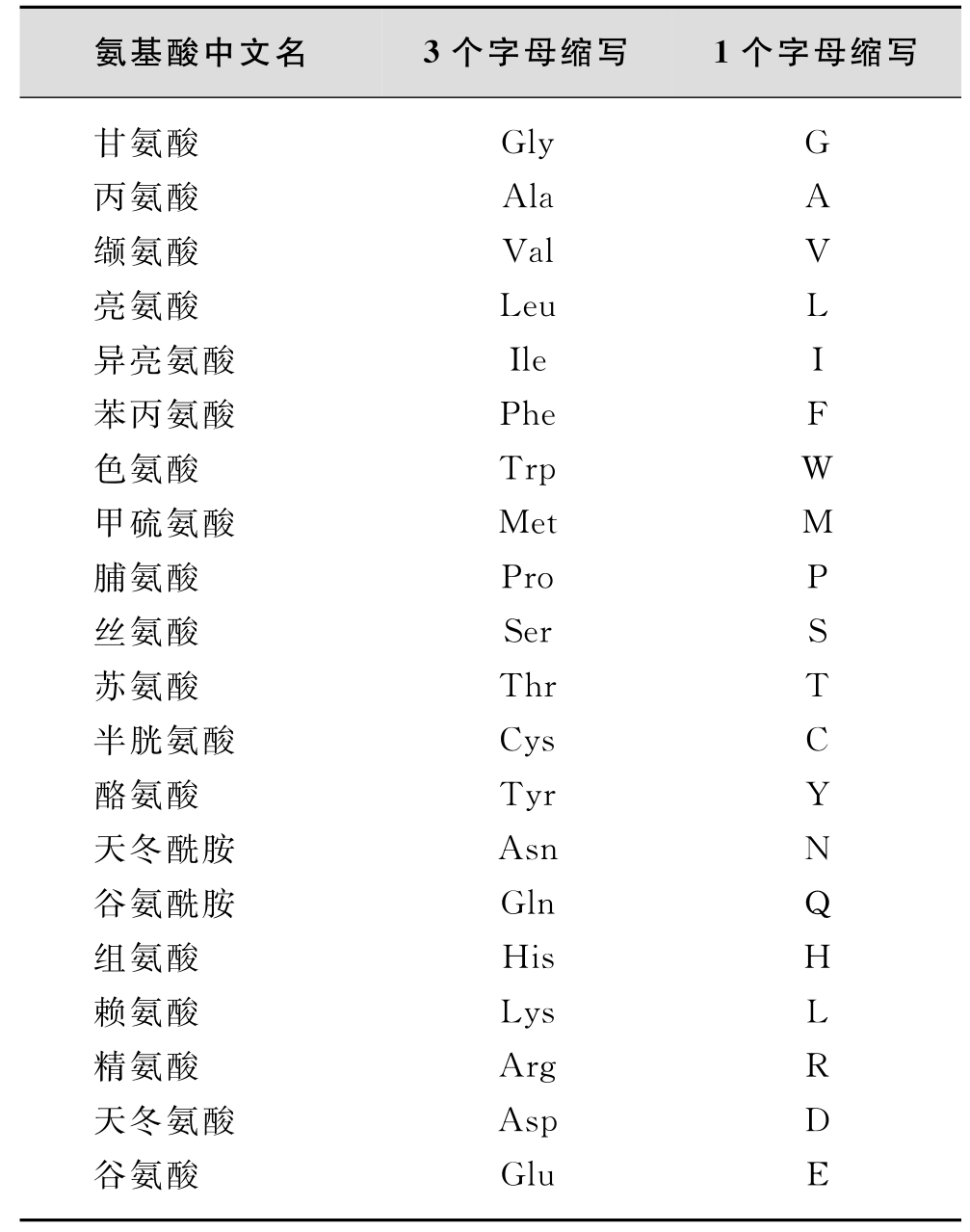
蛋白质的主要化学成分为碳、氢、氧、氮和硫,个别的还含有碘、磷和镁、铜、铁、锌、锰、钴、钼等。蛋白质为生物大分子,由其基本单位氨基酸所组成。组成人体蛋白质的基本氨基酸共20种(表2-2)。
表2-2 20种氨基酸缩写表
组成蛋白质N端的第1个氨基酸通过α-碳的羧基和第2个氨基酸α-碳的氨基形成酰胺键(又称肽键)构成蛋白质的基本骨架,所有氨基酸通过肽键连接就是蛋白质的一级结构,即指蛋白质多肽链中氨基酸的排列顺序。在大多数情况下,这种顺序由基因的碱基序列所决定。构成蛋白质的某段肽链通过氢键等非共价键,有规则地盘绕和折叠成相对位置的空间构象即二级结构,其共有α-螺旋、β-片层、β-转角和无规卷曲4种典型形式。具有二级结构的几个肽段在空间上相互作用形成的特殊结构称为基序。具有二级结构的整条肽链进一步在空间上相互作用形成球状、棒状、纤维状或椭圆形的三维空间结构,被称为蛋白质的三级结构。蛋白质的四级结构是指具有三级结构的肽链之间形成的三维空间排布,这些肽链被称为蛋白质亚基。由相同亚基构成的四级结构称为均一四级结构,由不同亚基构成的四级结构称为非均一四级结构。
二级和二级以上的蛋白质结构统称为空间结构,通常采用构象来描述蛋白质分子的空间结构。一般说来,构象反映的是在不发生共价键断裂和形成的情况下,由于共价单键的自由旋转而产生的不同空间结构状态。
二、蛋白质的性质
1.两性解离及等电点 组成蛋白质的氨基酸既含有酸性的羧基,又含有碱性氨基,可产生两性解离,同时一些氨基酸侧链基团在一定条件pH下也可解离成带负电或正电的基团。当蛋白质处于某一pH时,蛋白质解离成的正、负离子相等,净电荷为零,此时溶液的pH称为蛋白质的等电点(pI)。当溶液的pH大于pI时,该蛋白质颗粒带负电荷,当溶液的pH小于pI时带正电荷。各种蛋白质的pI不同,可在不同的pH处构成带,因此,可以利用这一特性将蛋白质通过pI电泳分离开来。
2.紫外吸收与显色反应 构成蛋白质链的氨基酸中的苯丙氨酸、酪氨酸和色氨酸具有共轭双键结构,在200~320nm的波长处会产生吸收,最大吸收值在280nm处,可利用蛋白质的这一性质来测量蛋白质的浓度。但核酸会产生干扰。在一定条件下,蛋白质中肽键可与硫酸铜作用生成紫色产物,蛋白质中的氨基可与茚三酮反应生成蓝紫色化合物,蛋白质中的酚羟基能与酚试剂反应生成蓝色化合物,可利用这些性质来测量蛋白质浓度。
3.高分子及胶体性质 蛋白质的相对分子质量一般在104~106,为生物大分子,因此可以用透析方法将其与小分子分开。同样可通过超滤法来进行浓缩。蛋白质大分子的胶体性质也使得蛋白质可以通过乙醇或丙酮等沉淀出来,还可以通过盐析进行初步分离。
4.蛋白质变构和变性 蛋白质的空间结构不是一成不变的,在与它的配体或其他蛋白或其他因子结合后,蛋白质的空间结构发生改变,使它适合于功能的需要,称为变构效应或别构效应。血红蛋白与氧气结合后发生空间构象改变就是个典型例子。许多酶蛋白也具有别构效应。蛋白质构象的改变既是一种调节方式,同时也会影响蛋白质功能,甚至与某些疾病的发生相关。
蛋白质远没有核酸稳定,在一定条件如高温、射线、高压、酸、碱、有机溶剂、去污剂、重金属离子及尿素等作用下,蛋白质的二级和二级以上结构被破坏,从而导致理化性质的改变和生物活性的丧生,称为蛋白质变性。蛋白质变性后,其溶解度降低、生物活性改变或丧生。有些蛋白质的变性在变性因素去除后可以恢复,称为可逆变性;蛋白质结构和功能在变性因素去除后无法恢复的称为不可逆变性。蛋白质十分容易变性也正是其研究进展缓慢的重要原因之一。
三、生物学大分子的相互作用
蛋白质往往通过非共价相互作用来完成生物功能。非共价相互作用包括氢键、范德华力、离子键和疏水相互作用。与一种蛋白质高度特异地识别和结合的其他分子,称为该蛋白质的配体,包括蛋白质、核酸、糖类、脂类等生物大分子以及小分子或离子等。通常采用亲和力来表示蛋白质分子与配体结合的特异性和牢固程度;亲和力通常又是通过解离常数(Kd)来反映的,解离常数越小,亲和力越大,特异性越高。一般情况下,蛋白质与配体的结合都是可逆的,在一定条件下会产生解离。因此,蛋白质的相互作用是动态的、变化的。为了能获得两者的结合物,常采用共价交联的方法先将它们固定后再进行分离纯化。
1.蛋白质与蛋白质的相互作用(protein-proteion interaction) 酶与底物、受体与配体、抗体与抗原之间通常通过蛋白质与蛋白质的相互作用来完成生物学功能。此外,细胞信号转导和通用转录因子与特异转录因子的结合一般也是通过蛋白质与蛋白质之间的相互作用实现的。两个蛋白质分子间相互作用的部位称为结合位点(binding site)。结合位点通常是由多肽链上一些氨基酸残基通过肽链折叠而在空间上聚集到一起,形成特定的空间排列方式。这些空间结构常称为基序(或模序、模体、基元,motif),现发现有4种方式,α-α/β-α-β/β发夹/β拱形。各种基序相互作用形成蛋白质的功能空间结构,即结构域。
2.蛋白质与DNA的相互作用 蛋白质与DNA的相互作用是生命活动的重要部分。蛋白质与DNA的相互作用的典型例子就是转录因子与DNA的结合及其功能的发挥。与DNA结合的转录蛋白质因子大多以二聚体形式起作用,与DNA结合的蛋白质功能域常见有以下几种。
(1)螺旋-转角-螺旋(helix-turn-helix,HTH)及螺旋-环-螺旋(helix-loop-helix,HLH):这类结构至少有两个α螺旋,其间由短肽段形成的转角或环连接,两个这样的基序结构以二聚体形式相连,两个α螺旋刚好分别嵌入DNA的深沟。
(2)锌指(zinc finger):每个重复的“指”状结构约含23个氨基酸残基,锌以4个配价键与4个半胱氨酸或2个半胱氨酸和2个组氨酸相结合。整个蛋白质分子可有2~9个这样的锌指重复单位。每一个单位可以其指部伸入DNA双螺旋的深沟,接触5个核苷酸。
(3)碱性-亮氨酸拉链(basic leucine zipper,bZIP):这类结构的特点是蛋白质分子的肽链上每隔6个氨基酸就有1个亮氨酸残基,结果就导致这些亮氨酸残基都在α螺旋的同一个方向出现。两个相同结构的两排亮氨酸残基就能以疏水键结合成二聚体,这二聚体的另一端的肽段富含碱性氨基酸残基,借其正电荷与DNA双螺旋链上带负电荷的磷酸基团结合。
3.蛋白质与RNA的相互作用 RNA参与许多基本的细胞生理过程:携带来自DNA的遗传信息,参与形成核糖体、拼接体、端粒酶、染色质重塑复合体、RNA诱导的沉默复合物等许多核酸蛋白颗粒的结构。这些结构的生物功能的发挥都需要RNA与蛋白质可逆或不可逆地结合,而且在绝大多数情况下,蛋白质与RNA的相互作用在上述那些生理过程中起着决定性的作用。目前,已经鉴定了许多RNA中的蛋白质结合位点,也发现了为数不少的蛋白质中的RNA识别结构域。RNA链内的碱基配对产生的二级结构有:螺旋、发夹、膨泡、内环和假结。这些结构单元之间进一步的相互作用使RNA形成复杂的三级结构。RNA的复杂结构使RNA-蛋白质的识别比DNA-蛋白质的识别要复杂得多,以“间接读出”(indirect readout)机制为主。RNA结合蛋白质(RNP)的结构域有以下几种。
(1)RNA结合结构域(RNA binding domain,RBD):又称RNA识别基序(RNA-recognition motifs,RRM),是研究得最多也是了解得最清楚的RNA结合结构域。目前已经在200多种RNA结合蛋白中发现这一结构域,这些蛋白分别结合RNA前体、mRNA、rRNA和snRNA,涉及RNA的加工、转运和代谢等多方面。RNP基序中有3个精细的结构元件可能与RNA相互作用:β折叠、连接折叠的环区、氨基和羧基端邻近区域。
(2)富含精氨酸基序(arginine-rich motif,ARM):发现于病毒和核糖体的一些蛋白中,由富含精氨酸的10~20个氨基酸序列组成,除了都富含精氨酸外,几乎没有同源性。
(3)双链RNA结合结构域:该结构域有一长为65~68个氨基酸残基序列,同源性约为30%,发现于双链RNA结合蛋白中。另外的RNA结合结构域,还有RGGBox(Arg-Gly-Gly重复)、KH结构域(K-homolog domain)、锌指结构、冷休克结构域和Sm-蛋白基序等。
四、蛋白质的功能
蛋白质占细胞干重的70%,不但是细胞的最主要成分,同时也是细胞功能发挥的主角。生命活动中的代谢、生长、信息交流、防疫都通过它们来执行;它们不但控制着生命信息的传递和表达,同时为生物性状的体现者。蛋白质按功能可分八大类:酶、受体、结构蛋白、转运蛋白、调节蛋白、信号转导蛋白、保护性蛋白和其他蛋白。在此仅简要介绍其中的几类。
(一)酶
生物体内新陈代谢的一系列复杂的化学反应几乎都是在酶的催化下进行的,酶是由活细胞合成的、对其特异底物起高效催化作用的大分子。除了核酶和端粒酶外,目前已发现的2000多种酶的本质都是蛋白质。酶对所催化的反应具有强大的催化能力和催化效率以及对底物有严格的选择性,同时酶在体内的催化作用受多种因素的控制,保证了生命活动的正常进行。酶既可以由单一肽链构成(如胰蛋白酶),又可以由不同亚基组成(大多数酶);既有催化单一反应的酶,也有催化几种不同反应的酶(如大肠埃希菌DNA聚合酶Ⅰ)。
酶促反应受多种因素的调控,酶可以从无活性的酶原转变而来,也可以通过与辅酶或辅基的结合来发挥功能。有些酶还可以通过变构效应来调节酶的活性,这些酶被称为变构酶。酶的共价修饰,包括磷酸化与脱磷酸化、乙酰化与脱乙酰化、甲基化与脱甲基化、腺苷化与脱腺苷化,以及二硫键的形成和解开,同样也是酶活性调节的重要方式。另外,细胞还通过酶蛋白的诱导和阻遏表达及酶蛋白的降解来控制酶蛋白的含量。
体外酶催化反应速度的影响因素有:酶浓度、底物浓度、产物浓度、温度、pH、酶抑制剂和激活剂等。酶可以分为六大类,即氧化还原酶类、转移酶类、水解酶类、合成(或连接)酶类、裂解酶类和异构酶类。
(二)受体与信息传递
受体(receptors,R)是位于细胞膜或细胞内,能识别和结合特异信息分子,并启动信息转导和引起生物效应的分子。多数受体的化学本质为蛋白质,且多数是糖蛋白,个别受体是糖脂。能与受体特异性结合的分子称为配体(ligand)。受体除了与配体结合后产生生物效应外,受体还能感受其他物理信号的刺激而产生效应,如力感应器。配体与受体的结合具有高度特异性和亲和力,同时也是可逆的、可饱和的。受体种类繁多,以下按细胞膜受体和细胞内受体两大类进行简单介绍。
1.膜受体 位于细胞膜上的受体按其信号转导机制和受体分子的结构特点,又可分为离子通道型受体、G蛋白偶联型受体、酶蛋白偶联受体和催化型受体。
(1)离子通道型受体:一般由多亚基组成的离子通道复合体,每个亚基由4~6个跨膜区,在细胞膜上形成阴离子或阳离子通道,与信号分子结合后即打开或关闭离子通道,改变细胞膜的离子通透性,从而产生生物效应。离子通道型受体主要见于可兴奋细胞间的突触信号传递,包括烟碱型乙酰胆碱受体(nAChR)、γ-氨基丁酸受体(GABAR)、甘氨酸受体、5-羟色胺受体-3(5-HT3)、多巴胺受体、离子型谷氨酸受体、光受体和嗅神经受体等。
(2)G蛋白偶联型受体:是与GTP结合蛋白(G蛋白)相偶联的最大受体家族,受体本身为单一肽链,一般长400~500个氨基酸,分细胞外、细胞膜和细胞内3个区域,具有典型的7个α-螺旋结构,跨越细胞膜7次。根据同源性的差异,G蛋白偶联型受体可分为3个超家族,多数神经递质和肽类激素的受体为G蛋白偶联型受体的成员,有M-乙酰胆碱受体(mAChR)、肾上腺素受体、多巴胺-D1受体、5-羟色胺受体-1和2、甲状旁腺激素受体和代谢型谷氨酸受体(mGluR)等。
G蛋白偶联型受体与配体结合后变构,将信息传递给G蛋白,使其活化,从而激活一系列信号转导和产生生物效应。G蛋白由α、β和γ3种亚基组成,受体与配体结合后,α/GTP在细胞膜内扩散,与不同的靶蛋白效应酶或离子通道相连,引起不同的生物效应。根据α-亚基作用的效应酶,目前发现的G蛋白有:①Gs和Golf:与激活腺苷酸环化酶的受体偶联,导致细胞内cAMP浓度升高;②Gi:与抑制腺苷酸环化酶受体偶联,使胞内cAMP浓度下降;③Gq:活化PLCβ;④Go:关闭Ca2+通道;⑤Gt:激活cGMP磷酸二酯酶;⑥Gp:激活磷脂酰肌醇特异的磷脂酶C。
(3)酶蛋白偶联受体和催化型受体:也是一类主要的细胞表面受体,自身具有酶活性或与酶偶联(主要指酪氨酸蛋白激酶),大多数生长因子和细胞因子是通过与这类受体结合进行信号传递的。这类酶活性受体通常由单个的α-螺旋形成跨膜部分组成,在信号分子与受体结合后引起两个膜受体分子集合在一起,形成二聚体,相互激活了自身胞内部分的激酶并将信号传递下去,从而产生效应。共有5种酶活性受体:受体酪氨酸激酶、受体丝氨酸/苏氨酸激酶、受体鸟苷酸环化酶、受体酪氨酸磷酸酶和酪氨酸激酶偶联受体。
2.细胞内受体 细胞内受体在细胞质或细胞核内,也被称为核受体,多为反式作用因子。当与相应配体结合后,能与DNA的顺式作用元件结合调节基因转录,因此又称为DNA转录调节型受体。核受体为单体蛋白质,N端为高度可变的受体调节区,具有转录激活作用;C端为激素结合区,其结构和功能最为复杂,有与配体结合的、与热休克蛋白结合的,还有使受体二聚化和激活转录的功能;中部为DNA结合区,比较保守,含有两个锌指结构。核受体超家族由类固醇激素受体、甲状腺激素受体、维A酸受体、维生素D3受体和孤儿受体(orphan receptor)组成。孤儿受体为具有核受体超家族各成员共同特性的一类基因产物,但尚未发现其内源性配体。
(三)参与调节的高迁移率族蛋白
在与DNA结合的、参与基因表达及调控的蛋白质中最近受到广泛关注的一类蛋白质为高迁移率族蛋白(high mobility group protein,HMG蛋白)。广义的HMG蛋白包括了两类蛋白质:HMG基序蛋白和经典的HMG蛋白。HMG基序蛋白中含有一个或几个与DNA的结合结构域,具有组织特异性,通常包括一些序列特异性的转录因子和其他一些DNA结合蛋白。
经典的HMG蛋白又分为3种类型,即HMGB、HMGA和HMGN。各类HMG蛋白都各含有不同的结构,但却具有广泛类似的功能。HMG蛋白家族广泛参与多种重要的核内生物学功能包括调节DNA复制、转录、重组和修复等。其中最为重要的功能是对基因表达转录的调控。HMG蛋白通过与染色质或DNA发生结合使其变形或弯折,或影响其与表达有关的结构,或促进其他调节蛋白的结合,影响大分子复合物的形成,从而调节转录的起始过程。所有的这三类HMG蛋白都是相对分子质量<3000的小分子蛋白质,并且都经历了广泛的翻译后修饰包括乙酰化、磷酸化、甲基化、ADP-核糖基化以及低度的糖基化。HMG蛋白能在核内进行快速的、跳跃式的运动,它们与染色质的结合是动态的、可逆的和短暂的,因此保证了其丰富的供应和变化组合。
(四)免疫分子
免疫分子为一大类重要的保护性和识别蛋白,包括免疫细胞和非免疫细胞表面分子和由这些细胞分泌的分子,如抗原识别受体分子、分化抗原分子(cluster of differentiation,CD)、主要组织相容性分子(major histocompatibility complex,MHC)、细胞黏附分子、免疫球蛋白、补体和细胞因子等。
免疫球蛋白(immunoglobulin,Ig),是由浆细胞合成和分泌的,具有保护功能的一类蛋白质。按理化性质和生物学功能,可将其分为IgG、IgA、IgM、IgE、IgD 5种类型,继而可分为许许多多亚型和同种异型,而具有抗原特异性的独特型(idiotype)则可高达107以上。Ig分子的基本结构是由四肽链组成的。即由两条相同的相对分子质量较小的肽链称为轻链(L链:κ和λ)和两条相同的相对分子质量较大的肽链称为重链(H链)组成的。轻链与重链是由二硫键连接形成一个四肽链分子称为Ig分子的单体,是构成免疫球蛋白分子的基本结构。肽链的N端氨基酸序列变化很大,称为可变区(variable region,V区),C-末端则相对稳定变化很小,称为恒定区(constant region,C区)。四条肽链由3个不连锁的Igκ、Igλ和IgH基因所编码。Igκ、Igλ和IgH基因定位于不同的染色体上。编码一条Ig多肽链的基因是由多个分隔的基因片段经重排而形成的。Ig还可通过缺失模式和RNA剪接两种机制来实现类别的转换。
Ig的生物活性主要为免疫作用,体现在:①特异性结合抗原;②激活补体;③结合Fc受体,介导Ⅰ型变态反应,起调理作用和发挥抗体依赖的细胞介导的细胞毒作用;④可通过胎盘及黏膜,形成自然被动免疫;⑤具有抗原性,刺激机体产生免疫应答。
许多细胞膜表面和机体某些蛋白质分子,其多肽链折叠方式与Ig折叠相似,在DNA水平和氨基酸序列上与IgV区或C区有较高的同源性,将它们统称为免疫球蛋白基因超家族(immunogloblin superfamily,IgSF)。近年来发现属于IgSF的成员已达近百种,主要包括T细胞、B细胞抗原识别受体和信号传导分子、MHC及相关分子、Ig受体、细胞黏附分子、某些细胞因子受体、神经系统功能相关分子以及部分白细胞分化抗原。IgSF的功能是以识别为基础,因此又称为识别球蛋白超家族。
五、蛋白质组学
生命现象的发生往往是多因素相互作用的结果,涉及多个蛋白质,而这些蛋白质的参与又常常交织成网络或平行发生,或呈级联因果关系,同时蛋白质在执行生理功能时的表现是多样的、动态的。因此,要对生命的复杂活动进行全面和深入的了解,必然要在整体、动态、网络的水平上对蛋白质进行研究。因此,20世纪90年代产生了蛋白质组学,它是以细胞内全部蛋白质的存在及其活动方式为研究对象,对一种基因组或一个细胞或组织类型所有蛋白的表达进行分析。
蛋白质有其自身特定的活动规律,这些通常都无法直接从基因组的信息中反映出来。这是因为基因组是均一的,在同一生物个体的不同细胞中基本相同,而且它是静态的,比较稳定而不易改变。蛋白质组则具有多样性,同一生物个体的不同细胞中所含蛋白质的种类和数量都不相同,因它是动态的,不断地改变着。即使是同一种细胞,在不同时期或在不同环境条件下,其蛋白质组分也在不断地发生着变化。更重要的是,从基因中得到的蛋白质的信息是不完整的,比如在基因组水平上无法获知蛋白质的结构形成、修饰加工、转运定位、蛋白质与蛋白质相互作用等活动。因此,若要精确地研究基因的功能,解释复杂的生命现象,就必然要在整体、动态、网络的水平上对蛋白质进行研究,即进行蛋白质组学的研究。
蛋白质组学的研究内容包括:①针对已知基因及转录数据库的生物体、组织及细胞,建立相应蛋白质组或亚蛋白质组数据库(蛋白质表达谱)及其蛋白质组连锁群;②以重要的生命过程或人类一些重大疾病为对象,进行重要的生理和病理体系或过程的研究,即比较蛋白质组学研究;③蛋白质组学支撑技术平台和生物信息学的研究。
蛋白质组学研究目前采用两种策略。一种称为“穷尽法”或“竭泽法”,即采用高通量的蛋白质组研究技术,分析生物体内接近所有的蛋白质。这种大规模、系统性的策略较为符合蛋白质组学的本质。但是,由于蛋白质种类繁多,表达随空间和时间不断变化,且目前高通量研究的技术尚不成熟,短期内要分析生物体内所有的蛋白质是一个难以实现的目标。因此人们逐渐转向另一种策略:“差异法”(也称为“功能法”),它着重于寻找和筛选任何有意义的因素引起的不同样本之间的差异蛋白质谱,试图揭示细胞对此因素的反应途径、进程与本质,同时获得对某些关键蛋白的认识和功能分析。这种观点更倾向于把蛋白质组学作为研究生命现象的手段和方法,技术上具有更高的可实现性,在疾病的早期诊断、肿瘤等疾病发病机制研究、药物靶标寻找和药理分析等方面的应用价值十分显著,是目前蛋白质组学在应用上最具前景的领域。
随着蛋白质组学研究的深入,又出现了一些新的研究趋势。①相互作用蛋白质组学:又称为“细胞图谱”蛋白质组学,它包含两个方面的内容,即研究蛋白质之间相互作用的网络和分析蛋白质复合体的组成;②亚细胞蛋白质组学:包括各种细胞器蛋白质组、核膜蛋白质组等;③定量蛋白质组学:即对蛋白质的差异表达进行准确的定量分析。这标志着蛋白质组学研究开始从简单的定性朝向精确的定量方向发展,并已逐渐成为蛋白质组研究的新前沿。
(潘銮凤)
参考文献
1.查锡良主编.医学分子生物学.北京:人民卫生出版社,2003
2.李振刚主编.分子遗传学.第二版.北京:科学出版社,2004
3.冯作化主编.医学分子生物学.北京:人民卫生出版社,2001
4.李振刚主编.现代分子生物学论纲.天津:天津科学技术出版社,2003
5.陈浩明,薛京伦主编.医学分子遗传学.第三版.北京:科学出版社,2005
6.张钦宪,何丽娅,李平法主编.医学分子生物学.郑州:郑州大学出版社,2003
7.吴士良,周迎会,黄新祥主编.医学生物化学与分子生物学.北京:科学出版社,2005
8.黄诒森,张光毅主编.生物化学与分子生物学.北京:科学出版社,2003
9.杨吉成,陈子兴主编.医用分子生物学.北京:化学工业出版社,2004
10.杜耀华,王正志.基因组中的重复DNA序列.生物技术,2003,13(6):51~53
11.黄春,张万江.转座子及其相关技术的研究.世界华人消化杂志,2006,14(1):1714~1720
12.胡锐等.动物基因组中反转录转座子的研究进展.中国畜牧杂志,2004,40(7):45~48
13.汪泰初,朝良肖,林珍.线粒体基因组(mtDNA)的研究进展.安徽农业科学,2006,34(10):2070~2071
14.朱武洋,贾青.端粒和端粒酶的研究进展.中国畜牧兽医,2004,31(2):24~26
15.郭曼,欧阳芳茜,王玉刚.端粒和端粒酶与衰老研究.生命科学研究,2006,10(4):30~36
16.杨平勋,黄君健.端粒及端粒酶的研究进展.生物技术通讯,2007,18(4):667~669
17.柴国林,朱卫国.DNA的损伤与修复.中华肿瘤杂志,2005,27(10):577~580
18.孙敬芬,周平坤,吴德昌.DNA修复与人类疾病研究进展.癌变·畸变·突变,2002,14(4):261~265
19.胡笳,郭燕婷,李艳梅.蛋白质翻译后修饰研究进展.科学通报,2005,50(11):1061~1072
20.刘兴顺,程牛亮.DNA错配修复系统基因多态性与大肠癌易感.医学综述,2006,12(24):1480~1482
21.毕利军,等.DNA错配修复系统研究进展.生物化学与生物物理进展,2003,30(1):32~37
22.李雷佳,许树长.微小RNA及其功能的研究进展.同济大学学报(医学版),2007,28(2):105~108
23.熊霞辉,陈梅红.Micro RNA参与的调控网络.医学分子生物学杂志,2007,4(4):367~370
24.沈金花,沈王羽,王非.组蛋白密码与表观标志.国外医学·分子生物学分册,2002,24(6):337~340
25.林洁,来茂德.DNA甲基化、组蛋白去乙酰化与基因表达抑制.临床与实验病理学杂志,2006,22(3):353~357
26.魏泉德,黄艳,余新炳.组蛋白与基因调控研究进展.热带医学杂志,2006,6(5):596~598
27.朱静,王应雄.染色质的重塑与基因表达调控.国外医学·临床生物化学与检验学分册,2005,26(1):12~14
28.傅美丽等.染色体领域的研究及其进展.遗传,2006,28(2):236~242
29.胡波,周新妇.微卫星DNA的研究概况.国外医学·临床生物化学与检验学分册,2000,21(2):88~90
30.杜耀华,王正志.基因组中的重复DNA序列.生物技术,2003,13(6):51~53
31.高锐等.蛋白质组学研究进展.畜牧兽医科技信息,2007,12:13~16
32.肖湘文,周建林,周畅.高迁移率族蛋白.细胞生物学杂志,2006,28:501~506
33.张庆硕,王恩多.RNA和蛋白质的相互作用.生物化学与生物物理进展,1999,26(2):121~125
34.杜光伟,等.RRM RNA结合蛋白的结构与功能.生物化学与生物物理进展,1999,26(4):305~307
35.童竞亚.免疫球蛋白基因超家族.赣南医学院学报,1994,14(1):66~77
36.夏其昌,曾嵘,等.蛋白质化学与蛋白质组学.北京:科学出版社,2004
37.Weaver.Molecular Bilogy.McGraw-Hill Companies,Inc.1999
38.Santos,et al.Driving change:the evolution of alternative genetic codes.Trends Genet,2004,20(2):95~102
39.McKenna and Omalley.Combinatorial control of gene expression by nuclear receptors and coregulators.Cell,2002,108:465~474
40.Kornberg and Thomas.Chromatin structure;oligomers of the histones.Science,1974,184:865~868
41.Aladjem,et al.Genetic dissection of a mammalian replicator in the human-globin locus.Science,1998,281:1005~1009
42.Walter P,Ibrahimi I,Blobel G.Translocation of proteins across the endoplasmic reticulum.I.Signal recognition protein(SRP)binds to in-vitro-assembled polysomes synthesizing secretory protein.J Cell Biol,1981,91(2Pt 1):545~550
43.Shamoo Y,et al.Crystal structure of the Two RNA binding domains of human hnRNPA1at 75 resolution.Nat Struct Biol,1997,4(3):215~222
44.Burd CG,Dreyfuss G.Conserved structures and diversity of functions of RNA-binding proteins.Science,1994,265(5172):61~621
45.Draper DE.Protein-RNA recognition.Annu Rev Biochem,1995,64:593~620
46.Kuby J.Immunology.2nd ed New York:W.H.Freeman and Company,1994
47.Stryer L.Biochemistry.3rd ed New York:W.H.Freeman and Company,1988
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














