第三节 目的基因的重组
一、载体和宿主
(一)载体
大多数外源DNA片段很难进入受体细胞,且不具备自我复制的能力。因此,在基因工程中要把外源目的基因引入宿主细胞进行复制、转录和表达,选择合适的载体是十分重要的。载体是供插入目的基因并将其导入宿主细胞内复制和(或)表达的运载工具。载体的本质是DNA(少数是RNA)。经过人工构建的载体,不但能与外源基因相连接,导入受体细胞,还能利用本身的调控系统,使外源基因在新细胞中复制和表达(图3-6)。
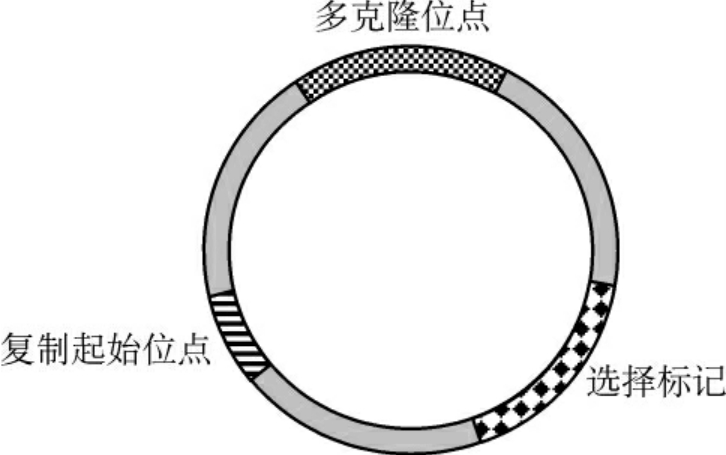
图3-6 克隆载体的结构示意
理想的载体应具备以下几个条件:①能自主稳定复制,目的基因的插入基本不影响载体的复制能力;②应具有一个以上的单一限制性酶切位点,以便目的基因插入;③具有某些容易检测的遗传标记(如抗药性、氨基酸合成酶、空斑形成等),以便利用这些标记筛选克隆;④插入目的基因的幅度较宽;⑤相对分子质量小、拷贝数高;⑥从生物防护角度考虑是安全的。
一般常用的载体按来源分有质粒、噬菌体和病毒。天然的质粒、噬菌体、病毒都需经过人工构建才能成为合乎上述条件的基因工程载体。根据载体得到的产物分类,可分为克隆载体和表达载体,前者主要用于DNA大量扩增,并不需要得到目的基因所编码的蛋白质,后者则两者兼而有之,并侧重于得到蛋白质。按宿主细胞来分,目前用于外源基因表达的载体主要是大肠埃希菌载体、哺乳动物细胞载体和酵母细胞载体,另外还有一种最近发展起来的有前途的基因工程载体:昆虫细胞载体。
1.大肠埃希菌的常用载体
(1)质粒:是一种存在于细菌细胞质中的遗传成分,绝大多数都是以共价闭合环状双链DNA分子形式存在。质粒DNA分子具有独立的复制能力,可以以游离状态持续、稳定地存在于宿主染色体外,并可在细胞分裂中与染色体一道分配到子细胞中。质粒的存在与否一般对宿主细菌的生存没有决定性的影响,但却可以赋予宿主细胞额外的生物学特性,如对药物、重金属的抗性,对细胞某方面代谢缺陷的补偿能力等。
质粒载体是以细菌质粒的基本元件为基础构建而成的基因工程载体,是最早发展起来的应用最为广泛的一类载体,广泛用于基因克隆、DNA测序、基因表达等实验中。不同的质粒分子大小不等,从数千碱基对到数十千碱基对,不同的质粒在寄主细胞的复制量有多有少,从几拷贝到几十、成百,甚至上千拷贝。根据质粒在细胞中的拷贝数的差异,可将其分为高拷贝的松弛型质粒和低拷贝的严谨型质粒。在宿主细胞内,严谨型质粒的拷贝数较少,甚至每个宿主细胞仅含有1~3个拷贝,而松弛型质粒的拷贝数较高,每个细胞一般含有10~60个拷贝甚至更高。严谨型质粒和松弛型质粒的分类并非是绝对的,质粒的复制类型与宿主细胞也有关系,一种质粒在一种宿主内是松弛型,在另一种宿主内可能为严谨型。为了提高单个细胞内质粒的拷贝数以获得大量的目的基因,一般都选用松弛型质粒作为克隆载体;或者可以用氯霉素、大观霉素等蛋白质合成抑制剂处理细胞,阻止宿主染色体复制,让质粒在一定时间内继续复制来提高质粒的拷贝数。然而,有的目的蛋白对宿主细胞有毒性,质粒的高拷贝并不能提高外源蛋白的表达效率,选择严谨型质粒载体有时能得到更理想的结果。
亲源关系密切的质粒不能稳定地在同一个寄主细胞中共存,这种现象称为质粒的不相容性,或称为质粒的不亲和性。其中一种质粒会逐级排斥另一种质粒,这样的两种质粒称为不亲和质粒。相反,如果两种质粒能在同一细胞中共存,则认为它们是相容的,互称为相容性质粒或亲和性质粒。根据质粒的不亲和性,可将质粒分成许多不亲和群。
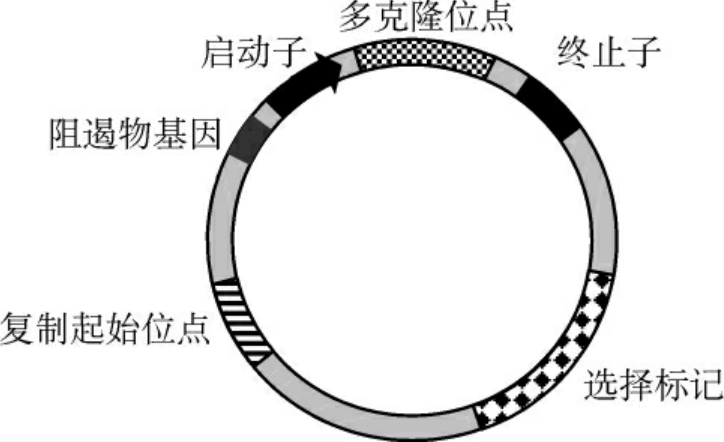
图3-7 一种典型的大肠埃希菌表达载体的结构示意图
有的质粒只能在少数寄主中复制,称为窄寄主范围质粒,而有的则能在多种不同属的细菌中复制,因而称为广寄主范围质粒。另外,复制型质粒只能在细胞中进行复制而不能进行表达;而表达型质粒除能进行复制外,还可以将连接到质粒上的目的基因进行必要的表达,体现出相应的生物学活性。因此,表达型质粒比复制型质粒多出启动子、终止子、核糖体结合位点等转录和翻译元件(图3-7)。无论是用作克隆的质粒载体,还是用作表达的质粒载体,它们的优点是:相对分子质量小、容易提取、拷贝数较高、大多有抗药性标记、易导入宿主细胞等;缺点是:插入的外源基因不能太大,一般不超过10kb,否则质粒不稳定容易丢失。
(2)噬菌体:目前使用的噬菌体载体主要有λ噬菌体衍生物、黏尾质粒和单链M13噬菌体等。除M13外,这类载体的特点是其容量比质粒载体大,即可插入较大的外源DNA片段(如20kb以上)。这类载体的另一优点是噬菌体转染宿主细胞的效率比DNA转化宿主的效率高2~3个数量级。缺点是单一限制性酶切位点较少,需要加以人工改造,一般不用于外源基因的高效表达。
2.真核细胞载体
(1)哺乳动物细胞的载体:哺乳动物细胞(如COS、CHO)用作克隆基因的表达具有很多优点,如它能识别和剪切外源基因中的内含子并加工成成熟的mRNA,这是原核细胞办不到的;哺乳动物细胞表达的蛋白质可在翻译后得到加工修饰(如糖基化),而原核细胞至少在糖基化方面是办不到的。糖基化在蛋白质免疫原性和稳定性方面起重要作用。哺乳动物细胞加工修饰后的蛋白质免疫原性比低等真核生物酵母细胞好。人工构建的哺乳动物细胞载体应具备下列条件:①含有原核基因序列,包括大肠埃希菌的复制子、便于抗生素筛选的抗性基因等,从而有利于外源基因的克隆与鉴定。另外,应包含真核细胞选择标记如酶、抗生素等。可包含病毒复制子。②含有哺乳动物细胞的启动子和增强子元件,能使外源基因有效转录。③含有终止信号和加poly(A)信号。④含有可选择的剪接信号。若内含子的存在对外源基因表达不利,则直接用cDNA作为外源基因;若表达效率因内含子的存在而有所提高,则载体必须含有剪切信号。⑤含有一个以上的单一限制性酶切位点。
1)SV40衍生载体:SV40是乳多空病毒群的一员,其基因组是共价闭合环状双链DNA,长为5.2kb。由于SV40有致癌性,因此需对其进行改造。SV40衍生载体是通过把SV40DNA早期基因或晚期基因以及非必需区切除,余下的SV40DNA的启动子部分再与其他质粒的启动子及其抗药性标记基因进行重组而得到的。pSV是该系列中的一个典型载体。
2)反转录病毒、腺病毒和腺病毒相关病毒载体:反转录病毒载体能稳定地将外源基因随机整合入宿主细胞基因组内,并随细胞分裂而传代,因此可稳定表达外源基因产物。上述这种整合作用不在非分裂的细胞中发生,而只在有DNA复制的细胞中发生。腺病毒及其相关病毒既能感染增殖细胞,也能感染静止细胞。腺病毒载体不具整合作用,因此不能持续表达外源基因产物;而腺病毒相关病毒载体能定向整合入染色体,因而能持续表达外源基因。
3)痘苗病毒载体:痘苗病毒是迄今所知结构最复杂的一类DNA病毒,其基因组是线状双链DNA,长度在180~200kb。痘苗病毒衍生载体的外源基因容量大,可达25~40 kb;并可同时插入多个外源基因,可在多种细胞中生长繁殖。外源DNA应为cDNA,因为痘苗病毒自身的DNA序列是连续的,不具有对真核基因转录后的剪切加工能力,但表达产物可以糖基化。
(2)酵母细胞的载体:酵母是一种低等真核生物,具有一定的修饰蛋白的能力如糖基化。另外,它比哺乳动物细胞操作简单,容易培养。因此,酵母细胞作为一种真核基因的表达系统有着良好的前景。酵母菌中天然存在的自主复制型质粒并不多,目前用于外源基因克隆和表达的载体质粒都是由野生型质粒和宿主染色体上的功能基因构建而成。
1)2μ质粒:是酵母中一种双链环状的染色体外DNA,长约6.3kb,在电镜下观察其周长约2μm,因而得名2μ。每个细胞内约有100个拷贝,2μ质粒的最大缺点是不稳定和易于丢失。
2)人工构建的酵母质粒载体:用作酵母的载体,除2μ质粒外,一般都需经过改造。构建高效的酵母表达载体,通常以克隆载体为基础,插入酵母高效启动子(如pGK1-p、pGD-p等)和酵母基因的3′非翻译区(含有终止信号,如pGK1-T、CYC-T等)。酵母人工染色体(YAC)载体是20世纪80年代发展起来的并经逐级完善的大片段外源DNA克隆体系。可供插入外源片段的长短是200~1000kb,甚至更长。酵母人工染色体载体已成为人类基因组研究中的重要工具。
(3)昆虫细胞的载体:真核基因在昆虫细胞中表达时,不仅能利用信号肽使外源蛋白分泌到胞外,而且能有效地进行蛋白质翻译后的加工和修饰,如糖基化、脂酰化和磷酸化等。表达产物的抗原性、酶活力等生物学活性与天然蛋白质十分相似。昆虫细胞的载体主要是昆虫杆状病毒载体。
(二)宿主
宿主细胞也称受体细胞,分为原核细胞和真核细胞两类。质粒和噬菌体常用于以原核细胞为宿主的分子克隆;动物病毒用于真核细胞为宿主的分子克隆。基因工程中原核细胞如细菌,包括大肠埃希菌、枯草杆菌、链球菌等,以大肠埃希菌为主;真核细胞包括酵母、哺乳动物细胞及昆虫细胞等。
二、载体和目的基因的处理及连接
含有目的基因的DNA片段,即使进入宿主细胞内,仍然是不能进行复制和表达的。它必须同适当的能自我复制或表达序列的DNA分子载体(例如质粒、噬菌体或病毒载体)共价连接形成重组体之后,才能够通过转化或其他途径进入合适的寄主细胞内,从而使目的基因得以复制、转录和表达目的基因产物蛋白质。
DNA连接是指在一定条件下,由DNA连接酶催化两个双链DNA片段相邻的5′端磷酸与3′端羟基之间形成磷酸二酯键的过程。把目的基因插入载体,这两种DNA分子连接起来得到的产物常称为重组体、重组子或重组DNA分子。
目的基因与载体之间的连接大致有以下3种方式:①两个两端均为黏端的DNA片段间的连接;②两个两端均为平端的DNA片段间的连接;③一端为黏端,另一端为平端的DNA片段间的连接。
1.黏端DNA片段间的连接 当用相同一种或相同两种限制酶分别酶切目的基因和载体而产生相同的黏性末端时,可采用这种方式连接。这包括两种情况。
(1)单酶切点的黏性末端:目的基因和载体用相同的一种限制酶酶切后,两者的两端均具有相同的黏性末端,可以很容易地进行连接反应(图3-8)。这是最简单的最方便的克隆途径,但是有个情况必须考虑:一是连接时可能导致目的基因及载体的自我连接环化,前者的自我环化产物导入宿主细胞并用载体上的选择标记筛选后将不能生存,因为目的基因一般不含这种选择标记;而载体的自我环化产物将生存下来,因此大大降低了目的基因插入载体的有效重组率。为了防止这种情况的发生,可以用碱性磷酸酯酶去掉载体DNA黏性末端的5′磷酸基。当目的基因与5′端脱磷的载体连接后,重组体双链DNA中的每条链仍残留一个缺口,但进入宿主细胞后可被修复成完整的环状双链DNA分子(图3-9)。另外,用同一种限制酶切割DNA进行黏端连接时,目的基因插入载体可有两种方向。这种连接若以克隆为目的,则没有影响,而若以表达为目的,就必须对插入的片段进行方向鉴定,因为目的基因是由起始密码子向终止密码子的方向表达的,一旦启动子与目的基因编码顺序方向相反就不能正确转录目的mRNA。
(2)双酶切片段的定向克隆:用两种不同的限制酶分别切割目的基因和载体时,将产生不同的黏性末端,载体只能在DNA连接酶的作用下和目的基因进行连接,载体DNA片段也将不会自身环化,目的基因将定向插入载体中(图3-10)。
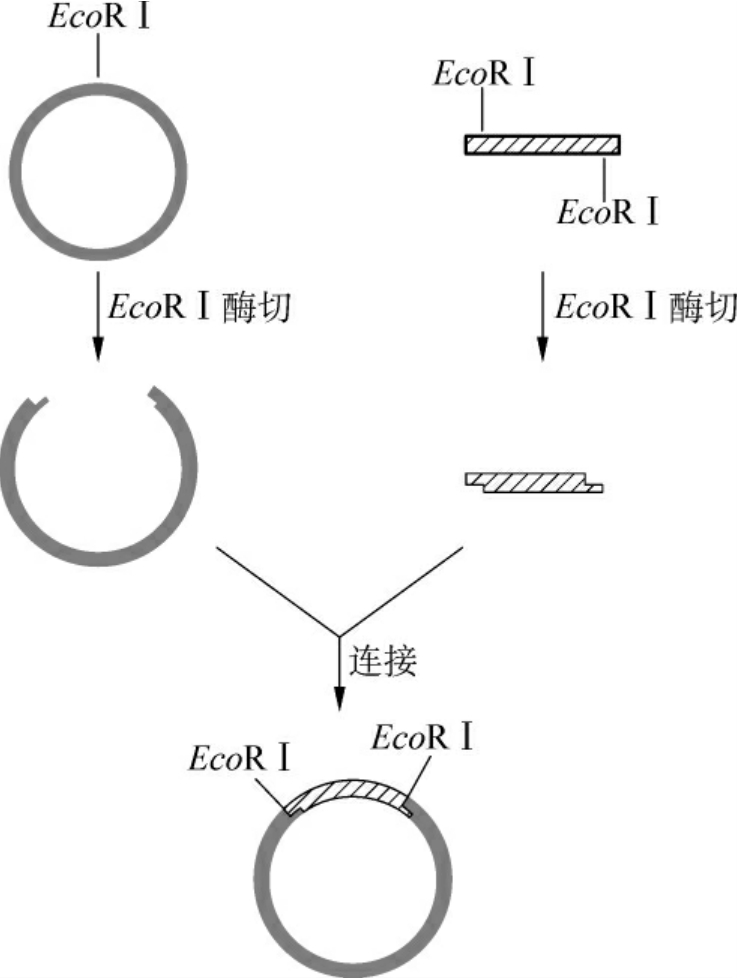
图3-8 单酶切后的黏性末端连接
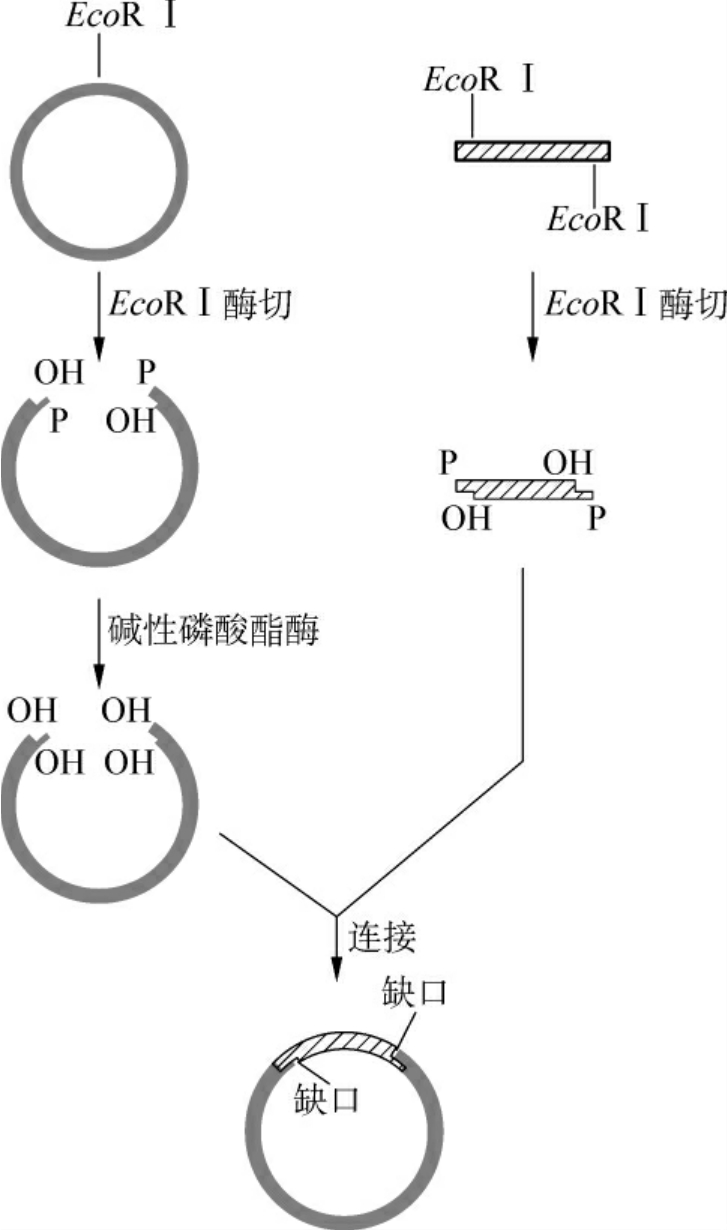
图3-9 碱性磷酸酶防治载体的自身环化
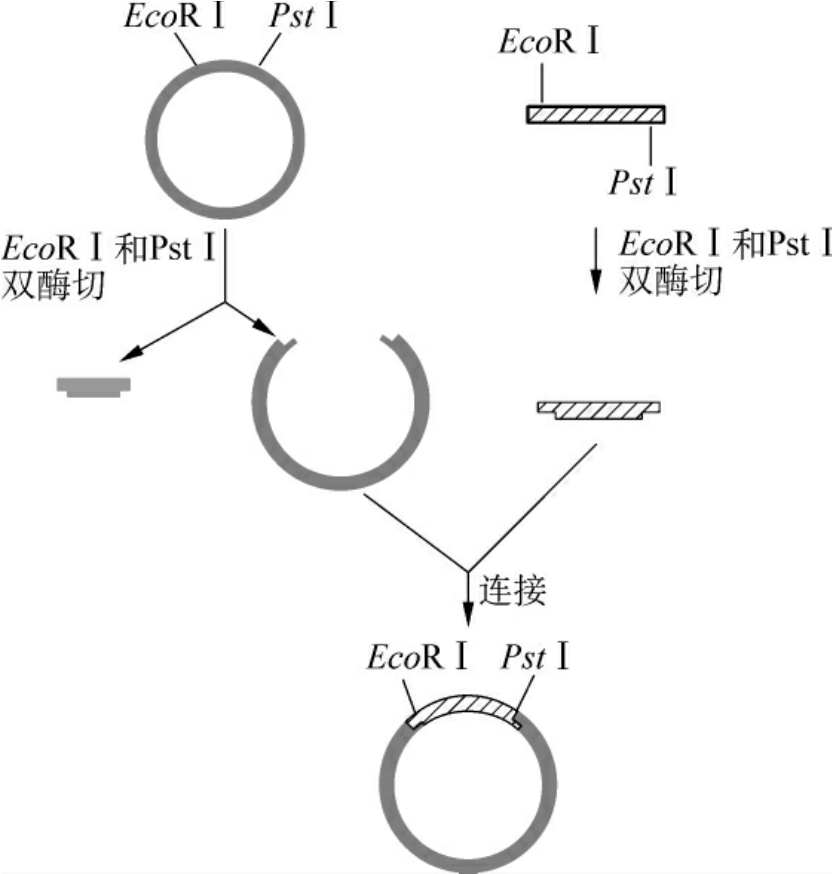
图3-10 定向克隆
产生黏性末端的办法除了用限制性核酸酶切割DNA外,还可通过同聚物加尾或人工接头后酶切或PCR后酶切来实现。
2.平端DNA片段间的连接 用人工合成法、反转录法及某些限制性内切酶(如SmaⅠ,HpaⅠ)酶切产生的DNA片段可为平末端,此时除了上述讲到的可将其改造成黏性末端外,也可在高浓度DNA、低浓度ATP、大量T4DNA连接酶的条件下,直接利用平端将目的基因与载体连接起来。但其效率远远低于黏末端连接,而且不能避免载体分子的自身环化及目的基因插入载体仍有两种方向的可能性。但是由于平端连接具有普适性,也是很有用的连接。DNA末端加人工接头的时候也用平端连接。
3.黏平末端DNA片段间的连接 目的基因插入载体还可通过一端为粘端、另一端为平端的方式连接。产生“粘-平”方式的末端有两条途径,即用一个产生平末端的限制性内切酶(如SmaⅠ,HpaⅠ)与一个产生黏性末端(如EcoRⅠ,BamHⅠ)的内切酶切割目的基因与载体;或先用一个产生黏性末端的内切酶酶切DNA,然后用修饰酶补平或削平黏性末端,使之成为平末端,再用另一个产生黏性末端的内切酶酶切该DNA。以这种方式连接得到的重组子,其目的基因可定向插入载体,并避免了载体分子的自身环化(图3-11)。
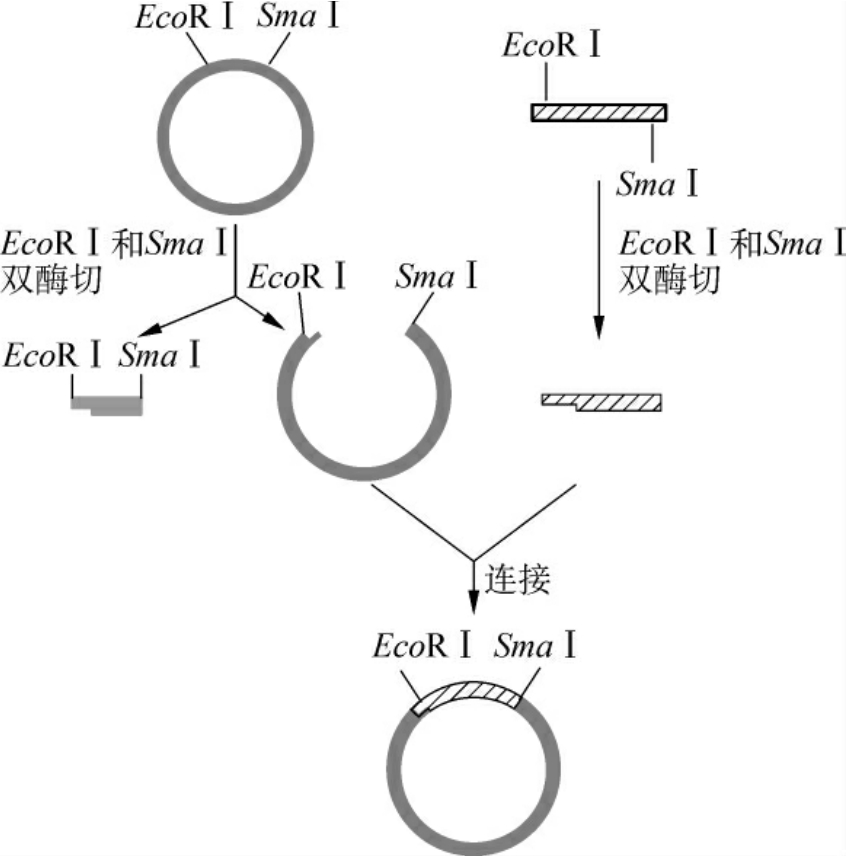
图3-11 黏平末端DNA片段间的连接
4.某些特殊的限制性酶酶切片段的连接 某些不同的限制性内切酶分别切割目的基因与载体DNA时,如用BamHⅠ切割目的基因,用BglⅡ切割载体DNA,表面上看,它们之间不能进行连接,但实际上连接反应可在它们之间进行。分析一下酶切后的DNA片段不难看出,这两个酶是同尾酶,切割后的目的基因和载体带有互补的末端(目的基因用BamHⅠ酶切后其末端成为GATC,载体DNA用BglⅡ酶切后成为GATC),因此可以实现连接。另外,平端之间的连接也不一定是用同一种限制性内切酶切割目的基因与载体DNA后产生的片段之间的连接,如用SmaⅠ切割的目的基因和用HpaⅠ切割载体DNA后产生的片段之间可以进行连接。但需要注意的是,上述几种情况下连接后的DNA可能使原来的限制性内切酶位点消失。
三、重组DNA分子导入受体细胞
为了使重组DNA分子进行扩增以及获得目的基因的表达产物,需将重组DNA分子导入受体细胞。重组DNA分子导入受体细胞的过程称为转化或转染。这些不同叫法有不同的含义。将质粒DNA或以它为载体构建的重组子导入细菌的过程叫转化;将噬菌体、病毒或以它为载体构建的重组子导入受体细胞的过程称为转染或感染。
1.重组DNA导入大肠埃希菌
(1)CaCl2转化法:大肠埃希菌细胞要摄取外源DNA,必须处于感受态。感受态细菌是指细菌表面受体经处理后,使其酶活化而处于感受态。另外,还有一种关于感受态的假说即局部原生质化。无论酶受体假说还是局部原生质化假说,目前尚有待进一步研究。
细菌处于容易吸收外源DNA的状态称为感受态,这种细菌细胞称为感受态细胞,转化的基本过程是:首先制备感受态细胞,即将对数生长期的细菌悬浮于冰冷的CaCl2溶液中。经冰浴处理一定时间,使细胞膜通透性增加,细胞就具备了感受态特性,此时加入外源DNA,经42℃短暂热处理后,外源DNA进入感受态细胞,加少许液体培养基培养一定时间后,将菌液涂布于固体培养基平板上,得到的菌落称为转化子。
每微克DNA转化受体细胞后所获得的转化子数称为转化效率。CaCl2法的转化效率为105~106转化子/微克环状DNA。外源DNA分子的构型与大小均可影响转化效率。环状DNA分子比线性分子的转化效率要高得多。当DNA分子>15kb时,转化效率也会降低。
为了提高转化效率,在CaCl2法的基础上,又发展了一些其他方法。如CaCl2溶液中加入DMSO、CaCl2与RbCl联合使用、CaCl2与MnCl2联合使用、MgCl2处理等,用这些方法可使转化效率达107,有的甚至达108。但目前实验室中常用的还是常规的CaCl2法,因其操作简单和省时,转化效率可以满足一般的基因克隆实验要求。
(2)电击法:又称电穿孔法,最初用于将DNA导入真核细胞,后来也被用于转化大肠埃希菌和其他细菌。制备电击的细胞与制备感受态细胞一样简便。细菌生长到对数中期后,离心收获细胞,用低盐缓冲液或超纯水充分洗涤后,将其悬浮于甘油中即成。电击时,将适量DNA加入到上述细胞中,混匀后转移到预冷的电击杯中,选择合适的参数进行电击,这些参数包括电压、电容和电阻,一般使用的电击条件导致细胞死亡率为50%~75%时,转化效率最高。电击法转化效率很高,可达1×109~1×1010,但成本也较高。因此,它一般在要求有较高转化效率的情况下使用,如构建基因文库。
(3)体外包装感染法:以λDNA或粘尾质粒为载体构建的重组DNA导入大肠埃希菌可采用此法。在试管中将重组DNA与λ噬菌体头部及尾部蛋白混合,使其包装入头部蛋白外壳中成为完整的噬菌体,然后感染大肠埃希菌。该法效率一般高于CaCl2法,线性DNA分子有利于体外包装成病毒颗粒及感染细菌。
2.酵母转化
(1)完整细菌转化法:该法以乙酸锂或氯化锂处理对数生长期的酵母细胞成为感受态细胞,在运载DNA(如鲑鱼精DNA、小牛胸腺DNA)、PEG、DMSO存在下,重组DNA经热冲击后进入酵母细胞,经28~30℃培养2~3天可长出转化子,转化效率在103~104间,线状质粒转化效率高于环状质粒。由于该法操作简单,常被许多实验室采用,但该法不利于DNA多拷贝整合到染色体中。
(2)原生质体转化法:该法用蜗牛酶处理对数生长期的酵母细胞,除去细胞壁成为原生质体,将原生质体细胞悬浮于含Ca2+的溶液中,在运载DNA存在下,用PEG使重组DNA分子进入酵母细胞。转化效率为103~105,该法有利于DNA多拷贝整合到染色体中。
(3)电击法:类似电击转化大肠埃希菌,该法也不利于外源DNA多拷贝整合到染色体中。
3.重组DNA导入哺乳动物细胞 哺乳动物细胞基因转移的效率大大低于大肠埃希菌,因而发展了多种基因转移技术,包括物理的、化学的或生物的方法。物理法有显微注射法、电穿孔法等;化学法有DNA-磷酸钙共沉淀转染法、DEAE-葡聚糖转染法等;生物法包括病毒感染法和融合法,融合法有脂质体介导、细胞融合、原生质体融合、微细胞介导等。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















