第五节 PCR技术的发展
PCR技术建立以来,因其较高的实用性而在各个领域广泛使用。PCR方法本身又在使用中不断得到发展,形成了一系列适合不同目的的特殊方法。
一、兼并引物PCR
密码子具有兼并性,因此,单以氨基酸顺序推测其编码的DNA序列是不精确的。但可以根据密码子的兼并性设计成对兼并引物,扩增所有编码已知顺序的核酸序列。用兼并引物时寡核苷酸中核苷酸序列可以改变,但核苷酸的数量应相同。兼并度越低,产物特异性越强。设计引物时应尽量选择兼并性小的氨基酸,并避免引物3′末端兼并,针对兼并的混合引物已成功地用于未知靶DNA的扩增、克隆和序列分析。现已成功地克隆了猪尿酸氧化酶基因、糖尿病相关肽基因和哺乳动物与禽类的嗜肝病毒基因。用脱氧肌苷(deoxyinosine,DI)引物进行PCR,可以代替编码蛋白的多种兼并密码子中的兼并碱基,DI的特异性主要受cDNA浓度影响。
二、套式引物PCR
先用一对外侧引物扩增含目的基因的大片段,再用内侧引物以大片段为模板扩增获取目的基因。用第一套引物扩增15~30个循环,再用扩增DNA片段内设定的第二套引物扩增15~30个循环,这样可使待扩增序列得到高效扩增,而次级结构却很少扩增。用起始引物限量方法或Centricon30(Amicon)分子滤过器离心,在第二套引物加入前去除第一引物。此方法已成功地用来分析中国仓鼠卵巢细胞AS52的分子突变。AS52细胞含有单拷贝的细胞gpt基因,与哺乳动物具有同源性。套式引物PCR减少了引物非特异性退火,从而增加了特异性扩增,提高了扩增效率。对环境样品中微生物检测和单拷贝的基因靶DNA的扩增是非常有效的。
三、多重PCR
用多对引物同时扩增几条DNA片段的方法称为多重PCR(Multiplex PCR)。在一次反应中加入多对引物,同时扩增一份DNA样品中的不同序列,由于每对引物扩增区位于模板DNA的不同部位,因而扩增片段长短不同,由此检测是否存在某些基因片段的缺失或突变。
这一方法最初是由Chanberlain等检测人的基因发展而来。Bej等随之发展了对环境样品中不同属细菌相关基因序列同时PCR扩增的检测方法。两种不同的军团菌基因,一为特异嗜肺L基因(mip),另一种为L-5SrRNA基因,通过引物摇摆添加进行多重PCR。首先用mip引物PCR扩增7个循环,然后加入5SrRNA引物PCR扩增38个循环。加入不同量的LacZ和LacB基因引物进行PCR扩增可以检测与人类粪便污染有关的细菌包括大肠埃希菌、肠源致病沙门菌和志贺菌。
在多重PCR中,所有引物Tm值应相近。如果两对引物Tm值差异超过±℃10%,会使扩增产物的量明显不同,其中一种扩增产物或目的DNA很难观察到。另外,靶DNA的长度也应相近,差别大时短片段靶DNA会优先扩增。因此,会产生不同产量的扩增产物,须采用DNA摇摆扩增或加入不等量的引物方法进行解决。
四、反向PCR
反向PCR(Inverse PCR或Reverse PCR)的目的在于扩增一段已知序列旁侧的DNA,也就是说这一反应体系不是在一对引物之间而是在引物外侧合成DNA。反向PCR可用于研究与已知DNA区段相连接的未知染色体序列,因此又可称为染色体缓移或染色体步移。这时选择的引物虽然与核心DNA区两末端序列互补,但两引物3′端是相互反向的。扩增前先用限制性内切酶酶切样品DNA,然后用DNA连接酶连接成一个环状DNA分子,通过反向PCR扩增引物的上游片段和下游片段。现已制备了酵母人工染色体(YAC)大的线状DNA片段的杂交探针,这对于转座子插入序列的确定和基因库染色体上DNA片段序列的识别十分重要(图5-2)。
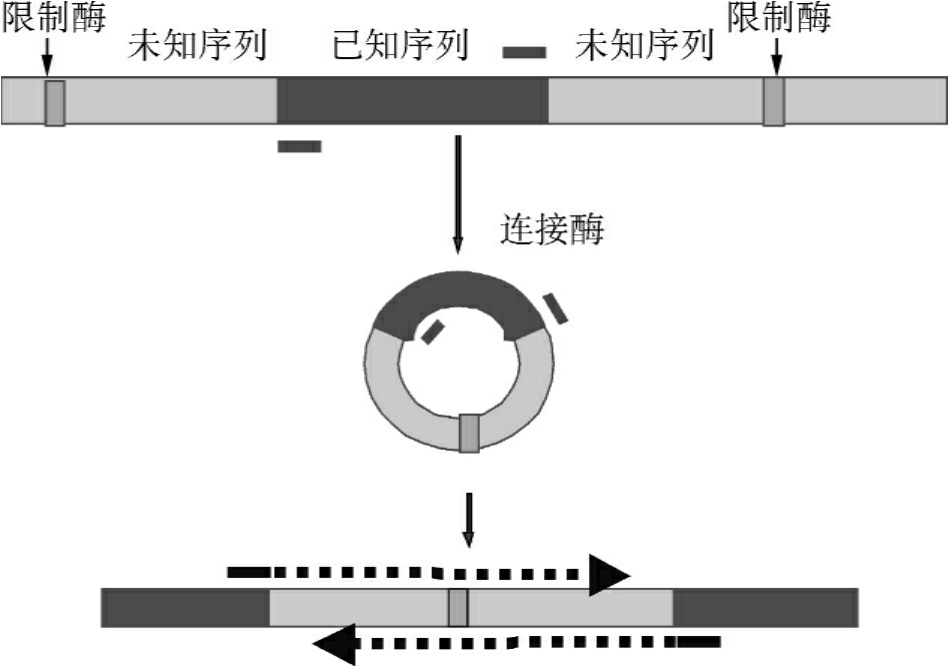
图5-2 反向PCR
利用反向PCR可对未知序列扩增后进行分析,探索邻接已知DNA片段的序列,并可将仅知部分序列的全长cDNA进行分子克隆,建立全长的DNA探针。适用于基因游走、转位因子和已知序列DNA旁侧病毒整合位点分析等研究。
该方法的不足是:①需要从许多酶中选择限制酶,或者说必须选择一种合适的酶进行酶切才能得到合理大小的DNA片段。这种选择不能在非酶切位点切断靶DNA。②大多数有核基因组含有大量中度和高度重复序列,而在YAC或Cosmid中的未知功能序列中有时也会有这些序列,这样,通过反向PCR得到的探针就有可能与多个基因序列杂交。
五、不对称PCR
不对称PCR(asymmetric PCR)的基本原理是采用不等量的一对引物产生大量的单链DNA(ss-DNA)。这两种引物分别称为限制性引物与非限制性引物;其最佳比例一般为1∶50~1∶100。此方法的关键是限制性引物的绝对量,限制性引物太多或太少,均不利于制备ss-DNA。也可用普通PCR制备靶DNA双链DNA(ds-DNA),再以ds-DNA为模板,只用其中一种过量引物进行单引物PCR制备ss-DNA。
产生的ds-DNA与ss-DNA由于相对分子质量不同可以在电泳中分开,而得到纯ss-DNA。
不对称PCR主要为测序制备ss-DNA,用cDNA经不对称PCR进行DNA序列分析是研究真核DNA外显子的好方法。
六、标记PCR(LP-PCR)和彩色PCR
Labelled Primers PCR(LP-PCR)是利用放射性核素、荧光素等对PCR引物5′端进行标记,据此检测目的基因的存在与否,与常规PCR相比更为直观,省去了限制性内切酶酶切及分子杂交等烦琐步骤,而且一次可以同时分析多种基因成分,因而特别适合于大量临床标本的基因诊断。目前该方法只对PCR产物进行定性鉴定。
彩色PCR(color complement assay)直译为“着色互补性检测”,是LP-PCR的一种,彩色PCR意义更为明确:它用荧光染料标记引物的5′端。荧光染料JOE和FAM呈绿色荧光;TAMRA呈红色荧光;COUM呈蓝色荧光。不同荧光标记的引物同时参加反应,扩增后的目的基因会分别带有引物5′端的染料,通过电泳或离心沉淀,肉眼就可以根据不同荧光的色泽判断目标基因是否存在及扩增基因的类型。通常仅需两种不同颜色的引物,一种作为基因检测引物;另一种作为控制条件的内对照,即可诊断基因缺失、染色体易位或感染某种病毒。检测多种点突变时,可用更多的色彩,如多点突变的遗传病、几种可疑病毒感染、HLA位点分析都可以用彩色PCR同时检测多个位点。
七、加端PCR
加端PCR(add-PCR)是使扩增产物的5′端加一段DNA顺序的PCR。设计加端PCR的引物时,除与模板配对的那一部分外再加上若干碱基,这样使扩增产物的末端加上额外一段DNA,如加上一个限制酶的识别顺序或特定功能的DNA片段。Stoflet等报道在结构基因前加上噬菌体T7的启动子。当然也可用于DNA片段的末端标记或引入特定的点突变。末端可加碱基的数量与引物的长短有关,当引物足够长时扩增产物或末端甚至可以加上十几个至几十个碱基。
八、锚定PCR或固定PCR(A-PCR)
通常采用的PCR反应必须知道欲扩增DNA或RNA片段两侧的序列,但在许多情况下,对于欲扩增片段旁侧序列或某端序列并不清楚。A-PCR可以克服序列未能全知的障碍获取目的扩增片段。
A-PCR主要用于分析具有可变末端的DNA序列,Loh等用A-PCR对人外周血淋巴细胞T细胞受体α-链的mRNA的多变性进行了分析。先合成cDNA,并用末端脱氧核苷酸转移酶在其3′-可变区末端加上一个PolyG尾巴。Loh等在恒定区与可变区连接部位设计一个引物,另一个引物是一个具5′-polyC尾巴的引物。带有PolyC尾巴的引物是一个固定点,它可以与PolyG尾巴结合,无论其余部分序列如何,只识别片段末端,利用此法可从前述mRNA中检出至少20种不同序列,每一种都是独特的,表明A-PCR不对任何特殊序列有倾向性结果,可用于T细胞、肿瘤及其他部位抗体基因的研究。
九、玻片PCR
在聚丙烯管中可以对多种含模板材料进行PCR,而在显微玻片上用组织细胞涂片或切片直接进行DNA扩增的方法就称为玻片PCR(Slide-PCR)。
先将细胞涂片或制备成单层细胞,然后用甲醇/醋酸(3∶1,V/V)、Carnoy溶液、无水乙醇或4%多聚甲醛溶液固定5~15min。用蒸馏水冲洗,干燥,直接使用或保存于-20℃备用。在玻片上划20mm×28mm为免疫组化反应区。加入30μl PCR反应混合液,然后盖上22mm×40mm的盖玻片,边缘用石蜡油封好。把玻片放入PCR热循环仪金属块上,使金属块与样品呈最大限度接触,同在聚丙烯管中一样,进行30~40个循环。对于较短的扩增片段在后期循环中变性温度可降低。反应后,将制冷玻片放在氯仿中除去大部分石蜡油,但不取出盖玻片,用一个尖镊子轻轻拈起盖玻片一角,在相对的一角中PCR反应混合液呈半月形液面,用移液器回收。一般可回收25μl混合液,将反应产物进行琼脂糖电泳或用套式PCR引物按标准PCR进行重新扩增。片上扩增物可做原位杂交显示。
Silde-PCR的机制可能是在起始变性过程中一部分DNA从细胞中洗提出来,然后在细胞和玻片的水相中进行PCR。用地高辛标记的人全基因组DNA探针杂交表明在起始循环中DNA极微量,而30个循环后很丰富。常规细胞染色表明只有少量的形态改变。
Silde-PCR对于玻片上的细胞样品提供了一种较好的方法,而不必再把这些样品从玻片上刮下来,使操作简便,污染减少。本方法对于原样品量极微且需病史追踪保存的样本(如子宫颈涂片)具有实用价值。
十、反转录PCR方法检测RNA
RNA的聚合酶链反应(RT-PCR)是以RNA为模板,联合反转录反应(reverse transcription,RT)与PCR,可用于检测单个细胞或少数细胞中少于10个拷贝的特异RNA,为RNA病毒检测提供了方便;并为获得与扩增特定的RNA互补的cDNA提供了一条极为有利和有效的途径。
RNA扩增包括两个步骤:①在单引物的介导下和反转录酶的催化下,合成RNA的互补链cDNA;②加热后cDNA与RNA链解离,然后与另一引物退火,并由DNA聚合酶催化引物延伸生成双链靶DNA,最后扩增靶DNA。
在RT-PCR中关键步骤是RNA的反转录,cDNA的PCR与一般PCR条件一样。由于引物的高度选择性,细胞总RNA无需进行分级分离,即可直接用于RNA的PCR。但RT-PCR对RNA制品的要求极为严格,作为模板的RNA分子必须是完整的,并且不含DNA、蛋白质和其他杂质。RNA中即使含有极微量的DNA,经扩增后也会出现非特异性扩增;蛋白质未除净,与RNA结合后会影响反转录和PCR;残存的RNase极易将模板RNA降解掉。硫氰酸胍(GaSCN)-CsCl法或酸性硫氰酸胍-酚-氯仿法可提取理想的RNA制品,尤以后者方法为佳,适合一般实验室进行。
常用的反转录酶有两种,即禽类成髓细胞性白血病病毒(avian myeloblastosis virus,AMV)和莫洛尼鼠类白血病病毒(Moloney murine leukemia virus,Mo-MLV)的反转录酶(RT)。一般情况下用Mo-MLV-RT较多,但模板RNA的二级结构严重影响反转录时,可改用AMV-RT,因后者最适温度为72℃,高于Mo-MLV-RT的最适温度(37℃),而较高的反应温度有助于消除RNA的二级结构。
一步法扩增(one step amplification)是为了检测低丰度mRNA的表达,利用同一种缓冲液,在同一体系中加入反转录酶、引物、Taq酶和4种dNTPs直接进行mRNA反转录与PCR扩增。发现Taq酶不仅具有DNA聚合酶的作用,而且具有反转录酶活性,可利用其双重作用在同一体系中直接以mRNA为模板进行反转录和其后的PCR扩增,从而使mRNA的PCR步骤更为简化,所需样品量减少到最低限度,对临床小样品的检测非常有利。用一步法扩增可检测出总RNA中<1ng的低丰度mRNA。该法还可用于低丰度mRNA的cDNA文库的构建及特异cDNA的克隆,并有可能与Taq酶的测序技术相组合,使得自动反转录、基因扩增与基因转录产物的测序在一个试管中进行。
十一、实时荧光定量PCR
实时荧光定量PCR(real-time PCR)是1996年由美国应用生物系统公司(Applied Biosystems)推出的一种新的PCR技术,其原理是利用特异荧光基团标记PCR产物,通过实时检测PCR每一个循环扩增产物相对应的荧光信号,来实现对起始模板进行定量及定性的分析。该方法的出现不仅实现了PCR从定性到定量的飞跃,而且与常规PCR相比,具有特异性更强、有效解决PCR污染问题、自动化程度高等特点,目前已广泛应用于基因表达研究、转基因研究、病原体定量检测、药物疗效考核、疾病分类及其发病机制的研究、新药验证等生命科学领域。
实时荧光定量PCR扩增时每个循环都会有荧光释放,由电脑软件记录每一循环后的荧光强度就会形成扩增曲线,该曲线是S型,包括基线期、指数期、线性期和最终的平台期。因此,可以在PCR反应处于指数期的某一点上来检测PCR产物的量,并且由此来推断模板最初的含量,即根据荧光强度达到给定域值(threshold)所需的循环数就可精确计算出起始模板的含量。所以,为了便于对所检测样本进行比较,在实时荧光定量PCR反应的指数期,首先需设定一定荧光信号的域值,一般这个域值就是以PCR反应的前15个循环的荧光信号作为荧光本底信号(baseline),荧光域值的默认值通常设置为3~15个循环的荧光信号的标准偏差的10倍。如果检测到荧光信号超过域值就被认为是真正的信号,它可用于定义样本的域值循环数(Ct)。Ct值的含义是:每个反应管内的荧光信号达到设定的域值时所经历的循环数。研究表明,每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系,起始拷贝数越多,Ct值越小。利用已知起始拷贝数的标准品可作出标准曲线,因此只要获得未知样品的Ct值,即可从标准曲线上计算出该样品的起始拷贝数(图5-3)。

图5-3 实时荧光定量PCR的标准扩增曲线
实时荧光定量PCR所使用的荧光化学一般有两种:荧光探针和荧光染料。常用的荧光染料是SYBR green 1;常用的荧光探针是TaqMan荧光探针和分子信标。现将其原理简述如下。
1.SYBR荧光染料 在PCR反应体系中,加入过量SYBR green 1荧光染料,SYBR green 1荧光染料特异性地掺入DNA双链后,发射荧光信号。而不掺入链中的SYBR染料分子不会发射任何荧光信号,从而保证荧光信号的增加与PCR产物的增加完全同步。该法虽是扩增序列非特异性检测方法,但该法的优势在于它能监测任何dsDNA序列的扩增,不需要探针的设计,使检测方法变得简便,同时也降低了检测的成本。然而正是由于荧光染料能和任何dsDNA结合,因此它也能与非特异的dsDNA(如引物二聚体)结合,使实验容易产生假阳性信号。引物二聚体的问题目前可以用带有熔解曲线分析的软件加以解决。
2.TaqMan荧光探针 PCR扩增时,在加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团。探针荧光信号被淬灭荧光基团吸收。PCR扩增过程中,当引物延伸至结合探针的模板处时,Taq酶的5′→3′外切酶活性将探针酶切降解,使报告荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。
3.分子信标 是一种标记荧光的发夹探针,当探针分子呈发夹结构时,结合在其两端的报告荧光基团与淬灭荧光基团距离上接近,产生能量转移效应而不发生荧光。当互补序列出现时,探针与DNA杂交,探针转变成一个开放的结构,呈线性,报告荧光基团与淬灭荧光基团彼此在空间上产生足够的分离,荧光基团脱离了淬灭基团的影响,从而产生可被检测到的荧光(图5-4)。
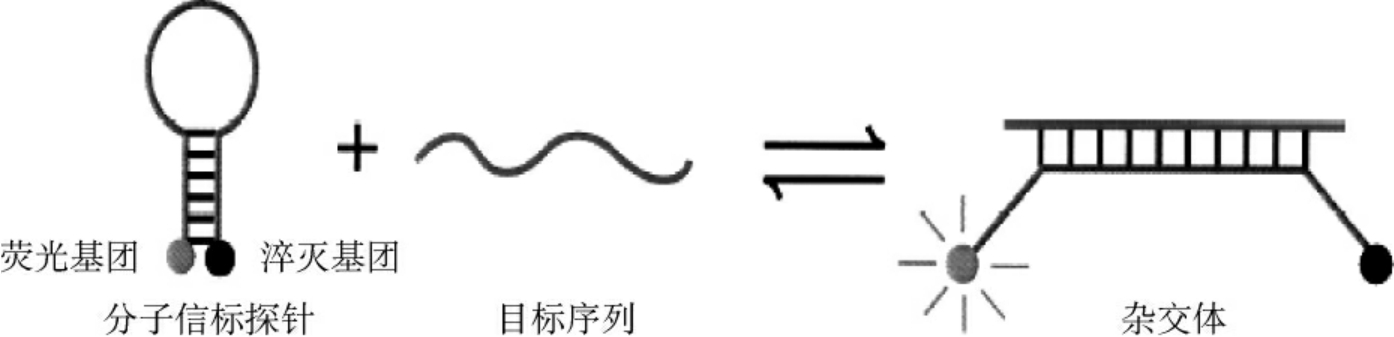
图5-4 分子信标
如果对不同分子信标探针修饰以具有不同特征发射波长的荧光发射基团,就可在同一激发光下,通过检测这些特征波长的荧光强度,实现在同一体系中的多基因分析。
实时荧光定量PCR与定性PCR(常规PCR)测定的最根本的区别是:实时荧光定量PCR测定的测定点为PCR扩增的指数扩增期,而定性PCR测定的测定点多为PCR扩增的平台期。此外,定性PCR的扩增产物通常需用琼脂糖凝胶电泳和溴化乙啶染色并在紫外光下观察结果,而实时荧光定量PCR是在全封闭状态下实现扩增及产物分析,无需电泳和溴化乙啶染色。
(王松梅 陈季武)
参考文献
1.迪芬巴赫CW,德维克斯勒GS.PCR技术实验指南.北京:科学出版社,2000
2.哈伍德AJ.DNA及RNA基本实验技术.北京:科学出版社,2002
3.王廷华,景强,Pierre Dubus.PCR理论与技术.北京:科学出版社,2005
4.冯作化.医学分子生物学.北京:人民卫生出版社,2001
5.张钦宪,何丽娅,李平法.医学分子生物学.郑州:郑州大学出版社,2003
6.张维铭.现代分子生物学实验手册.北京:科学出版社,2003
7.梁国栋.最新分子生物学实验技术.北京:科学出版社,2001
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















