三、昆虫病毒的分子生物学
1.昆虫病毒蛋白质。从20世纪70年代后期以来,杆状病毒蛋白质的研究取得了较大进展。由研究其蛋白质的种类深入到研究蛋白质的结构和功能,在分子水平上为免疫学和病毒分类提供了理论依据。昆虫病毒蛋白质的功能有以下几点:
(1)保护作用:如昆虫病毒多角体蛋白;
(2)吸附与侵入:如昆虫病毒的碱性蛋白酶;
(3)降解宿主DNA:如虫痘病毒的核酸酶;
(4)合成病毒核酸:如AcNPV的DNA多聚酶,甲壳虫RNA病毒的RNA多聚酶;
(5)修饰作用:如AcNPV的蛋白激酶,昆虫痘病毒的核苷酸磷化酶;
(6)增加毒力:如昆虫病毒的增效因子。
近年来,国内外许多学者用SDS-PAGE对杆状病毒的包涵体蛋白的结构多肽进行了分析,认为它们都极其相似。如AcNPV,IdNPV,MbNPV和GV的包涵体蛋白都有分子量为28~30kU的主要结构多,其差别仅在小分子多肽上[14]。早些时候的报道认为,包涵体和核衣壳的多肽种类不多,如AcMNPV的衣壳多、仅有14种。最近Singh[15](1983)用高压双向电泳确定,AcMNPV的包涵体病毒粒子有81个酸性多肽,核衣壳有64个多肽。
Rohrmann等[16](1979)对黄杉毒蛾OpMNPV和OpSMPV的多角体蛋白进行了详细研究,提出它们的蛋白质有密切相关的氨基酸顺序,只在N-末端的34个氨基酸中仅有4个不同。有趣的是,同家蚕BmNPV比较,在34个氨基酸中也分别只有4个和5个不同。说明OpNPV和BmNPV有极其密切的亲缘关系。在这34个氨基酸中有6个酪氨酸,它们分成两群集聚在末端20个氨基酸以内,由于酪氨酸的pKa~10,它们可能与多角体在中肠中的碱解有关。所以,酪氨酸的成群分布具有特异性功能。
Kozlov等[17]是最早研究多角体氨基酸顺序的。1977年,他们首次报道了家蚕BmNPV包涵体蛋白氨基酸的全部顺序。最近,Rohr-mann[18]将直到1982年发表的黄杉毒蛾OpMNPV,大蜡螟GmNPV,舞毒蛾LdMNPV,家蚕BmSNPV,黄杉毒蛾OpSNPV,大菜粉蝶Pb-GV,锯角叶蚕NsSNPV,沼泽大蚊TpSNPV的包涵体蛋白氨基酸顺序进行了比较,发现至少有6个大的相同区域,不相同的比例是很少的。因此认为,包涵体蛋白氨基酸顺序分析资料与杆状病毒的分布和昆虫宿主的进化一致,称为宿主依赖性进化。
他们将家蚕BmSNPV的全部氨基酸顺序按亲水性程度进行排列,得到了有意义的结论,根据Hopp和Woods[19]的理论,即分子上抗原位点可用初级结构即每个氨基酸亲水值的高低来预测。Rohrmann认为,BmNPV的6个抗原位点,最高亲水区或主要抗原决定族是在氨基酸40~50之间,这一区域正好是最可变区,是不同杆状病毒种属特征的主要标志。
2.昆虫病毒酶。昆虫病毒酶的研究起步较晚,到目前为止仅在11种昆虫病毒中发现了8种酶,研究最多的是碱性蛋白酶(表1)。
表1 已发现的昆虫病毒酶

续表

当杆状病毒侵入中肠后,碱性蛋白酶降解多角体,释放病毒粒子。一般认为,其最适pH值为9.5,不耐热,加热60~70℃,20~30min即失活。
Payne等[20](1978)用亲和层析法SINPV分离了这种酶,比活提高80倍。主要定位在病毒粒子中。但多数报道认为,此酶定位在包涵的结晶蛋白中。
齐义鹏和Stairs[21,22]1982年研究了GmNPV的蛋白酶。他们用Sephacryl进行分离,比活提高50倍,最适pH值是8.8,与Langeridge[23]所得结果一致。他们认为,GmNPV多角体的降解有酶解和碱解两种机制,蛋白酶降解多角体的最适pH值是8.8,与大蜡螟幼虫中肠平均pH 8.04接近。在pH 11时,此酶无活性,多角体的降解为碱性的化学水解。
杆状病毒碱性蛋白酶的来源是一个有争论的问题。一般认为,它是由病毒基因组编码的[24],但近两年来,Tanada等认为[25-28],此酶由宿主编码,在中肠中被病毒包涵体吸附。
此外,被AcNPV感染的幼虫体内,还可诱导一种新的DNA多聚酶[29]和蛋白激活酶[30],其磷酸化的主要底物是丝氨酸和苏氨酸。
3.杆状病毒的DNA及其基因组结构Autographa california多角体病毒(AcMNPV)是NPV亚群的代表,研究得最为深入。据报道,此病毒为共价、闭合环状的双链DNA(cccds-DNA),超螺旋占30%~50%,非甲基化,有128kb,分子量82×106U,大约能编码60%~70%的蛋白质,其中定位了25个基因[31]。
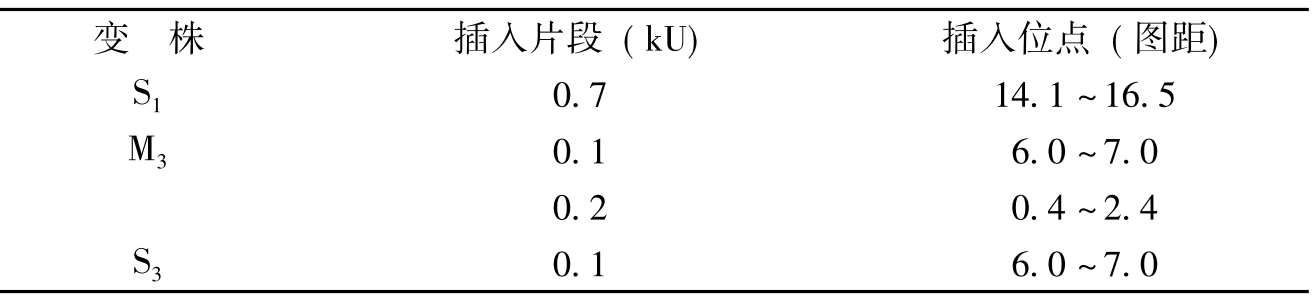
G.Smith[32](1979)用限制酶测定了AcMNPV空斑纯化的几个变株DNAs的物理图谱。为了阅读方便,物理图谱也可被绘制成线形,以EcoRI位点作为基因组的零点,分成100个图距单位。各基因在基因组上的定位以限制位点或图距表示。他们比较了AcMNPV变株E2,S1,M3,S3,R3以及GmMNPV和TnMNPV DNA的物理图谱。发现,它们的图谱非常相似,相互之间仅有小的差异,或插入一小段顺序,或增减1、2个限制位点。插入顺序一般多在AcMNPV变株间发生,见表2。
表2
限制性位点的增减一般多在来自不同宿主NPV基因组之间发生,见表3。
表3

凡是基因组有轻微差异的不同地理分布分离物叫基因型变株(genotype variant)。Summers等提出的所谓亚克分子带(submolar),实质上是遗传异质的几个变株的混合物,其中一个是优势种,通过空斑纯化是可以将它们分开的。
基因组顺序同源性的研究也得到了与上述相同的结果[33,34]。因而,杆状病毒的分类,以感染宿主为依据是不十分合理的,同一杆状病毒的不同地理分离物具有一定的亲缘关系;感染不同宿主的NPV甚至很可能是一个种的不同变种。
4.杆状病毒基因的定位、复制、转录和表达。当AcMNPV感染后5小时(5hr pi),DNA开始复制,18hr pi DNA复制达到高峰,以后下降。以病毒DNA作模板转录成mRNA,有早期和晚期两个阶段[35]。
L.Fuchs[35]指出,7hr pi早期转录即开始,由于病毒粒子不含RNA多聚酶,以及早期转录时对2-amanitin的敏感,所以,病毒在早期转录时必定是借用宿主RNA多聚酶,因为宿主RNA polyⅡ是惟一对此试剂敏感的酶,晚期转录时才由病毒自己的RNA多聚酶起作用。
目前,在AcMNPV的物理图谱上已经定位了25个基因[36],研究得最清楚的是多角体蛋白基因(polyhedrin基因)。
AcMNPV的多角体蛋白基因转录体是一个有12000bp的poly Am-RNA,无间隔顺序,没有可测定的intron,该基因定位在HindⅢV/E,coRLⅠ区域,图距3~4。其5'末端起始于3990bp。3'末端终止于52000bp。在3'末端有特异性的TATTATTATAA顺序,包含了转录起始中的Goldburg-Hogness box[18,36,27]。
1983年,Miller等[38]根据功能阻断试验将病毒基因的表达分为4个阶段;①早期(α期),在感染后3小时;②中期(β期),在感染后5~7小时;③中期(γ期),在感染后10~12小时;④晚期(δ期),在感染后15小时。
M.Erlandson[37,39]等指出,前期(早、中期)表达的蛋白质数目为20种,晚期表达的蛋白质大约有30~35种[40],主要的晚期蛋白是32K(或28K)的包涵体蛋白和一种10K蛋白。39K蛋白也可能是主要的晚期蛋白之一[39,41]。
5.遗传工程在昆虫病毒领域的新成就。在昆虫病毒领域应用遗传工程只是一个新的开端,但却显示了巨大的威力。最近几年来取得的成就略述如下:
(1)突变及其在昆虫病毒遗传工程中的应用。
①Morph突变[42]:即形态突变。凡产生类似野生型的NOV和包涵体蛋白,但不形成包涵体的突变叫Morph突变(O-突变)。R.Duncon等[42](1983)用5-溴尿嘧啶处理AcMNPV DNA,在5f细胞上,空斑纯化,得到Morph29。它可以用来研究包涵体形态发生基因的表达和调控,也可作为遗传工程的重筛选标记。
②ts突变[38]:即温度敏感性突变,Miller[38]在1983年得到了tsB821在33℃感染,它缺失早期基因功能,特别是不能合成包涵体蛋白和7.2K蛋白,阻遏了早期向晚期的过渡。在23℃培养则恢复正常感染。
③FP突变[43]:Miller用AcMNPV感染粉纹夜蛾Tn细胞,传代25次,得到了一些自然发生的突变株,它们极少产生包涵体的病毒(fewer poly hedra FP)。突变实质是在病毒基因组中插入了一段宿主DNA。Fraser等从AcMNPV的空斑中得到了一些FP突变,这些FP突变是在35~37.7图距间插入了0.8到2.8kb的片段,Miller的FP突变是在86.4~86.6图距间插入7.3kb的片段。
(2)基因定位及表达的研究:杆状病毒基因组有多少个基因?如何排列?各个基因表达的产物是什么?这是研究杆状病毒的基本问题。
Adang与Miller等用逆转录酶法[45](或末端转移法)对这些问题进行了初步的研究。他们首先从AcMNPV感染的病尸幼虫中分离任一mRNA,用逆转录酶合成RNA-DNA杂合双链,加热至100℃3分钟,并速冷退火,得到ssDNA,再用DNA多聚酶合成ds DNA。为了进行克隆,在dCTP存在下用末端转移酶得到两端带胞嘧啶核苷酸的DNA;同法得到两端带鸟嘌呤核酸的质粒pBR322DNA。将它们混合,加热至65℃10分钟,缓慢冷却到室温,两DNA链的GC通过氢键配对融合成环状的新质粒,用此质粒转化大肠杆菌RRI,菌落表型为TetrAPS。通过转录产物的测定和核酸顺序分析,即可确定基因的类型及其定位。Miller等用此法定位了AcMNPV的25个基因。
此法的创新之处在于,它不用限制性内切酶消化制备粘性末端,而用同源聚合尾巴(homopolvmer tail)使客体载体通过氢键融合,便于用完整基因研究其表达。
Rohrmann[18]用分子杂交法确定了AcMNPV的多角体蛋白基因及其功能。他从病死虫体分离出mRNA,用麦胚转录系统找出多角体蛋白基因的mRNA,再用Northern blot法与病毒DNA杂交,而“钓出”多角体蛋白基因,将它克隆进质粒pBR322里,成为一个新质粒Poms-Q,此质粒含有多角体蛋白基因,且能转化大肠杆菌,并在其中复制。
接着Mokarski[46](1980)用等位交换法(或标记营救)组建了一个带有缺陷型多角体蛋白基因的AcMNPV病毒。他先将AcMNPV多角体蛋白基因克隆进质粒pBR 322上,再用限制酶KpNI切割此基因,则得到两个末端都带有多角体蛋白基因片段的线性重组质粒。经过末端修饰和再连接酶连接,就得到了带有缺陷性多角体蛋白基因的重组质粒,将它和野生型AcMNPV(wt-AcMNPV)合作转感Sf细胞,在二者的同源顺序(即多角体蛋白基因)之间发生交换。
由于此病毒的多角体蛋白基因是有缺陷的,因而子代病毒不能形成包涵体,而以O-空斑被筛选出来。以O-为筛选标记是Summers等的创举[36]。Smith与Summers等(1983)[37]用包涵体缺陷型O-表型作为标记筛选杆状病毒同源重组体,做了大量工作。
(3)利用杆状病毒基因组作为新的遗传工程载体。遗传工程载体一般是用plasmid、comid和噬菌体。最近,用动物病毒组建的新载体——穿梭载体(shuttle vector)问世,使昆虫病毒基因组作载体的研究也相应发展起来[13,36,47]。其优点有以下几点:
①有大的负荷:杆状病毒基因组较大,可容纳较大以上的外源DNA片段,并可延伸。
②有好的标记:包涵体形成基因的缺失对病毒复制和包涵体蛋白的合成无影响,但不能形成包涵体,具有O-表型,可作为筛选标记。
③高的产量:多角体蛋白基因有一个强大的启动子(promotor)可以启动客体基因的高水平表达。
④更为安全:过去人们担心,遗传工程有可能创造出自然界没有的怪物,对人类产生毁灭性的危害。由于O-重组体在自然界生存时间短暂,不可能有这种危害。
最近,几个新的杆状病毒质粒被组建成功并得到了初步的应用。
(1)质粒pEXS942的组建[47]:Miller等组建的这个质粒包含了完整的多角体蛋白基因,它可作遗传工程的载体,插入外源DNA片段,即可直接在原核细胞中表达。
他们在筛选时,开始认为可得到一个只带1.9~5.9的多角体蛋白基因片段,但意外地克隆了一个0~3.9的含有EcoRI~I.R.O的片段。
(2)质粒pGP-B6874及β-半乳糖苷酶的产生:G.Pennock[13]以杆状病毒作载体在多角体蛋白基因区克隆β-gal基因,然后与完整病毒合作转感Sf细胞,筛选出病毒空斑,其遗传特征是,O-lac+β-gal基因表达产生β-半乳糖苷酶,这是杆状病毒作载体在遗传工程上成功应用的第一个例子。
(3)质粒PAC380的组建及干扰基因的表达:人干扰素基因在昆虫细胞中的表达是遗传工程的又一创举。1984年,在美国纽约举行的第16届SIP年会上,M.S.ummers和Smith首次报告[48],他们将PAC380-IFN-B质粒等位交换插入野生型AcMNPV基因组中,成为一个人工病毒。它包括质粒puc8,人干扰素基因,缺陷的包涵体蛋白基因和AcMNPV基因组。它能在昆虫细胞中复制,以O-空斑被筛选,产生很高水平的干扰素,95%以上能分泌到细胞外面。这种人工病毒有可能用于害虫的生物防治。我们也正在考虑遗传工程手段生产病毒杀虫剂。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














