实验十二血凝素基因的原核表达
一、实验目的
掌握原核表达蛋白的方法。
二、实验原理
E.coli是重要的原核表达体系。在重组基因转化入E.coli菌株以后,通过温度或者诱导物等的诱导,诱导其在宿主菌内表达目的蛋白质。提高外源基因表达水平的基本手段之一,就是将宿主菌的生长与外源基因的表达分成两个阶段,以减轻宿主菌的负荷。
本实验采用异丙基硫代-β-D-半乳糖昔(IPTG)诱导外源基因表达。
不同的表达质粒表达方法并不完全相同,因启动子不同,诱导表达要根据具体情况而定。诱导表达后可通过SDS-PAGE电泳来检测表达蛋白质。
细菌裂解的常用方法有:①高温珠磨法;②高压匀浆;③超声破碎法;④酶溶法;⑤化学渗透等。前三种方法属机械破碎法,并且方法①、②已在工业生产中得到应用,后三种方法则在实验室研究中应用较为广泛。
酶溶法中常用的溶解酶有溶菌酶、β-1,3-葡聚糖酶、β-1,6-葡聚糖酶、蛋白酶、壳多糖酶、糖昔酶等。溶菌酶主要对细菌类有作用,而其他几种酶对酵母作用显著。
而超声波破碎法的原理是声频为15~20kHz的超声波在高强度声能输入下可以进行细胞破碎,在处理少量样品时操作简便,液体量损失较少,同时还可对染色体DNA进行剪切,大大降低液体的粘稠度。
三、实验材料
1.诱导表达材料
(1)LB (Luria-Bertani))培养基(见实验七)。
(2)IPTG储备液:2g IPTG溶于10mL蒸馏水中,0.22μm滤膜过滤除菌,分装成1mL/份,-20℃保存。
(3)1×凝胶电泳加样缓冲液:50mmol/L Tris-Cl(pH6.8),50mmol/L DTT,2% SDS(电泳级),0.1%溴酚蓝,10%甘油。
2.大肠杆菌包涵体的分离与蛋白纯化材料
(1)酶溶法
①裂解缓冲液:50 mmol/LTris-Cl(pH8.0),1 mmol/L EDTA,100 mmol/L naCl。
②50mmol/L苯甲基磺酰氟(PMSF)。
③10mg/mL溶菌酶。
④脱氧胆酸。
⑤1mg/mL DNase I。
(2)超声破碎法
①TE缓冲液。
②2×SDS-PAGE凝胶电泳加样缓冲液:100mmol/L Tris-HCl (pH8.0),100mmol/L DTT,4%SDS,0.2%溴酚蓝,20%甘油。
四、实验步骤
1.外源基因的诱导表达
取上一个实验验证后的细菌进行下面实验。
(1)从平板上挑取单菌落,接种于5mlLB液体培养基中培养过夜,
(2)按照1∶50~1∶100的比例接种,37℃培养细菌数小时达到对数生长期后,取1ml备用,其余加IPTG至终浓度为1 mmol/L。继续培养3~5h。
(3)每小时取上述培养液1ml,1000g离心1min,取沉淀,加100μl聚丙烯酰胺凝胶电泳上样缓冲液后,作SDS-PAGE检测(具体操作步骤见实验十六)(图12-1)。
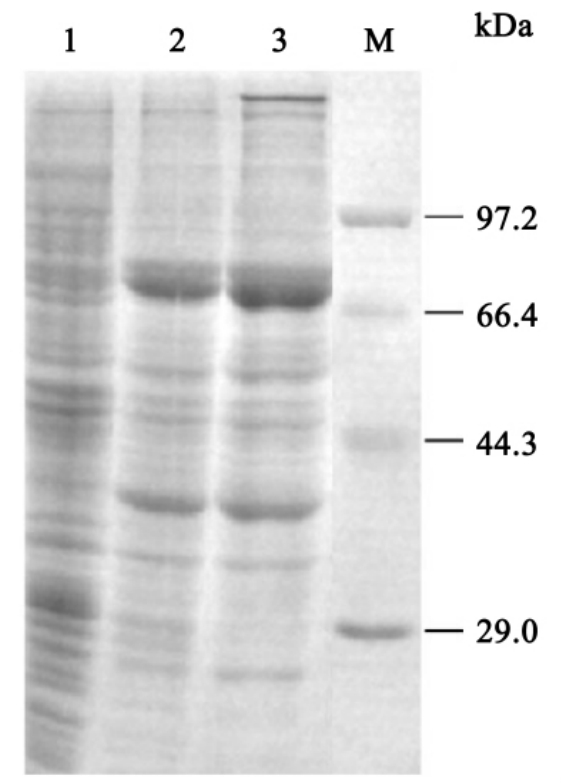
图12-1 大肠杆菌原核表达
表达前;2.诱导表达2h;3.诱导表达4h)
2.大肠杆菌包涵体的分离与蛋白质纯化
(1)酶溶法
①4℃,5000r/min离心15min,收集诱导表达的细菌培养液(100ml)。弃上清液,约每克湿菌加3ml裂解缓冲液,悬浮沉淀。
②每克菌加8μl PMSF及80μl溶菌酶,搅拌20min;边搅拌边每克菌加4mg脱氧胆酸(在冷室中进行)。
③37℃,玻棒搅拌,溶液变得粘稠时每克菌加20μl DNase I。室温放置至溶液不再粘稠。
(2)超声破碎法
①收集1L诱导表达的工程菌,40℃,5000r/min离心15min;弃上清液,约每克湿菌加3ml TE缓冲液。
②按超声处理仪厂家提供的功能参数进行破菌;10000g离心15min,分别收集上清液和沉淀。
③分别取少量上清液和沉淀,加入等体积的2×凝胶电泳加样缓冲液,进行SDS-PAGE。
注意事项:
超声破碎与声频、声能、处理时间、细胞浓度、菌种类型等因素有关,应根据具体情况掌握;超声波破菌前,标本经3~4次冻溶后更容易破碎。
五、方法评注
细菌质粒是一类双链闭环的DNA分子,它们可以利用宿主的酶和蛋白质进行独立复制和遗传。表达载体一般都含有强的启动子和有效的核糖体结合位点,当外源基因编码序列定向克隆入这些载体的多克隆位点之后,在适当的条件下(如温控诱导、化学诱导)诱导表达,就可产生目的蛋白质。这样表达的蛋白绝大多数为融合蛋白。融合表达具有高表达,高稳定性(相对于天然蛋白质)以及易鉴定和纯化等优点。
六、技术要点
(1)单菌落首先要进行活化,然后才能进行诱导表达;
(2)诱导表达时,菌液的生长状态非常重要,一般要求细菌处于对数生长期,可以检测菌液的OD600值,一般要求OD600nm在0.5~0.7;
(3)诱导温度,时间和IPTG的浓度对表达有很大的影响,可以影响外源蛋白质在宿主菌中的表达形式。如有些蛋白质需要在低温下(如20℃诱导)才能得到可溶性的表达。
附
1.包涵体的分离
蛋白质在细菌中的高水平表达,常形成在相差显微镜下可见的细胞质颗粒,即为包涵体,经离心沉淀后可用Triton-X100 / EDTA或尿素洗涤,若为获取可溶性的活性蛋白质,须将洗涤过的包涵体重新溶解并进行重折叠。
(1)试剂与配制
①洗涤液I:0.5% Triton X 100,10 mmol/L EDTA (pH8.0)溶于细胞裂解液中。
②2×凝胶电泳加样缓冲液。
(2)细胞裂解混合物12000g离心15min,4℃;弃上清液,沉淀用9倍体积洗涤液I悬浮;室温放置5min,12000g离心15min,4℃;吸出上清液,用100μl水重新悬浮沉淀;分别取10μl上清液和重新悬浮的沉淀,加10μl2×凝胶电泳加样缓冲液,进行SDSPAGE。
2.包涵体的溶解和复性
(1)试剂与配制
①缓冲液I:1 mmol/L PMSF,8mol /L尿素,10 mmol/L DTT溶于裂解缓冲液中。
②缓冲液Ⅱ:50 mmol/L KH2PO4,1 mmol/L EDTA (pH8.0),50 mmol/L NaCl,2 mmol/L还原型谷胱甘肽,1 mmol/L氧化型谷胱甘肽
③KOH和HCl。
④2×凝胶电泳加样缓冲液。
(2)用100μl缓冲液I溶解包涵体;室温放置1h;加9倍体积缓冲液Ⅱ,室温放置30min,用KOH调到pH 10.7;用HCl调至pH8.0,在室温放置至少30min; 1000g离心15min,室温;吸出上清液并保留,用100μl2×凝胶电泳加样缓冲液溶解沉淀;取10μl上清液,加10μl2×凝胶电泳加样缓冲液,与20μl重新溶解的沉淀进行SDS-PAGE。
注意事项:
①不同的大肠杆菌表达载体带有不同的启动子和诱导成分。实验者必须根据特定系统和用途决定相应的实验方案。
②表达和检测时,应设置对照组,如转化载体和非诱导细胞。
③由于大肠杆菌中表达的重组蛋白质缺少哺乳动物细胞特异的翻译后加工,所以,其生物活性无法与天然蛋白质相提并论。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















