9.1.5 过氧化氢
过氧化氢H2O2可以看作是O2发生二电子还原的产物,是一种淡蓝色黏性液体,沸点152℃,冰点-0.89℃,易溶于水。H2O2分子具有非对称的链状结构,分子绕O—O键内旋转的势垒较低。液态H2O2通过氢键进行缔合。其实过氧化氢不是自由基,但它是很重要的活性氧,而且可以通过反应产生自由基。
9.1.5.1 过氧化氢的产生
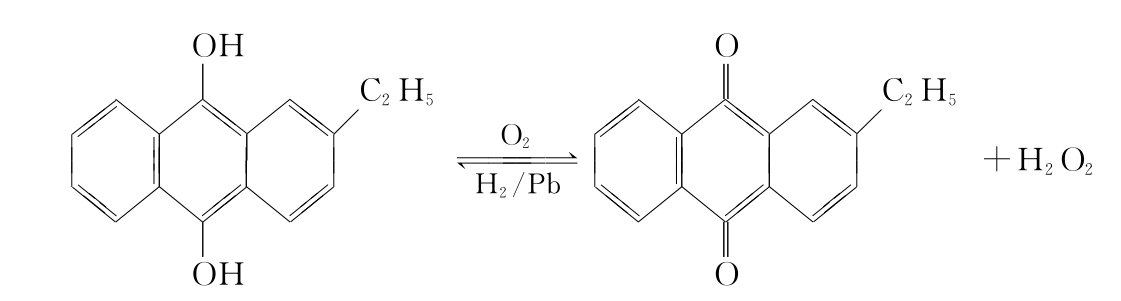
过氧化氢可以在形成过二硫键根离子与紧接着发生水解的电解过程中获得。利用蒽醌醇的自动氧化,亦可大规模地生产过氧化氢。如用2-乙基蒽醌醇生产H2O2为一连续的循环过程,原料只需H2、大气中的O2和水。
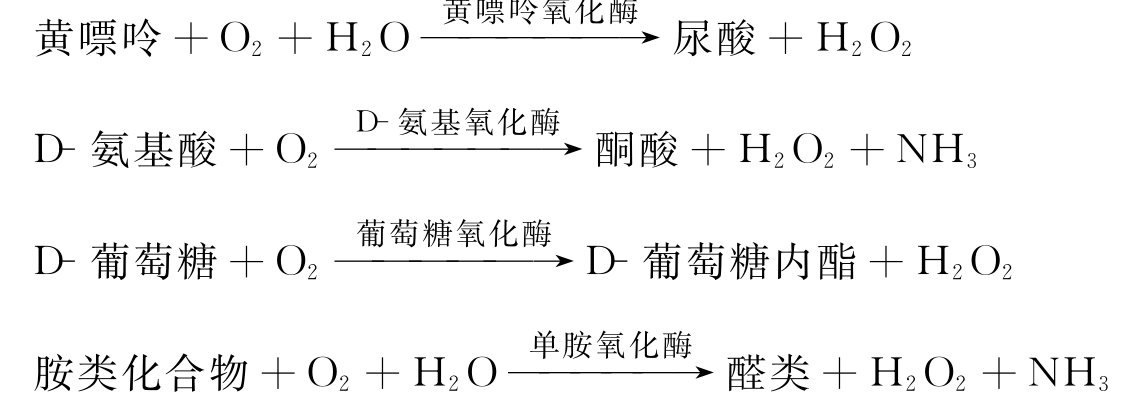
对于生物系统,可以说凡是能够产生超氧阴离子自由基 的体系,都可通过歧化反应生成H2O2
的体系,都可通过歧化反应生成H2O2
![]()
除非 被其他分子,例如高浓度的细胞色素c所截获。SOD可使歧化反应大大加速。体外对线粒体、微粒体、胞浆等的研究都可观察到所生成的H2O2,主要来源于
被其他分子,例如高浓度的细胞色素c所截获。SOD可使歧化反应大大加速。体外对线粒体、微粒体、胞浆等的研究都可观察到所生成的H2O2,主要来源于 。
。 的损伤作用也往往是由歧化反应生成的H2O2所介导的。
的损伤作用也往往是由歧化反应生成的H2O2所介导的。
还有几种酶促反应可不经由 产生H2O2,例如乙醇酸酯氧化酶、D-氨基酸氧化酶、尿酸氧化酶、黄嘌呤氧化酶等。
产生H2O2,例如乙醇酸酯氧化酶、D-氨基酸氧化酶、尿酸氧化酶、黄嘌呤氧化酶等。
9.1.5.2 过氧化氢的反应
过氧化氢是一种较强的氧化剂,具有杀菌防腐之功效,这是因为O—O键较弱,在紫外光照射下发生均裂产生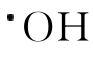 。
。
![]()
当然,H2O2也是一种温和的还原剂,它含有的氧处于-1的氧化态,可以自发地发生歧化反应产生分子氧(氧化态为0)和水,水分子的氧处于-2的氧化态。
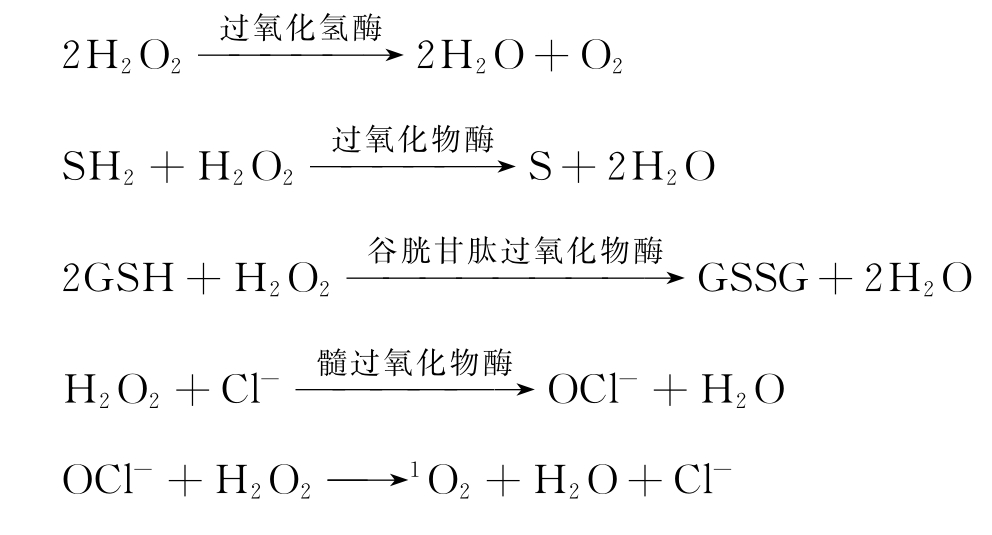
固然,过氧化氢酶和过氧化物酶都可清除H2O2,但前者是催化H2O2分解为H2O和O2,而后者则催化H2O2氧化其他底物(以SH2表示)后才产生H2O。
H2O2是O2二电子还原的产物,具有较强的氧化性。但在较强的氧化剂存在时,也具有一定还原性。它可以直接氧化一些酶的巯基,使酶失去活性。甘油醛-3-磷酸脱氢酶就是以这种方式被过氧化氢失活的,菠菜叶绿体的果糖二磷酸酶也是以这种方式失活的。过氧化氢还可以非酶氧化丙酮酸,也可以参与以下反应:
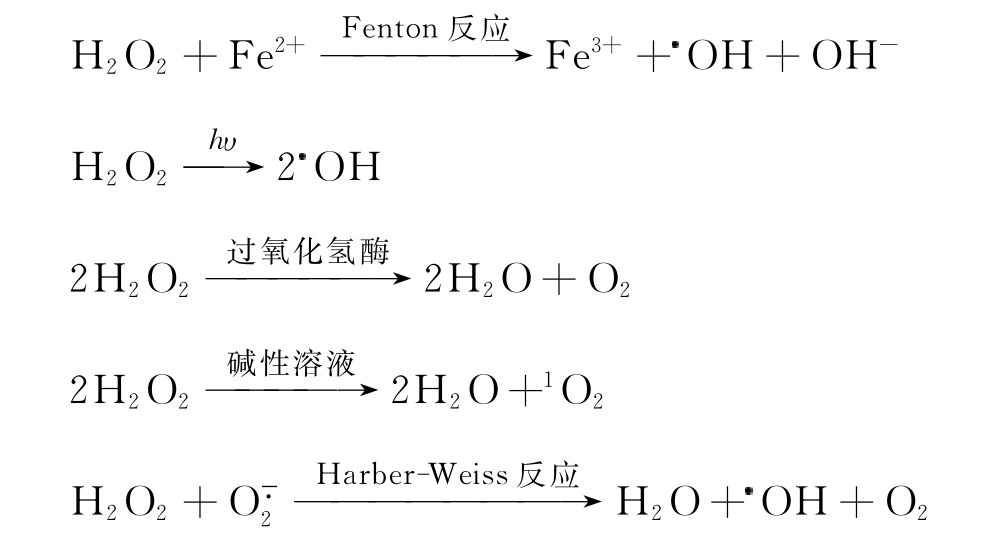
一些研究表明,Fenton反应有激发态的铁氧复合物产生。
过氧化氢可以穿透大部分细胞膜,这是超氧阴离子自由基不能相比的。这就增加了过氧化氢的细胞毒性,当它穿越细胞膜后就可以与细胞内的铁反应产生羟基自由基。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















