9.2.3 NO、 与SOD的关系
与SOD的关系
一氧化氮(NO)是自由基,具有生理学作用与病理生理学作用的独特生物学效应。该项重大发现掀起了世界各国科学家的研究热潮,有关NO的研究报告与专论像雪崩一样极大量地涌现在许多著名学术刊物与权威著作上。在短短的一二十年内就推动一个生命科学新领域的开拓并取得了丰收。有关NO的研究资料涉及活性氧,特别是超氧化物自由基( ),而且必然地联系到超氧化物歧化酶(SOD)。这些新发现与新进展不仅充实了自由基生物学及医学的某些空白领域,而且把这门新学科的发展推向前所未有的新高度。在本文中仅讨论一氧化氮、超氧化物自由基与超氧化物歧化酶的相互关系。
),而且必然地联系到超氧化物歧化酶(SOD)。这些新发现与新进展不仅充实了自由基生物学及医学的某些空白领域,而且把这门新学科的发展推向前所未有的新高度。在本文中仅讨论一氧化氮、超氧化物自由基与超氧化物歧化酶的相互关系。
9.2.3.1 NO与 反应产物ONOO-作用反映了这两种自由基的相互关系
反应产物ONOO-作用反映了这两种自由基的相互关系
NO与 都是化学性质较不活泼的自由基。但NO与
都是化学性质较不活泼的自由基。但NO与 反应生成的ONOO-化学性质却极为活泼。其反应速率常数(k)为7×109(mol/L)-1s-1。
反应生成的ONOO-化学性质却极为活泼。其反应速率常数(k)为7×109(mol/L)-1s-1。
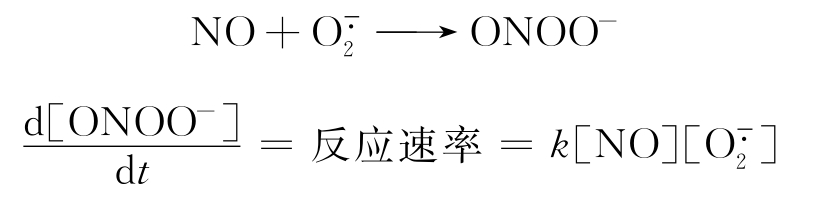
从该反应的速率公式,可以看出ONOO-的产生速率不仅决定于k,而且决定于 与NO的各自浓度。由于NO与
与NO的各自浓度。由于NO与 的反应产物ONOO-的作用反映了这两种自由基相互关系,在ONOO-产生量的多寡上,必然要涉及影响NO与
的反应产物ONOO-的作用反映了这两种自由基相互关系,在ONOO-产生量的多寡上,必然要涉及影响NO与 浓度的因素。
浓度的因素。
A.影响NO浓度的因素
(1)NO的生物合成。在动物体内NO是NO合酶(NOS)的酶促反应产物。NOS有3种类型,即NOSⅠ、NOSⅡ与NOSⅢ,NOSⅠ与NOSⅢ最初分别从神经细胞与内皮组织提纯,因此又称为nNOS与eNOS。这两种亚型NOS原存在于组织细胞内,但为非活化状态。当Ca2+浓度增加到足以使NOS活化,才发生酶促反应,产生NO,因此这两种亚型NOS还可称为内生型NOS(cNOS)。这两种NOS的酶促反应产生的NO最大浓度小于1μmol/L,一般约为10~100nmol/L。NOSⅡ必须在干扰素、生物激发剂如脂多糖(LPS)或内毒素等刺激下,细胞内NOSⅡ基因才可表达,因此NOS又称为诱生型NOS(iNOS)。它最初由巨噬细胞提纯,故曾称为macNOS。其酶促反应产生的NO量大于1μmol/L。
从三种亚型NOS产生的NO量来看,影响NO与 反应生成ONOO-的NO量主要为iNOS生物合成。
反应生成ONOO-的NO量主要为iNOS生物合成。
(2)NO与生物分子的反应。生物合成后的NO一定扩散,其浓度随着扩散距离而减少。它可以通过细胞膜等生物膜,而且在生物膜的非水溶媒中溶解度比水中溶解度高7~8倍。它可与血红蛋白等生物分子反应,因此半衰期很短,但仍可到达生物靶分子,发生生化反应。
(3)NO与O2的反应。NO与O2的反应生成活性衍生物,常称为活性氮(reactive nitrogen species)或活性氮氧化物(reactive nitrogen oxide species)。
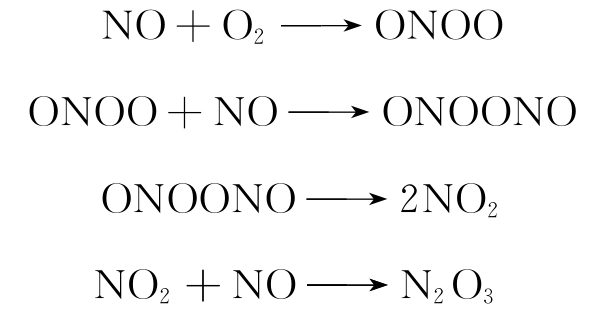
必须说明的是,NO与O2反应后产物虽不是ONOO-,但是ONOO与生物靶分子作用后,可能取得一个电子,而成为ONOO-。
B.影响 浓度的因素
浓度的因素
(1) 的产生。通过非酶反应与酶反应都可产生。
的产生。通过非酶反应与酶反应都可产生。
(2) 的清除。
的清除。 虽可与
虽可与 自动歧化为O2与H2O2,但反应速率常数仅为<100L·mol-1·s-1,而SOD酶使反应速率常数高达9×109L·mol-1·s-1。至于生物体内合成的其他抗氧剂(如谷胱甘肽)与外源性抗氧剂(如抗坏血酸)也可清除
自动歧化为O2与H2O2,但反应速率常数仅为<100L·mol-1·s-1,而SOD酶使反应速率常数高达9×109L·mol-1·s-1。至于生物体内合成的其他抗氧剂(如谷胱甘肽)与外源性抗氧剂(如抗坏血酸)也可清除 ,但对
,但对 的清除起到决定性作用的还是SOD。
的清除起到决定性作用的还是SOD。
NO与 反应速率决定于NO与
反应速率决定于NO与 的浓度。在生理情况下,
的浓度。在生理情况下, 的浓度常小于1nmol/L,而NO浓度常决定于iNOS,其浓度一般为μmol/L水平,即其浓度较
的浓度常小于1nmol/L,而NO浓度常决定于iNOS,其浓度一般为μmol/L水平,即其浓度较 高约1 000倍以上。在反应动力学上属于二级反应,但在反应中可以将[NO]视为常数,即k[NO]可当作假一级反应常数,ONOO-产生速率就可与
高约1 000倍以上。在反应动力学上属于二级反应,但在反应中可以将[NO]视为常数,即k[NO]可当作假一级反应常数,ONOO-产生速率就可与 的浓度成正比。在这方面SOD活性是
的浓度成正比。在这方面SOD活性是 浓度的决定性因素。
浓度的决定性因素。
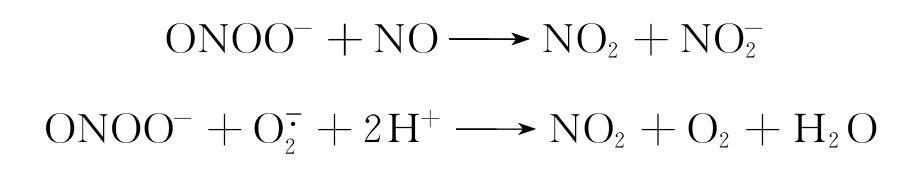
此外,还应该考虑NO与 不平衡时,可能发生以下反应,使ONOO-的产生量降低,但NO产生量增高,因此仍显示NO的生物学效应。
不平衡时,可能发生以下反应,使ONOO-的产生量降低,但NO产生量增高,因此仍显示NO的生物学效应。
9.2.3.2 ONOO-具有活性氧与活性氮的双重生化作用
ONOO-的产生有两条途径,一是 与NO的反应,二是NO与O2反应产物ONOO获得电子。另外,在过量NO存在时ONOO-可转变为NO2,后者与NO反应称为化学活性活泼的N2O3。因此ONOO-实际上可表现活性氧及活性氮的双重作用。
与NO的反应,二是NO与O2反应产物ONOO获得电子。另外,在过量NO存在时ONOO-可转变为NO2,后者与NO反应称为化学活性活泼的N2O3。因此ONOO-实际上可表现活性氧及活性氮的双重作用。
另外,ONOO-可与H+结合成ONOOH,再转变为活性的ONOOH*,发挥NO2与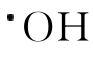 的作用,而且ONOO-还可与体内碳酸盐缓冲剂中CO2反应生成ONOOCOO-,发挥间接生化作用(见图9-5)。
的作用,而且ONOO-还可与体内碳酸盐缓冲剂中CO2反应生成ONOOCOO-,发挥间接生化作用(见图9-5)。
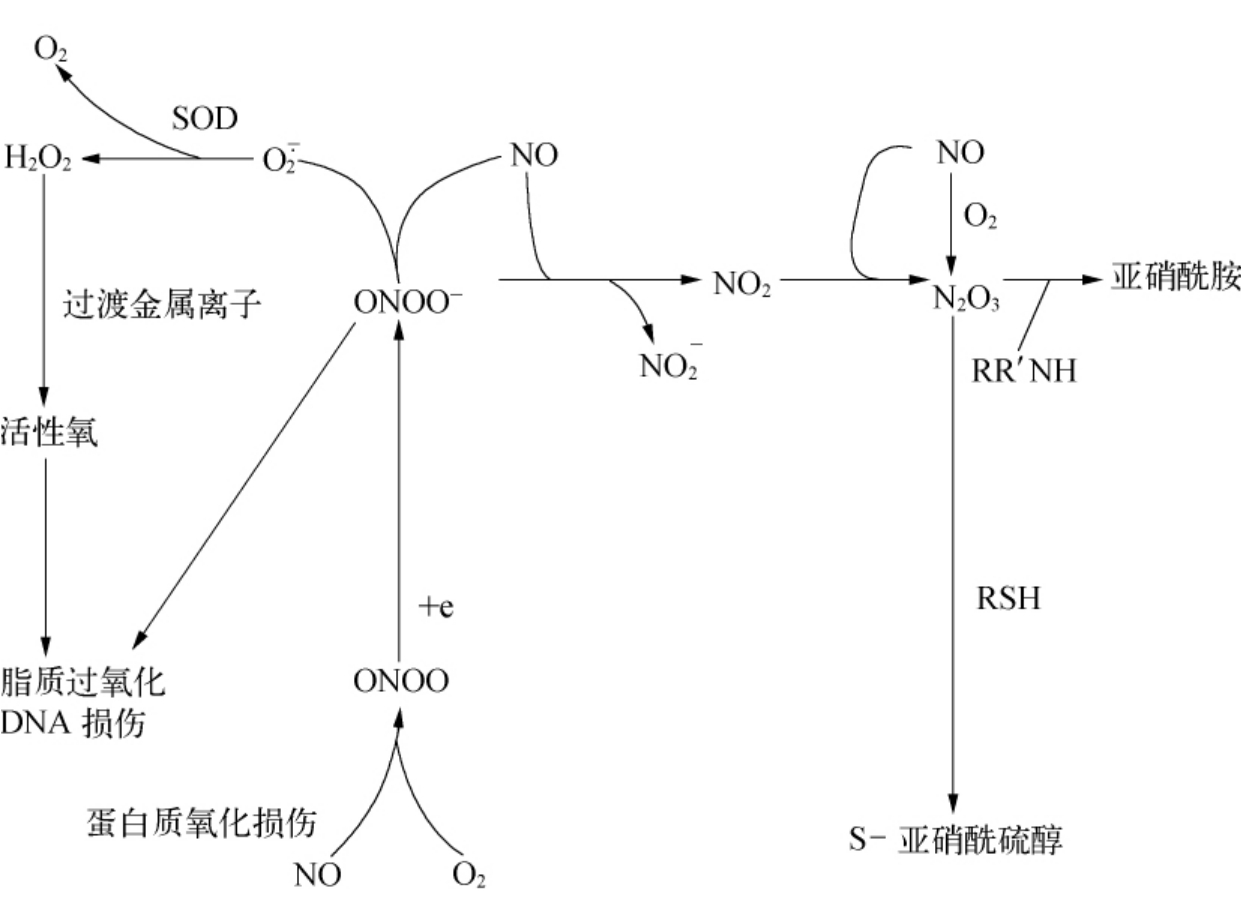
图9-5 ONOO-和N2O3的直接生化作用
9.2.3.3 SOD在NO和 相互作用中起到了减轻效应
相互作用中起到了减轻效应
9.2.3.4 ONOO-对Cu,Zn-SOD、Mn-SOD与Fe-SOD的影响
有顺型与反型的两种分子结构。虽然Cu,Zn-SOD可被H2O2与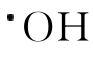 等活性氧攻击而失活,但顺型ONOO-却不能进入Cu,Zn-SOD活性中心区域。反型ONOO-进入酶活性中心区域,可使Cu2+,Zn2+-SOD分子中Cu2+从ONOO-取得一个电子而成为Cu+,Zn2+-SOD,ONOO-成为ON+OO-,从而与该酶分子发生硝基化反应。
等活性氧攻击而失活,但顺型ONOO-却不能进入Cu,Zn-SOD活性中心区域。反型ONOO-进入酶活性中心区域,可使Cu2+,Zn2+-SOD分子中Cu2+从ONOO-取得一个电子而成为Cu+,Zn2+-SOD,ONOO-成为ON+OO-,从而与该酶分子发生硝基化反应。
在此反应中,Cu,Zn-SOD分子中的酪氨酸被硝基化,但不影响酶活性,而Fe-SOD和Mn-SOD的酶活性却降低了,仅分别相当于原酶活性的70%和75%。
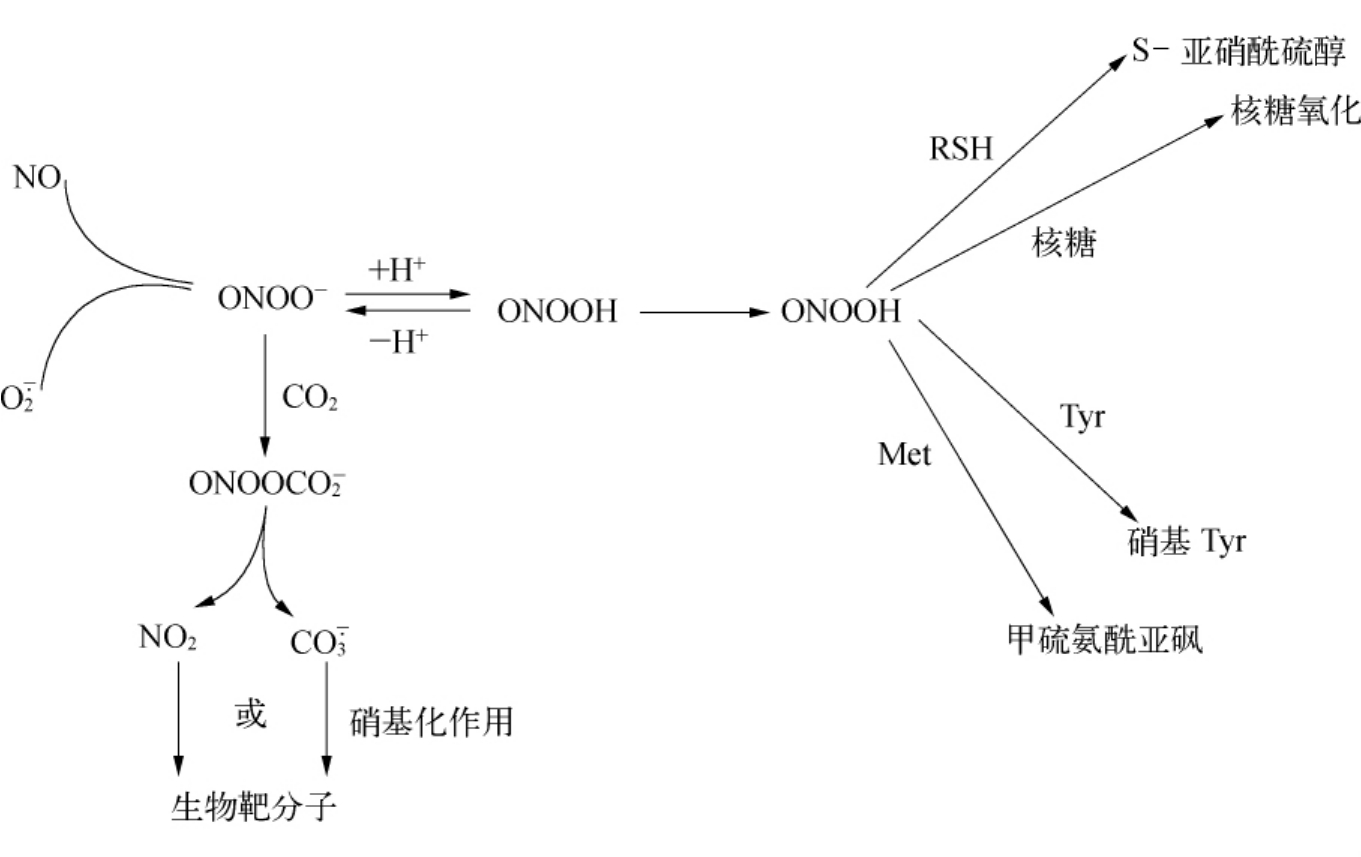
图9-6 ONOO-的间接生化作用
9.2.3.5 一氧化氮合酶在精氨酸不存在时可产生 ,
, 可能与业已生物合成的NO反应成为ONOO-
可能与业已生物合成的NO反应成为ONOO-
一氧化氮合酶分子实际上由还原酶区域与加氧酶区域构成,前者具有结合NADPH、FAD、FMN等区域,可传递NADPH的电子至FAD与FMN,以参加NO的生物合成,但在精氨酸不存在的情况下,电子可以传递到O2成为 。
。
 可能与业已生物合成的NO反应成为ONOO-。如果SOD及生物体内抗氧剂清除了
可能与业已生物合成的NO反应成为ONOO-。如果SOD及生物体内抗氧剂清除了 ,那就不会发生
,那就不会发生 与业已生物合成的NO反应生成ONOO-。
与业已生物合成的NO反应生成ONOO-。
9.2.3.6 对一氧化氮、超氧化物自由基、超氧化物歧化酶相互关系研究的意义
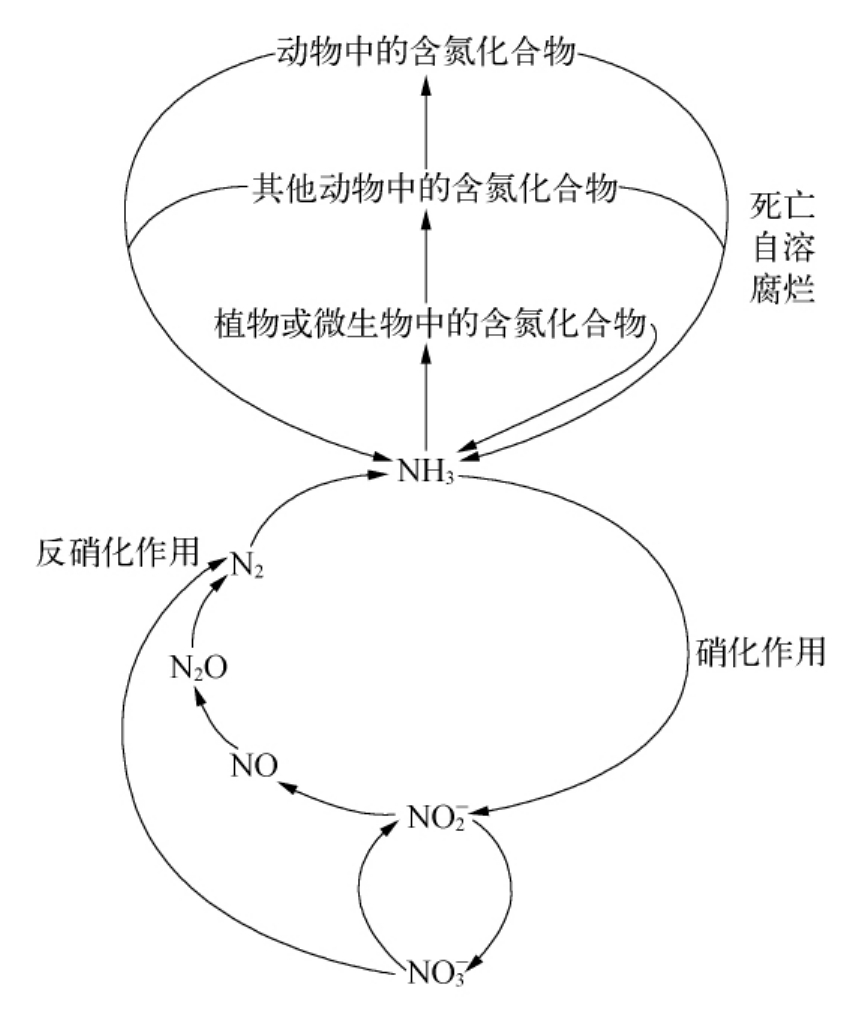
图9-7 生物氮循环
值得考虑的是低等生物体既可产生NO,同时也会产生 。SOD的作用是清除
。SOD的作用是清除 ,当可防止
,当可防止 与NO生成ONOO-。在理论上虽可推测,在生物进化的过程中NO,
与NO生成ONOO-。在理论上虽可推测,在生物进化的过程中NO, 与SOD之间存在着相互关系,然而如何探究并取得实验证据呢?
与SOD之间存在着相互关系,然而如何探究并取得实验证据呢?
(2)防治肠炎或肠癌中细菌及粪便内NO与 产生ONOO-及其活性衍生物。在正常人的肠内就存在大肠杆菌,可以产生NO及其活性衍生物。粪便中Fe2+或Fe3+还可诱生活性氮或活性氧,但在生理情况下不会发生活性氮或活性氧的危害。值得研究的问题是:肠炎或肠癌的发生是否与活性氧或活性氮的危害作用有关?是否涉及ONOO-?按理,口服SOD可以清除人体胃肠内的
产生ONOO-及其活性衍生物。在正常人的肠内就存在大肠杆菌,可以产生NO及其活性衍生物。粪便中Fe2+或Fe3+还可诱生活性氮或活性氧,但在生理情况下不会发生活性氮或活性氧的危害。值得研究的问题是:肠炎或肠癌的发生是否与活性氧或活性氮的危害作用有关?是否涉及ONOO-?按理,口服SOD可以清除人体胃肠内的 ,并防止
,并防止 与NO生成ONOO-及其他活性衍生物;那么,SOD是否对肠炎或肠癌的防治有效?
与NO生成ONOO-及其他活性衍生物;那么,SOD是否对肠炎或肠癌的防治有效?
(3)疾病中一氧化氮、超氧化物自由基与抗氧化系统(包括SOD)的相互作用。凡是引起iNOS基因表达的疾病均可诱发NO量的增加,而且 的生成也会增加,NO与
的生成也会增加,NO与 可能生成ONOO-,例如炎症。从相关文献中已查明,乙型肝炎中iNOS基因表达增高,同时
可能生成ONOO-,例如炎症。从相关文献中已查明,乙型肝炎中iNOS基因表达增高,同时 也增加,但有关ONOO-的研究还相对较少。已知人免疫球蛋白可以预防乙型肝炎,但在预防实验中有关NO、
也增加,但有关ONOO-的研究还相对较少。已知人免疫球蛋白可以预防乙型肝炎,但在预防实验中有关NO、 及抗氧化系统相互作用的研究几乎还是空白。关节炎既可引发
及抗氧化系统相互作用的研究几乎还是空白。关节炎既可引发 的增加,又可诱生NO。按理在临床上应用SOD的效果不仅是清除
的增加,又可诱生NO。按理在临床上应用SOD的效果不仅是清除 ,而且还可防止
,而且还可防止 与NO产生ONOO-及其活性衍生物,但如何在这方面取得有说服力的实验证据,却尚未见报道。
与NO产生ONOO-及其活性衍生物,但如何在这方面取得有说服力的实验证据,却尚未见报道。
当然,对于抗御活性氧与活性氮的危害,应在防止疾病的同时,注意增强机体抗氧化的能力,但有关的实验资料却很少。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















