实验十三 亲和层析
——镍柱纯化分离天然状态的带有His标签的蛋白质
【实验目的】
1.掌握亲和层析法分离纯化蛋白质的实验原理
2.掌握Ni柱法纯化携带His标签的蛋白质的实验方法
【实验原理】
许多生物大分子化合物具有与其结构相对应的专一分子可逆性结合的特性,如蛋白酶与辅酶、凝集素和糖类、抗原和抗体、激素与其受体等。生物分子间的这种专一结合能力称为亲和力。依据生物高分子物质能与相应特异配基分子可逆结合的原理,采用一定技术,把与目的产物具有特异性亲和力的生物配基固定在特定载体上,作为固定相,将含有目的产物的混合物(流动相)在适合与配基形成络合物的条件下流过固定相,即可将目的产物从混合物中分离出来,使其留在含配基的固定相上,随后通过改变配基与目的产物结合的条件使目的产物从固定相中解离并洗脱下来,从而得到较纯的目的产物。此分离技术称为亲和层析。亲和层析具有专一性高、操作条件温和、操作过程简单、纯化效率高、可有效保持生物活性物质的高级结构的稳定性等诸多优点,也能有效分离含量极少又不稳定的生物活性药物。
金属螯合亲和层析(metal-chelating affinity chromatography)是近30年来出现的一种亲和层析技术,也称固相化金属离子亲和层析。其原理是利用蛋白质表面暴露的一些氨基酸残基和载体上的金属离子相互作用而进行的亲和纯化。它以配基简单、吸附量大、分离条件温和、通用性强等特点,逐渐成为分离纯化蛋白质等生物工程产品最有效的技术之一,不仅适于某些蛋白质、酶和氨基酸与肽的分离纯化,也适用于能可逆螯合金属离子的核苷酸、激素、抗体等物质的分离和纯化。
本实验利用镍离子螯合的亲和配体从重组大肠杆菌菌液中纯化带有6个组氨酸标签的重组蛋白。组氨酸是具有杂环的氨基酸,每个组氨酸含一个咪唑基团,对多种带正电的物质如金属离子Cu2+、Ni2+、Fe3+、Co2+、Zn2+有较强亲和力。亲和配体Ni-NTA葡聚糖含阳离子(Ni2+),对组氨酸有高度亲和作用。含6×His标签目的蛋白载体的重组菌在IPTG诱导下可大量表达目的蛋白,通过裂解工程菌可获得含有目的蛋白质的混合蛋白质溶液。通常诱导表达的目的蛋白质以可溶性和包涵体形式的不可溶两种状态存在,如果是可溶性蛋白,可以直接用保持天然活性的亲和纯化方法进行分离;如果是包涵体形式存在的不可溶性蛋白,则需要在离心分离包涵体后在溶液中加入尿素、盐酸胍等变性物质促使包涵体蛋白质溶解,并且在含有一定浓度的变性剂的条件下进行亲和纯化分离目的蛋白质,随后通过透析等方法去除变性剂,并使目的蛋白质复性。本次试验是保持天然活性的可溶性蛋白质的亲和纯化过程。
【实验器材】
层析柱1.6×20 cm、50 ml小烧杯、注射器、三通管、止水夹、吸耳球、紫外分光光度计、石英紫外比色杯等。
【药品试剂】
1.Ni-NTA葡聚糖。
2.IPTG诱导表达pET-His-GFP的重组工程菌。
3.细菌裂解液:50 mmol/L NaH2PO4,300 mmol/L NaCl,10 mmol/L imidazole(咪唑),用NaOH调整pH值至8(6.9 g NaH2PO4·H2O,17.54 g NaCl,0.68 g imidazole,溶于水以后用NaOH调整pH值至8,定容到1 L)。
4.平衡液:50 mmol/L NaH2PO4,300 mmol/L NaCl,20 mmol/L imidazole,用NaOH调整pH值至8(6.9 g NaH2PO4·H2O,17.54 g NaCl,1.36 g imidazole,溶于水以后用NaOH调整pH值至8,定容到1 L)。
5.缓冲液1(pH8):50 mmol/L NaH2PO4,300 mmol/L NaCl,用NaOH调整pH值至8(即6.9 g NaH2PO4·H2O,17.54 g NaCl,用NaOH调整pH值至8,定容到1 L)。
6.缓冲液2:50 mmol/L NaH2PO4,300 mmol/L NaCl,0.5 mol/L imidazole,用NaOH调整pH值至8(即6.9 g NaH2PO4·H2O,17.54 g NaCl,34 g imidazole,溶于水以后用NaOH调整pH值至8,定容至1 L)。
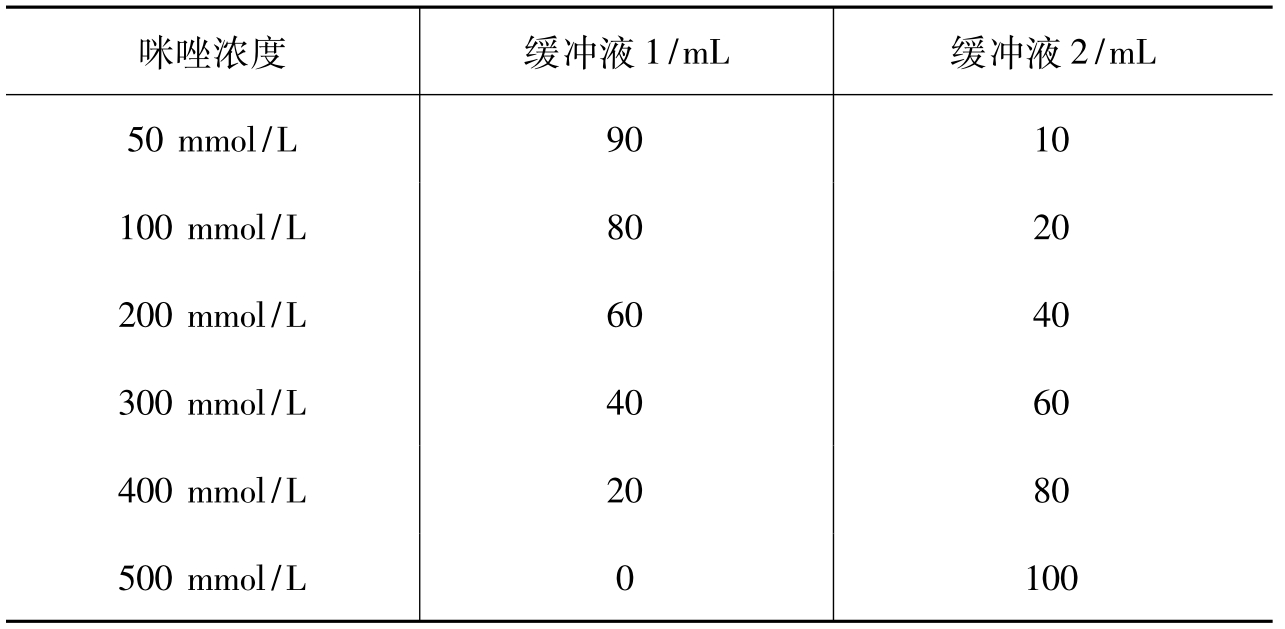
7.梯度咪唑缓冲液:按表3-12加入缓冲液1和缓冲液2配成不同浓度的咪唑缓冲液。
表3-12 梯度咪唑缓冲液的配置
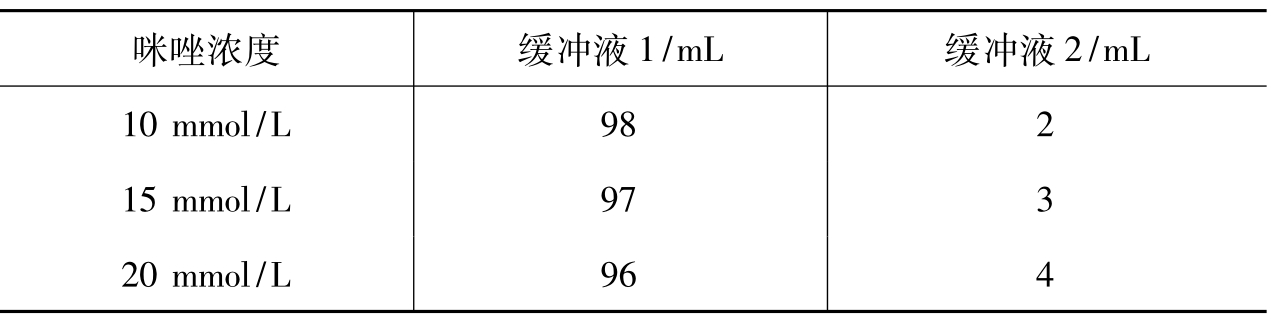
续表
【实验方法】
1.在平板上挑取一个含有重组质粒的菌落,接入5 ml含50kg/ml卡那霉素的LB液体培养基,37℃培养过夜。
2.次日以1∶50接种入250 ml含50kg/ml卡那霉素的LB液体培养基中,30℃培养2~3小时直至OD600为0.4~0.7。
3.加入IPTG至终浓度为0.1~0.2 mmol/L,诱导蛋白表达3~4小时。
4.收集菌液,4℃,13200 r/min离心15分钟,去上清液,加0.01 mol/L PBS清洗沉淀,并再次离心,将沉淀保存于-80℃。
5.冰上溶解细菌沉淀,以每克2~5 ml的量加入裂解液,充分重悬。
6.加入溶菌酶至终浓度1 mg/ml,混匀,冰上放置30分钟。
7.冰上超声菌体,200~300 W,每次10秒,共6次,每次间隔10秒。
8.加入RNase A(10μg/ml)和DNase(5μg/ml),冰上放置10~15分钟。
9.4℃,10000 r/min离心20~30分钟,收集上清液,0.45 mm滤膜过滤。
10.取2 ml Ni-NTA凝胶装柱。
11.在柱上缓慢加入10倍柱体积的平衡液,以充分平衡Ni-NTA凝胶,流速为1 ml/min。
12.取过滤后的细菌裂解液,匀速加入凝胶,直至样品完全进入凝胶后,用10倍柱体积的平衡液继续洗涤凝胶,保存流速为1 ml/min。
13.用分别含50 mmol/L、100 mmol/L、200 mmol/L咪唑的洗脱液各5 ml进行阶段洗脱,流速为2 ml/min,在下端用试管接住流出液体,每管1 ml,试管标记顺序。
14.用紫外分光光度计测定每管的蛋白质含量A280,并以洗脱体积为横坐标,A280为纵坐标做洗脱曲线,并用虚线标记咪唑浓度。
15.取20μl洗脱液加6×上样缓冲液,煮沸5分钟,用10%凝胶做SDS-PAGE电泳。
16.用20 ml蒸馏水充分洗涤Ni-NTA柱,再用10 ml20%乙醇流洗柱体,流速为1 ml/min。凝胶保存于4℃。如长期不用,可用2倍体积含50 mmol/L EDTA的缓冲液洗涤以除去Ni2+,将NTA凝胶在4℃保存于20%乙醇溶液中。
【注意事项】
1.溶解IPTG诱导的重组细菌后,务必用SDS-PAGE方法确认重组蛋白质是否表达、表达量以及表达于上清液还是沉淀,以确认纯化方法是用天然活性的纯化法还是变性方法。
2.上样前务必要对样品溶液进行过滤,以保证样品溶液中没有沉淀和杂质阻塞柱体。
【思考题】
1.简述亲和层析的原理。
2.用Ni-NTA层析纯化His-标签蛋白有哪些注意事项?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















