第三节 其他免疫细胞膜分子
一、促有丝分裂原受体
有丝分裂原来自植物的糖蛋白或细菌产物,能与多种细胞膜糖类分子结合(受体)促进细胞活化、诱导分裂(图8-12)。
图8-12 促有丝分裂原受体
二、IgFc受体
体内多种细胞表面可表达IgFc受体,并通过二者结合,参与Ig的功能。属于CD分子的Fc受体包括FcγR、FcαR和FcεR。其中FcγR分为FcγRⅠ、FcγRⅡ和FcγRⅢ三类;FcεR分为FcεRⅠ和FcεRⅡ两类,受体是糖蛋白,胞外都有Ig样功能区,能与IgFc结合(图8-13)。其功能为介导Ag识别,吞噬功能,Ag递呈,免疫细胞活化等。
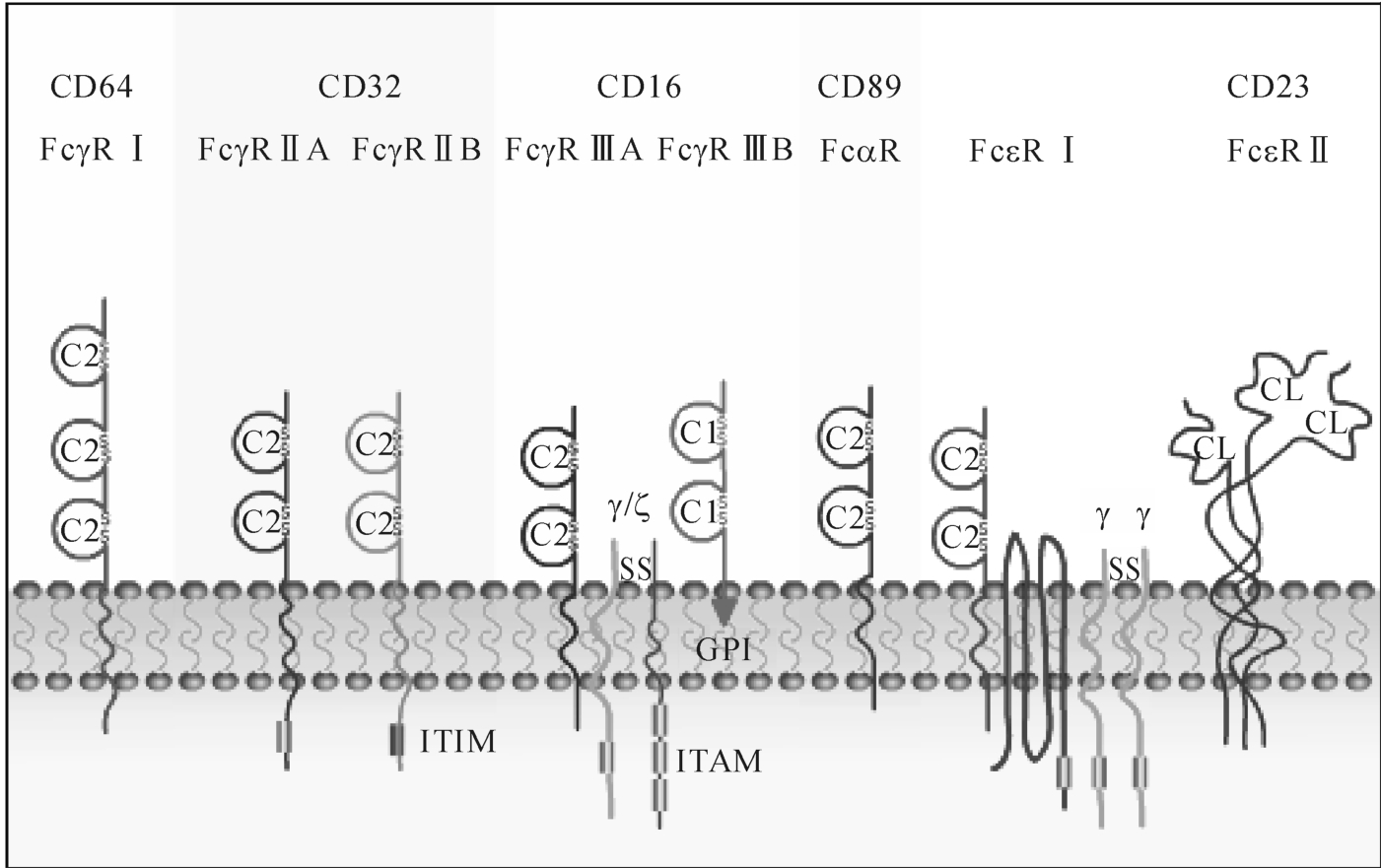
图8-13 各类Ig的Fc受体
三、CK受体
根据细胞因子受体cDNA序列以及受体胞膜外区氨基酸序列的同源性和结构征,可将细胞因子受体主要分为四种类型:免疫球蛋白超家族(IgSF)、造血细胞因子受体超家族、神经生长因子受体超家族和趋化因子受体。此外,还有些细胞因子受体的结构尚未完全搞清,如IL-10R、IL-12R等;有的细胞因子受体结构虽已搞清,但尚未归类,如IL-2Rα链(CD25)。免疫细胞表面表达多种CK受体,参与调节T、B细胞、单核吞噬细胞的生物学功能。
细胞因子受体主要包括免疫球蛋白受体超家族(IgR—SF)、I型细胞因子受体家族、Ⅱ型细胞因子受体家族(干扰素受体家族)、Ⅲ型细胞因子受体家族(肿瘤坏死因子受体家族,TNFR—F)和七次跨膜受体家族(又称G—蛋白耦联受体家族),如图8-14所示。
四、补体受体
中性粒细胞和单核-巨噬细胞高度表达补体受体,与吞噬功能有关(图8-15)。其配体为iC3b,但针对其他补体受体的单克隆抗体不能阻断CR4与iC3b的结合,证明CR4的存在。CR4与gp150/95为同一分子,对其功能尚有诸多不明之处。据认为CR4在排除组织内与iC3b结合的颗粒上起作用。它和CR3一样,与配体结合时需有二价离子的存在。
五、内分泌激素、神经递质、神经肽受体
免疫细胞表面可具有多种激素、神经递质和神经肽的受体,如雌激素、甲状腺素、肾上腺皮质激素、肾上腺素、前列腺素E、生长激素、胰岛素等激素的受体,内啡肽、脑啡肽、P物质等神经肽受体,组胺、乙酰胆碱、5-羟色胺、多巴胺等神经递质受体。免疫细胞表面的激素、神经肽和神经递质受体是机体神经内分泌免疫网络中的一个重要环节。

图8-14 细胞因子受体超家族结构图
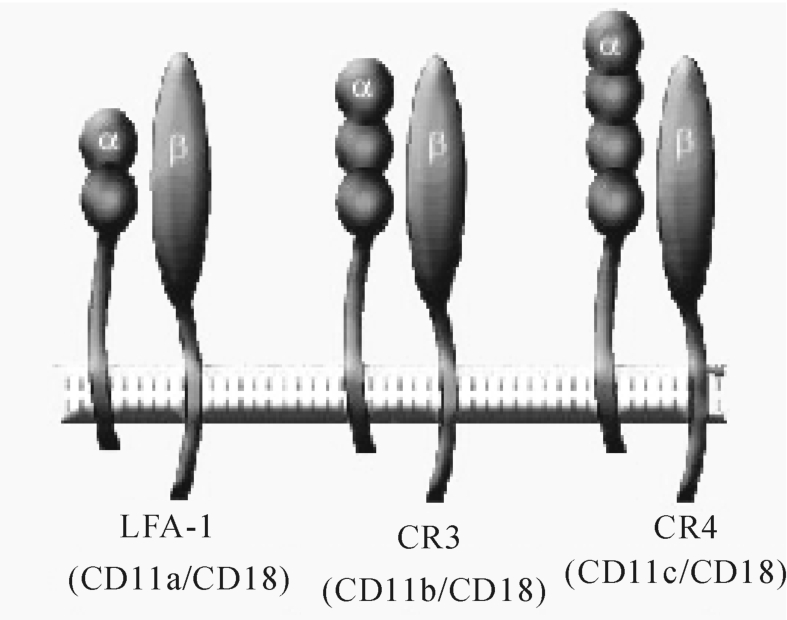
图8-15 补体受体
【理解与思考】
1.你能形象地解说机体免疫细胞膜分子的构成及其作用吗?
2.你就是一个免疫细胞,请从如何接受外界信号刺激,传递到内部产生作用作一表述。
3.当某一局部受到病原微生物的侵袭,请形象地描述淋巴细胞是如何到达病原微生物入侵部位的。
【课外拓展】
1.参与细胞凋亡的CD分子有哪些?
2.黏附分子与疾病有何关系?
3.黏附分子结合时,其结构有何变化?
4.参与T、B淋巴细胞抗原识别与活化的CD分子是如何互相影响的?
【课程实验与研究】
1.如何检测新出现的免疫细胞膜分子与其活性?
2.能够识别病原相关分子的模式识别受体是如何去鉴别的?
3.免疫负相调控机制与CD分子有何关联?
【课程研讨】
1.阐述某一种白细胞分化抗原的研究进展。
2.免疫细胞膜缺失会导致什么样的结果?
3.黏附分子与肿瘤的发生有何关联?
4.目前,黏附分子的研究热点是什么?你认为将来的研究方向是什么?要解决什么难题?
5.免疫识别的结构基础与相关机制研究能解决什么问题?
【课后思考】
1.CD分子、黏附分子的概念。
2.简述与T细胞识别、黏附及活化有关的主要CD分子与其作用。
3.简述与B细胞识别、黏附及活化有关的主要CD分子与其作用。
【课外阅读】
CD45在淋巴细胞活化中的研究
CD45又称为白细胞共同抗原(LCA),是一种单链跨膜糖蛋白,是蛋白酪氨酸磷酸酶(PTPase)家族成员,它广泛地存在于造血系细胞,如T细胞、B细胞、自然杀伤细胞和巨噬细胞表面。CD45通过对蛋白酪氨酸激酶(PTKs)的调节,在淋巴细胞的发育和活化中起重要作用。
CD45至少有9个变构体(如CD45RA、CD45RB、CD45RC、CD45RO等),由4~6个外显子(常见的有A、B、C等)交替剪接而成。这些变构体的胞外结构不同,但有共同的胞浆结构。单个淋巴细胞可同时表达多个变构体。CD45变构体在T细胞和B细胞上的表达有所不同,在T细胞各功能亚群上以及在T细胞发育和活化的各阶段也存在不同。
一、CD45对Src家族蛋白酪氨酸激酶的调节作用
PTKs是淋巴细胞活化信号传递过程中的重要介质,主要包括3个家族:Src家族、Syr家族和Jak家族。CD45通过对Src家族PTKs的调节而在淋巴细胞活化中起重要作用。其分子结构上有两个关键的调节性酪氨酸磷酸化位点,一个位于激酶结构域,另一个位于C末端尾,前者的磷酸化可增强激酶的活性,称为活化位点;后者的磷酸化则抑制激酶活性,称为抑制位点。
CD45可以同时使活化位点和抑制位点去磷酸化从而控制Src激酶的活性,因此CD45同时具备阴性调节和阳性调节作用。在静止细胞,CD45可以和磷酸根竞争抑制位点同时使活化性位点去磷酸化,其综合效应是使Src激酶处于非活化状态。当受体和抗原结合后,膜蛋白的位置发生改变,Src激酶向抗原受体方向位移,从而使Src激酶和CD45分离,活化位点磷酸化而使Src激酶活化,此时CD45是阳性调节。在整合素介导的细胞黏附过程中,Src激酶和CD45同时向黏附位点位移,此时CD45仍使活化位点去磷酸化,从而发挥阴性调节作用。
二、CD45对抗原-受体信号的调节作用
TCR复合体包括一个异二聚体(TCRαβ或TCRγδ)、CD3复合体和一个ζ链同二聚体。同样,BCR复合体也包含多个亚单位。无论是TCR或BCR,其信号传导均以PTKs的活化而开始。
研究显示,缺乏CD45的细胞接受抗原刺激后,不能产生有效的活化信号。通过分析发现,这种抗原-受体信号的传导异常是由于缺乏Src激酶的调节而引起的,缺乏CD45的T细胞,Src激酶抑制性位点的磷酸化程度增高,故不能形成有效的信号传导,说明CD45在淋巴细胞的抗原-受体信号传导中起着关键作用。
三、CD45在调节细胞黏附中的作用
抗原被抗原特异性受体识别以及T细胞和抗原递呈细胞之间的黏附是T细胞活化的两个同等重要的过程。由于TCR与抗原的亲合力较低,需要其他的蛋白质(如整合素)来稳定细胞间的接触才能有效地使T细胞活化。当整合素和配体结合后,Src家族激酶和CD45分子均向黏附位点移位,Src家族激酶由于其高度亲和力的结合位点与黏附分子上的黏附位点结合而活化,此时尽管CD45仍使抑制位点去磷酸化,但其作用是次要的,不足以抑制激酶的活化,可见CD45对细胞间的黏附起阴性调节作用。
四、CD45胞外结构在信号传导中的作用
Robert等研究发现,在缺乏CD45跨膜和胞外结构的情况下,CD45的胞内结构仍可以参与TCR的信号传导,提示CD45胞内结构的酶活性对TCR的信号传导是必要和充分的。那么,CD45的胞外结构在信号传导中起什么作用呢?研究表明,某些CD45变构体的表达与淋巴细胞的成熟及活化存在密切联系,从而提示不同的CD45变构体可能与T细胞的功能有关。向CD45阴性细胞内转染不同的CD45变构体cDNA,发现对TCR的信号传导的影响也不同。说明不同的变构体对T细胞活化的调节不同。Dianzani等认为,这可能是由于不同的变构体与细胞表面上不同分子选择性结合的结果。也就是说,CD45的胞外部分可能提供信号传导的特异性,胞内部分参与信号的传导。
五、CD45分子在淋巴细胞发育中的作用
CD45分子可能对T细胞在胸腺内的选择和发育起着非常重要的作用。Deans等研究发现,CD45RA阳性的胸腺细胞可以分化为T细胞,而CD45RO阳性的胸腺细胞则在胸腺内被清除。早期的研究显示,CD4+CD45RA+T细胞是抑制-诱导亚群,而CD4+CD45RA-T细胞是辅助-诱导亚群。然而事实远比这复杂得多,因为有研究显示,活化T细胞仍保留CD45RA+,而且CD45RA-和CD45RA+T细胞之间也可以相互转换。
敲除小鼠CD45基因后,发现其胸腺细胞的发育被严重阻断,从而使CD4-CD8-胸腺细胞增多,CD4+CD8+胸腺细胞减少,结果外周T细胞急剧减少,T细胞TCR对抗原刺激无反应,也不能产生细胞毒性反应。此时B细胞的数量虽然正常,但外周未成熟细胞明显增多。可见,CD45对T细胞和B细胞的发育和功能都非常重要。
六、CD45调节淋巴细胞的活性
研究显示,缺乏CD45的CD4+、CD8+T细胞,其抗原特异性增殖能力、分泌IFN-γ能力以及溶解靶细胞能力均降低。如果使CD4+、CD8+T细胞重新表达CD45,则可恢复这些能力。但Irie-Sasaki等的研究发现,CD45对细胞因子受体介导的信号传导起阴性调节作用,并且发现破坏CD45基因则可以增强细胞因子和IFN-γ受体介导的细胞活化。
淋巴细胞活化是一个复杂过程,包括PTKs的活化、某些细胞蛋白酪氨酸的磷酸化、细胞内Ca2+浓度的增加、磷酸肌醇的水解、蛋白激酶C和Ras的活化等。缺乏CD45分子的淋巴细胞在TCR受体抗原刺激后,酪氨酸激酶活性降低,磷酸肌醇及细胞内Ca2+代谢也降低,因而不能有效地传导活化信号。如通过转基因技术使T细胞重新表达CD45分子,则可恢复TCR的信号传导能力,说明CD45分子在TCR的信号传导中是非常重要的。
七、CD45结合蛋白的作用
CD45结合蛋白(CD45AP)又称为淋巴细胞磷酸酶结合蛋白(LPAP),是一个包含有198个氨基酸的蛋白质。CD45AP主要表达在T细胞和B细胞表面,CD45AP的表达与CD45的表达密切相关。在CD45阴性细胞,细胞表面检测不到CD45AP的表达,而CD45APmRNA仍有表达。研究发现,此时CD45AP仍有合成,但合成后很快降解。用CD45cDNA转染CD45阴性细胞,结果可以恢复CD45A P的表达,提示CD45AP和CD45结合可防止其降解。CD45AP的功能尚不清楚,鉴于CD45AP的表达受CD45的严格调节,所以认为CD45AP在CD45介导的淋巴细胞信号传导中发挥重要作用。但也有学者发现,缺乏CD45AP的小鼠,其胸腺细胞及脾细胞的分化发育是正常的,而且这些细胞的P56Lck的活性与正常细胞没有区别,因而认为CD45AP在CD45对Src激酶活性的调节过程中并不是必需的。
CD45是一个重要的跨膜分子,它以其蛋白酪氨酸磷酸酶活性使蛋白酪氨酸激酶的抑制位点的酪氨酸去磷酸化从而使其活化,进而在T细胞活化的信号传递中起重要作用。近年来,随着对CD45认识的不断深入,人们试图利用单克隆抗体或药物阻断CD45介导的信号传导来阻断淋巴细胞的活化,进而应用于诱导免疫耐受和逆转移植排斥反应的研究,并取得了较好的效果。但CD45及其结合蛋白在淋巴细胞的发育、增殖和活化过程中的确切作用机制仍不甚清楚,CD45及其阻断措施在调节淋巴细胞活化中的作用,特别是在诱导免疫耐受及逆转排斥反应中的应用还需要进一步研究。
改造T细胞受体限制H IV扩散
通过基因改革工程,研究人员让“杀手”T细胞更好地限制了H IV在培养液中的扩散。他们在日前在线出版的《自然—医学》期刊中说,这种能力升高的T细胞还能识别已经发生变异并试图逃过免疫反应的病毒。
T细胞受体(TCR)能够识别病毒蛋白质碎片,并在受感染细胞表面发出警告信息,T细胞因此得知了H IV的出现。目前,分离这种能够识别H IV的特别T细胞的方法主要基于克隆取自H IV患者的细胞,这是一个缓慢而费力的过程,而且,这些细胞中的TCR鉴别受感染细胞的能力很弱。病毒能够通过变异而逃脱探测。
James Riley和同事利用噬菌体表面展示技术,从取自H IV患者的T细胞分离出TCR,这种TCR能很好地鉴别出H IV的存在。然后,他们通过基因工程改造这种TCR,让它能更好地探寻病毒。将这种TCR置入T细胞中,结果产生出力量更大的“杀手”细胞,能够在培养液中更好地限制H IV的扩散。
(资料来源:Nature Medicine,doi:10.1038/nm.1779,Bent K Jakobsen,James L Riley)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















