实验二十 ITS序列分析法鉴定曲霉菌种
一、实验目的
学习ITS序列分析法鉴定真菌的原理和方法。
二、实验原理
传统的真菌分类鉴定主要是按照真菌的形态、生长以及生理生化等特征进行分类。然而真菌的种类繁多,个体多态性明显,而且其生长、生理生化特征也会随着环境的变化而不稳定。因此,采用传统的方法对真菌进行正确分类存在较大的困难。随着分子生物学技术的发展,核酸序列分析已被广泛地应用于真菌分类鉴定,目前常用的技术包括18SrDNA、ITS(Internal Transcribed Spacer,ITS)及18S rDNA-ITS序列分析技术。
真核生物核糖体RNA(rRNA)有5、5.8、17~18(以下统称为18S)和25~28S(以下统称为28S)。对于大多数真核生物来说,核糖体rRNA基因群的一个重复单位(rDNA)包括以下区段(按5′→3′方向):①非转录区(Non Transcribed Sequence)简称NTS;②外转录间隔区(External Transcribed Spacer),简称ETS;③18SrRNA基因,简称18SrDNA;④内转录间隔区1(Internal Transcribed Spacer 1),简称ITS1;⑤5.8SrRNA基因,简称5.8SrDNA;⑥内转录间隔区2 (Internal Transcribed Spacer 2),简称ITS2;⑦28SrRNA基因,简称28SrDNA。ITS1和ITS2常被合称为ITS,并且5.8SRNA基因也被包括在ITS之内。

图20-1 真菌rDNA转录区和相关引物
rDNA上的5.8、18和28SrRNA基因有极大的保守性,即存在着广泛的异种同源性。而由于ITS区不加入成熟核糖体,所以ITS片段在进化过程中承受的自然选择压力非常小,因此能容忍更多的变异。在绝大多数的真核生物中表现出极为广泛的序列多态性,即使是亲缘关系非常接近的2个种都能在ITS序列上表现出差异,显示最近的进化特征。研究表明,ITS片段的进化速率是18SrDNA的10倍。这就是ITS序列在微生物种类鉴定和群落分析的理论基础。ITS1和ITS2是中度保守区域,其保守性基本表现为种内相对一致,种间差异比较明显。这种特点使ITS适合于真菌物种的分子鉴定以及属内物种间或种内差异较明显的菌群间的系统发育关系分析。由于ITS的序列分析能实质性地反映属间、种间以及菌株间的碱基对差异,此外ITS序列片段较小、易于分析,目前已被广泛应用于真菌属内不同种间或近似属间的系统发育研究。
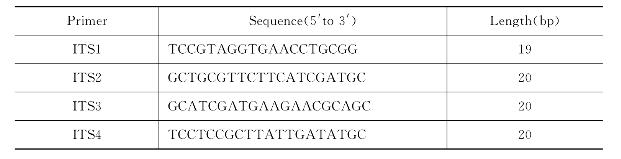
ITS序列分析通常通过多聚酶链式反应(PCR)技术实现,根据rDNA基因上高度保守区段设计通用引物(引物ITS1和ITS2用于扩增18SrDNA和5.8S rDNA之间的转录间隔区ITS1,引物ITS3和ITS4用于扩增5.8SrDNA和28S rDNA之间的转录间隔区ITS2),借助PCR技术扩增rDNA的目的片段。通常ITS的扩增产物是多种片段的混合物,可以通过克隆实现分离,然后对每一个克隆测序,也可以通过电泳分离获得所需长度的条带胶回收后直接测序。然后借助于详细的序列对比,分析被试菌种与基因序列库中已知菌种的同源性。
三、实验器材
(一)菌种
黑曲霉(Aspergillus niger)、米曲霉(Aspergillus oryzae)、酱油曲霉(Aspergillus sojae)等曲霉菌种。
(二)实验仪器
PCR扩增仪、微量移液器、水浴锅、低温离心机、电泳仪、电泳槽、凝胶成像系统、超低温冰箱、超纯水生成器、紫外分光光度计等。
(三)实验试剂
1.酶和试剂盒
真菌DNA基因组提取试剂盒、PCR扩增试剂盒、小量琼脂糖胶回收试剂盒、DNA marker(DL2000DNA marker)、Taq polymerase、RNase、PCR引物(引物设计后由公司合成,序列如表20-1)。
表20-1 真菌rDNA-ITS通用扩增引物
2.主要溶液及培养基
液氮,TE缓冲液(pH 7.5),石蜡油,10%SDS,苯酚,氯仿,异戊醇,异丙醇,NaOH溶液,PBS缓冲液,Tris-硼酸-EDTA缓冲液,琼脂糖,0.05%溴酚蓝-50%甘油溶液(5×Loading Buffer),0.5μg/mL溴化乙啶染色液等。
部分溶液的配制方法如下。
土豆培养基(PDA):称取土豆(去皮)200g,切碎放入水中煮30min,纱布过滤,在所得的土豆汁中加入葡萄糖(或蔗糖)20g,再加水至1 000mL,pH自然。
TE缓冲液:10mmol/L Tris-HCl(pH 7.5),1mmol/L EDTA(pH 8.0),121℃高压灭菌20min,备用。其中1mmol/L EDTA(pH 8.0):称取121.1g EDTA-Na2溶于800mL去离子水中,剧烈搅拌,用NaOH粉末调节pH值至8.0,加水定容至1L,分装至121℃高压灭菌20min,4℃冰箱贮存。
10×TBE缓冲液(pH 8.3):Tris 107.89g,EDTA 7.44g,溶于800mL水中,缓慢加入硼酸,pH为8.3,定容至1 000mL。
Tris-硼酸-EDTA缓冲液(TBE缓冲液),pH 8.3:称取10.78g Tris,5.50g硼酸,0.93g EDTA-Na2溶于去离子水,定容至1000mL。
DNA提取液(EDTA浓度125mmol/L):1mol/L Tris-HCl 10mL与0.5mol/L 的EDTA 25mL混合,定容至100mL。
磷酸盐缓冲溶液(PBS):在800mL蒸馏水中溶解8g NaCl,0.2g KCl,1.44g Na2HPO4和0.24g KH2PO4,用HCl调节溶液pH值至7.4,加水定容至1 000mL,高压灭菌。
氯仿-异戊醇(24∶1):将24倍体积的氯仿与1倍体积的异戊醇混合。
10%SDS(W/V):10g SDS溶于75mL水中,60℃助溶,调pH值至7.0~7.2,定容至100mL。
0.05%溴酚蓝-50%甘油溶液(5×Loading Buffer):取一定量的0.1%溴酚蓝水溶液,与等体积甘油混合而成。
0.5μg/mL溴化乙啶染色液:称取5mg溴化乙啶,用去离子水溶解,定容至100mL。从中取1mL,用无离子水稀释至100mL。(注意:有毒,戴手套,通风柜内进行。)
四、实验步骤

图20-2 ITS序列分析实验流程
(一)曲霉菌丝体的培养和收集
将菌种接种到PDA培养基上,培养3d后从菌落的边缘取菌丝块,转接到100mL PS液体培养基(马铃薯200g,蔗糖20g,蒸馏水1 000mL)中,于28℃,150r/min摇床振荡培养6d,离心或4层纱布过滤后收集菌丝体,用灭菌的生理盐水洗2次,再用灭菌的吸水纸吸干水分,-20℃冰箱保存备用。
(二)基因组DNA的提取
取备用菌丝体加适量dH2O充分研磨破碎,用真菌核酸提取试剂盒进行DNA提取。如不使用试剂盒也可用其他DNA提取方法进行提取。
取0.2~0.5g菌丝体用于基因组DNA提取。提取步骤如下:
(1)液氮中充分研磨,转入2mL离心管,每管加500μL预热的DNA提取缓冲液(1g/100mL CTAB,1.4mol/L NaCl,80mmol/L Tris-HCl pH 8.0,20mmol/L EDTA pH 8.0),65℃保温30min,期间摇动2~3次。
(2)加500μL氯仿-异戊醇(24∶1,V/V),振荡混匀,10 000rpm离心10min。
(3)取上清,加2倍体积预冷无水乙醇,-20℃静置60min,10 000rpm离心10min。
(4)沉淀用75%的乙醇洗涤两次,室温风干。
(5)沉淀溶于200μL TE(pH 7.6),RNase(DNase-free)至200mg/L,37℃处理60min。
(6)加200μL酚-氯仿-异戊醇(25∶24∶1,V/V),振荡混匀,10 000rpm离心10min。
(7)取上清,加200μL氯仿-异戊醇(24∶1,V/V),10 000rpm离心10min。
(8)取上清,加1/10体积3mol/L NaAc、2×体积预冷无水乙醇,混匀,-20℃静置60min,10 000rpm离心10min。
(9)75%乙醇洗涤两次,室温风干,溶于50μL灭菌双蒸水。-20℃保存备用。
(三)DNA纯度和含量的测定
取一定量的DNA提取液进行一定倍数的稀释后,在260、280和320nm下分别测定OD值,以(OD260-OD320)/(OD280-OD320)计算核酸纯度,自然界核酸纯度范围为1.6~2.0,一般以1.8±0.2为宜;核酸浓度(ng/μL)≈50×(OD260-OD320)/L×D(L为光径长度cm,D为稀释倍数),根据结果将核酸浓度稀释至适合的PCR用模板浓度100~300ng/μL。
(四)rDNA-ITS扩增
以表20-2所示的PCR反应组成,按以下反应条件扩增全长序列的ITS。在PCR过程为防止水分的蒸发可以加20μL石蜡油覆盖于混合物上。
表20-2 ITS PCR的反应组成
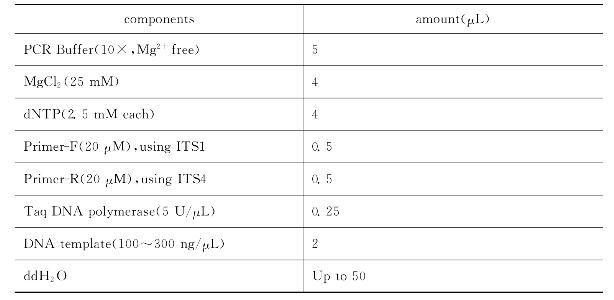

反应完毕后取5μL用1%琼脂糖凝胶电泳检测,使用0.15μg/mL EB或3× GelRed进行后染30min,然后在凝胶成像仪上进行显影成像,观察是否扩增出目的条带。
(五)PCR产物的纯化
采用小量DNA片段快速胶回收试剂盒进行PCR产物的纯化,具体操作步骤如下:
(1)用灭菌的刀片割下含目的条带的琼脂块,放入1.5mL灭菌离心管中。
(2)加入溶胶液(100μL胶块加300μL溶胶液),室温溶胶(或55℃溶胶),其间偶尔摇动;加入异丙醇(100μL胶块加150μL异丙醇),混匀;将溶解液装柱,12 000rpm,离心30s;弃废液。
(3)加入500μL漂洗液漂洗,12 000rpm,离心30s,重复漂洗一次。倒掉柱下面的废液以后,再于12 000rpm离心2min。
(4)在柱子中加入合适体积的洗脱缓冲液(通常用30~50μL),12 000rpm,3~5min离心洗脱。
(5)取2μL回收样品进行琼脂糖凝胶电泳,以检测回收结果,最终的回收样品置-20℃冻存。
(六)r DNA-ITS测序与分析
经纯化的PCR产物送上海生工生物工程技术服务有限公司进行测序。将测得的序列提交美国NCBI的GenBank获取对比指标靠前的20个相似序列,通过BLAST工具和DNAMAN软件进行比对分析,并以Neighbor-Joining方法构建系统发育树。
五、实验记录
(1)PCR扩增结果。
(2)r DNA-ITS序列测序与比对结果。
六、思考题
(1)简述rDNA-ITS序列分析鉴定真菌菌种的原理。
(2)简述rDNA-ITS序列分析鉴定真菌菌种的基本步骤。
参考文献
[1]陈剑山,郑服丛.ITS序列分析在真菌分类鉴定中的应用[J].安徽农业科学,2007,35(13):3785—3786,3792.
[2]刘艳梅,朱建兰,杨航宇.甘肃省曲霉菌的RAPD和ITS序列分析[J].中国酿造,2009(3):73—75.
[3]燕勇,李卫平,高雯洁,等.rDNA-ITS序列分析在真菌鉴定中的应用[J].中国卫生检验杂志,2008,18(10):1958—1961.
[4]谢丽源,张勇,邓科君,等.基于rDNA-ITS序列分析的桑黄真菌菌株分子鉴定[J].食品科学,2010,31(9):182—186.
[5]王延华.永新酱萝卜米曲中主要真菌的rDNA-ITS序列分析及其营养成分分析[D].南昌:南昌大学,2007.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















