实验二十一 变性梯度凝胶电泳解析微生物菌群结构
一、实验目的
(1)掌握变性梯度凝胶电泳的原理及用途。
(2)学习变性梯度凝胶电泳的操作方法,并解析环境样品中的微生物菌群结构。
二、实验原理
变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)技术是用于检测DNA突变的一种电泳技术。它的分辨精度比琼脂糖电泳和聚丙烯酰胺凝胶电泳更高,可以检测到一个核苷酸水平的差异。其原理是:双链DNA分子在一般的聚丙烯酰胺凝胶电泳时,其迁移行为决定于其分子大小和电荷。不同长度的DNA片段能够被区分开,但同样长度的DNA片段在胶中的迁移行为一样,因此不能被区分。DGGE/TGGE技术在一般的聚丙烯酰胺凝胶基础上,加入了变性剂(尿素和甲酰胺)梯度或是温度梯度,从而能够把同样长度但序列不同的DNA片段区分开来。一个特定的DNA片段有其特有的序列组成,其序列组成决定了其解链区域(melting domain,MD)和解链行为(melting behavior)。一个几百个碱基对的DNA片段一般有几个解链区域,每个解链区域有一段连续的碱基对组成。当温度逐渐升高(或是变性剂浓度逐渐增加)达到其最低的解链区域温度时,该区域这一段连续的碱基对发生解链。当温度再升高依次达到各其他解链区域温度时,这些区域也依次发生解链。直到温度达到最高的解链区域温度后,最高的解链区域也发生解链,从而双链DNA完全解链。因此,即使是大小相同,但碱基排列有差异的DNA片段,在不同浓度梯度的变性剂(尿素和甲酰胺)凝胶中电泳,根据部分解离的条件不同,其移动速度不同而得到分离。通过染色后可以在凝胶上呈现为分散的条带。因此,该技术可以分辨具有相同或相近分子量的目的片断序列差异,可以用于检测单一碱基的突变和遗传多样性以及PCR扩增DNA片段的检测,常常被用于环境样品中复杂微生物菌群的分析。
从环境样品中直接提取总DNA,经PCR扩增到含有某一高度可变区的目的DNA序列产物,通过DGGE得到图谱。因为每个条带就代表一个微生物物种,所以DGGE带谱中条带的数量,即反映该环境微生物群落中类群的数量。为了得到更详细的信息,往往采用种或类群专一性探针与得到的条带进行杂交或将条带切下,重新PCR扩增后测序,进而得到部分系统发育信息。
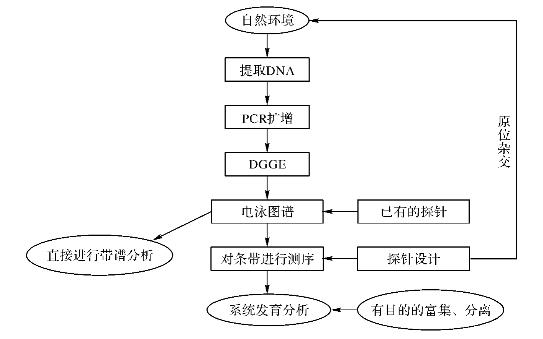
图21-1 PCR-DGGE工作流程
根据DGGE变性梯度的方向与电泳方向是否一致,可将其分为两种形式的DGGE。垂直DGGE的变性梯度方向垂直于电泳方向,常用的变性剂浓度梯度范围较宽,如0~100%、20%~70%,常用于优化样品的分离条件(即最佳变性梯度范围),电泳后经染色其DNA片段呈现“S”形曲线。水平DGGE的变性梯度方向平行于电泳方向,常用的变性剂浓度梯度范围较窄,可用于多个样本的同时分析,能更好地分离DNA片段。
三、实验器材
(一)样品
提取天然温泉水的宏基因组并制备16SrDNA V3区PCR扩增产物,作为本实验的基础材料。
(二)药品
乙二胺四乙酸二钠(EDTA-Na2),丙烯酰胺-双丙烯酰胺(37.5∶1),Tris,过硫酸铵(APS),TEMED,冰醋酸,去离子甲酰胺,6×Loading Buffer。
(三)溶液
(1)0.5mol/L EDTA(pH 8.0):在800mL水中加入186.1g二水乙二胺四乙酸二钠,在磁力搅拌器上剧烈搅拌,用NaOH调节溶液pH值至8.0(约需20g NaOH颗粒),然后定容至1L,分装后高压灭菌备用。
(2)50×TAE缓冲液:242g Tris,57.1mL冰醋酸,100mL 0.5mol/L EDTA (pH 8.0),定容至1L,高压蒸汽灭菌,室温保存。
(3)40%丙烯酰胺-双丙烯酰胺:40g丙烯酰胺-双丙烯酰胺(37.5∶1)用蒸馏水溶解,定容至100mL,4℃保存。
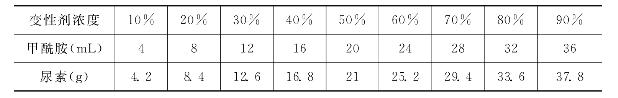
(4)丙烯酰胺变性胶制备:DGGE变性胶中的丙烯酰胺浓度为8%。变性剂浓度为0和100%的变性胶配方如下所示。

(5)变性剂溶液:DGGE的变性胶在普通的丙烯酰胺胶的基础上加入一定浓度的变性剂(甲酰胺和尿素),不同浓度变性剂溶液的配方如下所示。
(6)10%APS溶液:称取0.1g过硫酸铵,溶解于0.9mL的蒸馏水中。
(四)仪器
压力蒸汽灭菌器、pH计、移液枪、水平凝胶电泳仪、变性梯度凝胶电泳、凝胶成像系统。
四、实验步骤
(一)DGGE垂直电泳
1.丙烯酰胺变性凝胶胶溶液的配制
垂直DGGE的变性梯度方向与电泳方向垂直。这种胶适用于确定分离长度相同但序列不同的DNA片段的最佳梯度范围。垂直电泳的凝胶溶液中丙烯酰胺-双丙烯酰胺(37.5∶1)的浓度为8%,低浓度胶的变性剂浓度为20%,高浓度胶的变性剂浓度为70%。
2.垂直梯度胶7.5mm×10mm制胶板的装配
在灌胶之前,必须先将制胶板装配好,并检查其密封性。DGGE垂直胶的制胶板装配步骤如下:
(1)先将长玻璃板水平放置,再将两片塑料隔片分别放在长玻璃板的左右两侧,塑料隔片的厚度均为1.0mm,有凹槽的那面贴着长玻璃板,并且隔片上的小洞必须在玻璃外侧,使得两片隔片面对面,以确保凝胶溶液能流入“三明治”夹板。
(2)将短玻璃板叠在上面,底部和长玻璃板对齐,两片玻璃板和塑料隔片形成“三明治”夹板。
(3)将“三明治”夹板用左右两个夹具夹紧,并将左右两个注射螺帽拧紧,完全将“三明治”夹板固定住。
(4)将“三明治”夹板放在制胶架上,两边固定住,底部用海绵垫固定防漏,将夹具的螺丝柠松,在玻璃板中间插入直线隔片用来对齐两边的塑料隔板,对齐后将螺丝拧紧,并将直线隔板取出。
(5)将“三明治”夹板从制胶架上取出,在玻璃板中间的顶部插入两孔的梳子,从玻璃板底部的正中间插入中间隔片。
(6)将“三明治”夹板顶部用梳架固定住,确保密封性,然后将整个装置垂直放在制胶架上固定,注意短玻璃的一面正对着自己。
(7)装配好16mm×10mm制胶板,被中间隔片分成两块7.5mm×10mm的小制胶板。
3.垂直梯度胶的制备
在制胶板装配好后,将凝胶溶液用梯度形成器灌入制胶板,静置1h,等待凝胶凝固。步骤如下:
(1)将制胶板装置翻转90°。
(2)共有三根聚乙烯细管,其中两根较长的为15.5cm,短的那根长9cm。将短的那根与Y形管相连,两根较长的则与小套管相连,并连在10mL的注射器上。
(3)在两个注射器上分别标记“高浓度”与“低浓度”,并安装上相关的配件,调整梯度传送系统的刻度到适当的位置。
(4)反时针方向旋转凸轮到起始位置。旋松体积调整旋钮,将体积设置显示装置固定在注射器上并调整到4.5,旋紧体积调整旋钮。
(5)配制两种变性浓度的丙烯酰胺溶液各10mL,置于两个离心管中。
(6)每管加入60μL 10%APS,10μL TEMED,迅速盖上并旋紧帽后上下颠倒数次混匀。用连有聚乙烯管标有“高浓度”的注射器吸取所有高浓度的胶,对低浓度的胶同样操作。
(7)通过推动注射器推动杆小心赶走气泡并轻柔地晃动注射器,推动溶液到聚丙烯管的末端(注意不要将胶液推出管外,因为这样会造成溶液的损失,导致最后凝胶体积不够)。
(8)分别将高浓度、低浓度注射器放在梯度传送系统的正确一侧固定好(注意位置一定要放正确),再将注射器的聚丙烯管同Y形管相连。
(9)轻柔并稳定地旋转凸轮来传送溶液,此步骤最关键是要保持恒定匀速且缓慢地推动凸轮,以使溶液恒速地被灌入到三明治式的凝胶板中。
(10)让凝胶聚合大约一个小时,待凝胶凝固后,将制胶装置翻转180°,用同样的方法将另一块胶制好。
4.电泳
(1)在电泳槽中加入7L1×TAE缓冲液,并把电泳控制装置打开,预热到60℃。
(2)等两块胶都聚合完毕后拔走梳子,将胶放入电泳槽内,清洗点样孔,盖上温度控制装置使温度上升到60℃。
(3)将16SrDNA样品和6×Loading Buffer以5∶1混合,用注射针点样。
(4)按设定好的条件进行电泳,60℃,恒压80V,电泳1h。
(5)电泳完毕后用EB染色,然后用Bio-Rad Quantity One system拍照。
(二)DGGE水平电泳
1.丙烯酰胺变性凝胶胶溶液的配制
水平DGGE可以用来分析大量的样品。水平电泳的凝胶溶液中丙烯酰胺-双丙烯酰胺(37.5∶1)的浓度为8%,低浓度胶的变性剂浓度为35%,高浓度胶的变性剂浓度为55%。
2.水平梯度胶16mm×16mm制胶板的装配
(1)先将长玻璃板水平放置,再将两片塑料隔片分别放在长玻璃板的左右两侧,塑料隔片的厚度均为1.0mm。
(2)将短玻璃板叠在上面,底部和长玻璃板对齐,两片玻璃板和塑料隔片形成“三明治”夹板。
(3)将“三明治”夹板用左右两个夹具夹紧,将“三明治”夹板放在制胶架上,两边固定住,底部用海绵垫固定防漏。
(4)将夹具的螺丝柠松,在玻璃板中间插入直线隔片用来对齐两边的塑料隔板,对齐后将螺丝拧紧,并将直线隔板取出。
3.水平梯度胶的制备
(1)将海绵垫固定在制胶架上,把类似“三明治”结构的制胶板系统垂直放在海绵上方,用分布在制胶架两侧的偏心轮固定好制胶板系统,注意一定是短玻璃的一面正对着自己。
(2)共有三根聚乙烯细管,其中两根较长的为15.5cm,短的那根长9cm。将短的那根与Y形管相连,两根长的则与小套管相连,并连在30mL的注射器上。
(3)在两个注射器上分别标记“高浓度”与“低浓度”,并安装上相关的配件,调整梯度传送系统的刻度到适当的位置。
(4)反时针方向旋转凸轮到起始位置。为设置理想的传送体积,旋松体积调整旋钮,将体积设置显示装置固定在注射器上并调整到14.5,旋紧体积调整旋钮。
(5)配制两种变性浓度的丙烯酰胺溶液各20mL,置于两个离心管中。
(6)每管加入120μL 10%APS,20μL TEMED,迅速盖上并旋紧帽后上下颠倒数次混匀。用连有聚乙烯管标有“高浓度”的注射器吸取所有高浓度的胶,对低浓度的胶同样操作。
(7)通过推动注射器推动杆小心赶走气泡并轻柔地晃动注射器,推动溶液到聚丙烯管的末端。
(8)分别将高浓度、低浓度注射器放在梯度传送系统的正确一侧固定好,再将注射器的聚丙烯管同Y形管相连。
(9)轻柔并稳定地旋转凸轮来传送溶液,此步骤最关键是要保持恒定匀速且缓慢地推动凸轮,以使溶液恒速地被灌入到“三明治”式的凝胶板中。
(10)小心插入梳子,让凝胶聚合大约一个小时。在电泳槽中加入7L1×TAE缓冲液,并把电泳控制装置打开,预热至60℃。
(11)聚合完毕后拔走梳子,将胶放入到电泳槽内,清洗点样孔。
(12)将16SrDNA样品和5×Loading Buffer以5∶1混合,用注射针点样,上样量为30μL PCR产物。
(13)盖上温度控制装置使温度上升至60℃,然后开始电泳。
(14)电泳完毕后用EB染色,然后用Bio-Rad Quantity One System拍照。
4.电泳条件
水平DGGE的电泳条件为60℃,恒压150V,电泳4.5h。
(三)特征条带的回收及纯化
纯化的PCR产物进行DGGE分析后,然后根据需要对图谱中的条带进行割胶回收。
(1)用干净的无菌手术刀片将特征条带切割下来,用无菌蒸馏水清洗胶表面后放入洁净的无菌1.5mL离心管中。
(2)用无菌枪头将凝胶块捣碎。
(3)加入20μL ddH2O,混匀,4℃下放置过夜。
(4)稍微离心,将上清液转移到新的1.5mL离心管中。
将回收到的DNA片段再进行PCR扩增,PCR反应体系和程序同上。将回收DNA的PCR产物再用DGGE分析,确定此条带在DGGE图谱上的位置和原始条带一致,才能进行序列分析。
(四)16SrDNA序列分析
回收到的DNA片段经过PCR扩增,16SrDNA扩增引物F341-GC/R518,模板为回收产物10μL,程序采用降落PCR。测序由上海生工生物工程有限公司完成。登录NCBI(www.ncbi.nlm.nih.gov/blast/),将所得序列与数据库中已知序列进行比较。用Clustal X进行相似性分析,然后用MEGA 4.0软件构建系统发生树。
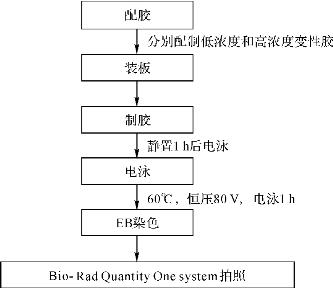
图21-2 系统发生树
五、实验记录
(1)分析电泳后形成的条带。
(2)将实验拍照结果贴到指定框内。

六、思考题
(1)DGGE技术可以应用到哪些领域?
(2)DGGE在制胶过程中有哪些注意事项?
(3)V3区为何可被用于细菌的分类学研究?
参考文献
[1]都立辉,刘芳.16SrRNA基因在细菌菌种鉴定中的应用[J].乳业科学与技术,2006,120(5):207—209.
[2]Liang ZB,Drijber RA.A DGGE-cloning method to characterize arbuscular mycorrhizal community structure in soil[J].Soil Biology and Biochemistry,2008,40(4):956—966.
[3]Cherif H,Ouzari H,et al.Bacterial community diversity assessment in municipal solid waste compost amended soil using DGGE and ARISA fingerprinting methods[J].World Journal of Microbiology &Biotechnology,2008,24(7):1159—1167.
[4]Yoshida A,Seo Y,et al.Actinomycetal community structures in seawater and freshwater examined by DGGE analysis of 16SrRNA gene fragments [J].Marine biotechnology,2008,10(5):554—563.
[5]Smalla K,Oros-Sichler M,Milling A,et al.Bacterial diversity of soils assessed by DGGE,T-RFLP and SSCP fingerprints of PCR-amplified 16SrRNA gene fragments:do the different methods provide similar results?[J].Journal of Microbiological Methods,2007,69(3):470—479.
[6]The DCodeTM Universal Mutation Detection System.Catalog Numbers 170—9080 through 170—9104.
[7]Zidkova K,Kebrdlova V.Detection of variability in apo(a)gene transcription regulatory sequences using the DGGE method[J].Clinica Chimica Acta,2007,376(1):77—81.
[8]Hong H,Pruden A,Reardon K F.Comparison of CE-SSCP and DGGE for monitoring a complex microbial community remediating mine drainage[J].Journal of Microbiological Methods,2007,69(1):52—64.
[9]杨龙.氡温泉耐辐射嗜热微生物的分类鉴定及其耐辐射机制的初步研究[D].杭州:浙江工商大学,2010.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














