一、细菌活菌数的测定
1.平板菌落计数法
平板菌落计数法是根据在固体培养基上生长的菌落计数,每一个菌落由一个单细胞繁殖而成,为肉眼可见的细胞群体。根据菌落数可以计算出待测菌液中的活菌数量。
(1)取水样1ml利用无菌水按10倍数作一系列稀释,水样稀释浓度以在平板上长出的菌落数在30~300个之间为宜。稀释时应尽量使微生物细胞分散开,否则易生长出片状菌苔。稀释过程参考实验五。
(2)以无菌操作用无菌移液管吸取1ml充分混匀的水样,注入无菌平皿中,再倾入约15ml已融化并冷却到45℃的营养琼脂培养基,迅速转动,使水样与培养基充分混匀。
(3)置水平位置静止凝固后,倒置于37℃下培养24小时。每个水样取3个连续适宜稀释菌液倒平板,各倾注3个平皿,同时做不加水样空白对照。
(4)待菌落生长好取出平皿计数,统计出同一稀释度一个平皿上菌落的平均数。根据以下公式计算:每毫升菌液中活菌总数=同一稀释度的菌落平均数×稀释倍数。
(5)菌落计数原则:先计算相同稀释度的平均菌落数。若其中一个平皿有较大片状的菌苔生长时,则不宜采用,而应以无片菌苔的平皿作为该稀释度的平均菌落数。若片状菌苔不到平皿的一半,而其余一半中菌落数分布又很均匀,可将此一半平皿计数后乘2以代表全皿菌落数。
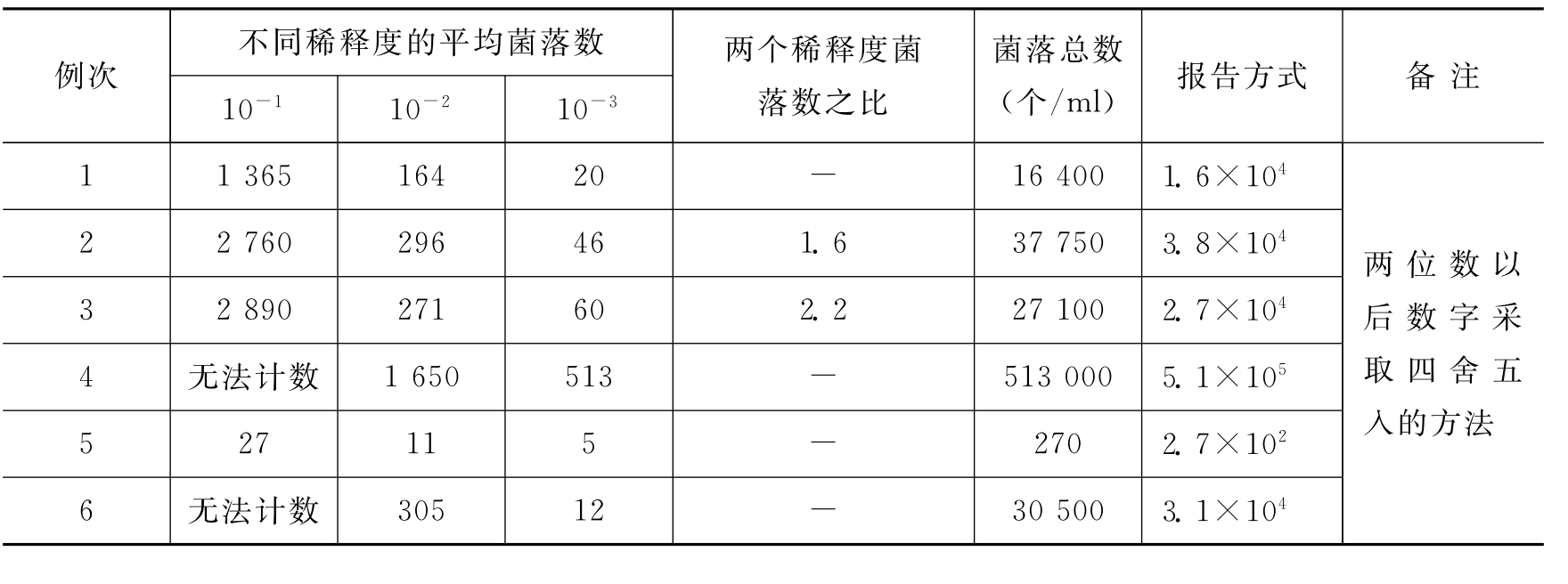
首先选择平均菌落数在30~300之间的,当只有一个稀释度的平均菌落符合此范围时,则以该平均菌落数乘以其稀释倍数报告之(表10-1中例1)。
若有两个稀释度,其平均菌落数均在30~300之间,应按两者菌落总数之比值来决定。若其比例小于2应报告两者的平均数,若大于2则报告其中稀释度较小的菌落总数(表10-1中例2、例3)。
若所有稀释度的平均菌落数均大于300,则应按稀释度最高的平均菌落数乘以稀释倍数(表10-1中例4)。
若所有稀释度的平均数均小于30,则应按稀释度最低的平均菌落数乘以稀释倍数(表10-1中例5)。
若所有稀释度的平均菌落数均不在30~300之间,则以最接近300或30的平均菌落数乘以稀释倍数(表10-1中例6)。
菌落计数报告,菌落数在100以内按实有数报告,大于100时采用两位有效数字,在两位有效数字后面的值,以四舍五入方法计算,为了缩短数字后面的零数也可用10的指数来表示(表10-1中“报告方式”栏)。在报告“菌落无法计数”时,应注明水样的稀释倍数。
表10-1 计算细菌菌落总数方法的示例
(6)细菌总数测定方法的改进。依上述方法观察计数,但深层较小菌落容易遗漏,造成计数上误差较大。由于多数细菌具有脱氢酶,在培养皿中产生脱氢作用,遇到氯化三苯基四氮唑(TTC)在平板上显现深浅不同红色小点或红色片状物均为细菌。TTC的投加量以0.01%及0.04%为宜,切忌TTC浓度过高,否则对细菌具有抑制作用。
使用该改进方法时,要注意如下情况:①要注意选择好倒平板的稀释度,一般以3个稀释度中的第二稀释度倒平板所出现的平均菌落数在50个左右为最好;②由3个稀释度(10-4、10-5、10-6)计算出的每毫升菌液中总活菌数应很接近,如相差较大,表示试验不准确,应重做。
2.液体稀释法(MPN法)
此法也可进行活菌数计算,由于某些微生物在琼脂平板上不易生长,故不适用平板菌落计数,但在液体培养基中生长易于检查。因此,根据某些稀释菌液接种培养后所生长微生物的试管数,用统计数学方法计算出原样品的含菌量,此法也称为最或然数技术或最大可能数量法,简称MPN法。反硝化细菌、氨化细菌、类大肠杆菌及紫色非硫光合细菌均可利用此法计数。
操作时先将样品作一系列的10倍稀释,至最后一级稀释液接种后,不出现菌的生长为临界级数。取后5种稀释液接种于无菌的液体培养基中,一般需做3~5管平行实验。适温培养,根据生长菌试管数,确定数据指标,查出菌的近似值,再行计算。
下面以5管平行实验为例来介绍检验方法。其他3管、4管平行实验同理依次查表计算,一般要根据实验精确度要求选择管数,一般用3管平行实验即可。
(1)取1ml样品,按10倍作一系列稀释至10-10。
(2)利用无菌移液管分别从不同浓度稀释液中各取1ml,分别接种到5支已灭菌液体培养基试管中。适温培养2~14天,记录每个稀释液出现细菌生长的试管数来确定数量指标。注意每种稀释度必须更换一支移液管。
(3)数量指标的确定,不论重复系数多少均取3位数字。
1)如果生长情况如下:
表10-2 生长情况表一
取各重复管数都有菌生长的最高稀释度的生长管数,为数量指标的第一个数字,其后两个稀释度的生长管数作为其他的个数。就上例4个重复生长的有10-3及10-4两个稀释度,取其中高稀释度10-4,其中生长管数“4”作为数量指标的第一位数字;10-5为3及10-6为1,因此所得数量指标为4、3、1。
2)如果生长情况如下:
表10-3 生长情况表二
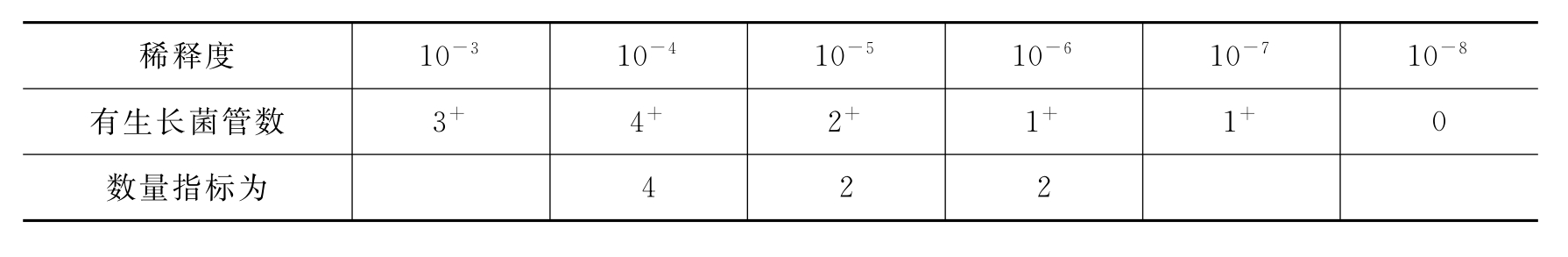
依原则1)数量指标第一数字应取10-4的4,其后两个数字是“2”和“1”,可是更高稀释度10-7中还有1管生长,因而需将这个管加在第三个数上,所以数量指标数为4、2、2。
3)如果生长情况如下:
表10-4 生长情况表三
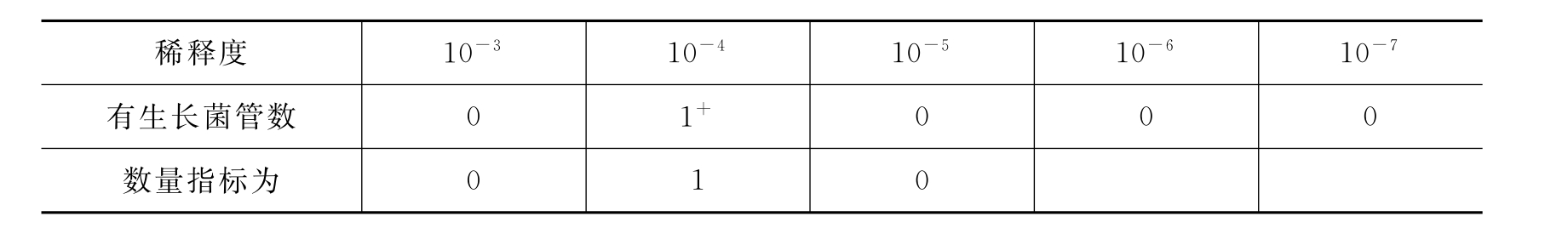
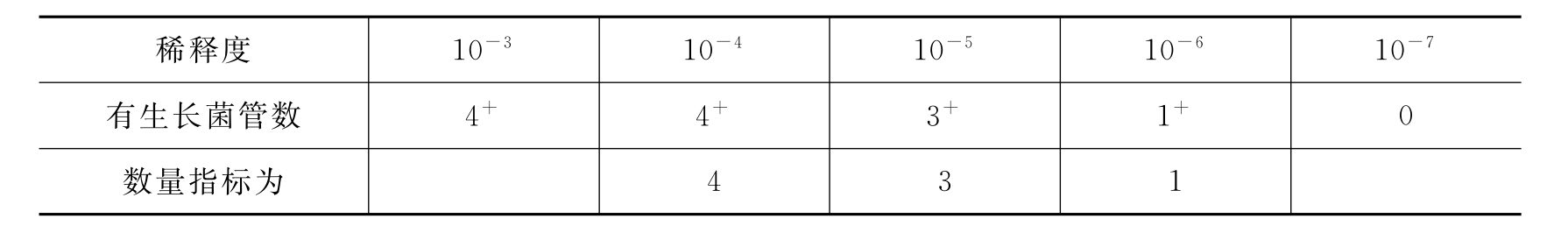
所取数量指标应使有生长菌的管数位于中间。
确定数量指标后查附表1得出菌近似值。
(4)计算方法。利用以下公式计算原菌液的最大可能数。
1ml(g)样品中的菌数=菌近似值×数量指标第一位数的稀释倍数。
3.滤膜过滤计数法
当单位体积水样中所含微生物数量较少时,可通过超滤膜过滤浓集后,再进行培养计数。
(1)滤膜主要是由硝化纤维制成的白色薄膜,根据实验要求可选择不同大小的孔径及直径。使用前应先经灭菌处理,将滤膜放入装有蒸馏水的烧杯中,置于沸水浴中煮沸灭菌3次,每次15分钟。前两次煮沸后需更换水洗涤3次,以除去残留溶剂。
(2)利用无菌镊子取滤膜,安装于过滤器上,将过滤器装于抽滤瓶上,并与真空泵相连接。
(3)取适量水样放入过滤器漏斗内过滤,若水样量少应加无菌水稀释、混匀过滤,过滤水样多少根据漏斗直径决定。开动真空泵抽滤,使水样中微生物被截留在滤膜上。待水样全部滤完,立即停止抽滤。
(4)打开滤器,利用无菌镊子取下滤膜,过滤面向上放于平板培养基上,使滤膜与培养基之间贴紧,不可留有气泡。盖好培养皿盖,倒置适温培养,若培养时间较长可将小培养皿放于铺有湿脱脂棉的大培养皿内,以保持皿内湿度。每个水样做3个平皿培养。计算膜上菌落数,取平均值,计算出每毫升水样的含菌数。
![]()
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















