Fenical研究组从Cortez海面采集的珊瑚体表分离到放线菌Streptomyces sp.PG-19。用乙酸乙酯粗提该菌株的肉汤培养液,得到的粗提物对8-16-F1o牲畜黑素瘤细胞和HCT-11d人类结肠肿瘤细胞有明显的体外细胞毒作用。该粗提物通过硅胶真空快速色谱梯度洗脱,然后再通过硅胶高效液相色谱法分离,得到octalactin A和octalactin B(图5-6)。其中octalactin A是抗肿瘤活性的主要贡献者,半抑制浓度(IC50)分别为7.2×10-3μg/mL(B-16-F10)和0.5μg/mL(HCT-116)。尽管octalactin A和octalactin B(图5-6)结构紧密相关,但后者在对牲畜和人类癌细胞细胞毒检测中完全没有活性,这可能与环氧基团有关。
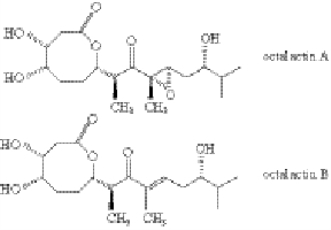
图5-6 octalactin A和octalactin B的结构式
Fenical研究组从Bodega海湾浅海沉积物样品中分离到一株疑似Maduromycetes属的放线菌CNB-032,其培养液用乙酸乙酯萃取得粗提物,粗提物中分离得到油状化合物,该化合物对Bacillus subtilis显示弱的抗菌活性,经鉴定为maduralide大环内酯化合物。
丁内酯类化合物以作为信号化合物而著名,可以引发和调节次级代谢物的产量,干扰病原菌体间信息的传递,从而达到抗菌目的。这种抗菌方式能降低耐药菌株的产生概率,因此是今后抗生素的发展方向。Fenical研究组从巴哈马岛沉积物样品中分离到放线菌BNB-228,在其发酵液中分离到新颖的丁内酯 -(1′R,2S,4S)-2-(1-羟基 -6-甲基庚基)-4-羟甲基丁内酯,它与virginiae butanolide A结构相似,有相同的分子式C11H20O4,但内酯环的γ位取代形式显著不同。该内酯为淡黄色油状液体,具有抑菌活性。除了放线菌BNB-228外,德国Mukku等从海洋沉积物分离到的链霉菌株B5632和B3497也可以产生几个新的丁烯内酯。菌株B5632在用人工海水配制的YMG培养基中发酵,发酵液通过硅藻土过滤,再用乙酸乙酯萃取,粗提物用甲醇环己烷分配脱脂,甲醇层浓缩后通过快速色谱柱,配以生物活性检定法获得4个已知的抗霉素和3个新的丁烯内酯,即4,10-二羟基 -10-甲基 -十二 -2-烯 -1,4-内酯和两个非对映异构体4,11-二羟基 -10-甲基 -十二 -2-烯 -1,4-内酯;而菌株B3497用同样方法可以产生抗霉素A(antimycin A)和1个新的酮式丁烯内酯,即4-羟基 -10-甲基 -11-氧代 -十二 -2-烯 -1,4-内酯。从Mozambique海岸附近印度洋采集的海绵中,分离到一株小单孢菌属放线菌L-25-ES25-008。从其发酵液中分离到新颖的生物活性大环内酯IB-96212(图5-7),该内酯对P-388肿瘤细胞具有非常强的细胞毒活性,对肿瘤细胞A-549、HT-29和MEL-28亦具有细胞毒性。
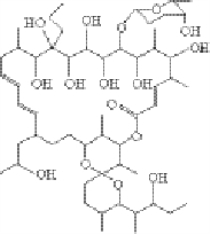
图5-7 小单孢菌属放线菌L-25-ES25-008所产生的生物活性大环内酯IB-96212的结构式
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















