体外细胞培养所需的基本环境、生存条件及物质代谢过程与体内细胞基本相同,但随着生存环境的改变也会有一定的差异。
一、细胞培养的基本环境
无论从事何种细胞培养,培养环境中无毒、无菌都是保证培养细胞生存的首要条件。无菌技术主要包括以下几个部分。
(一)工作环境的无菌及表面处理
可采用紫外线对细胞培养室空气、超净工作台操作表面消毒,一般距紫外灯2.5m范围内直接照射20min即可。也可用消毒剂对细胞培养室的工作面、墙壁、地面和空气等进行灭菌处理,如70%乙醇用于消毒皮肤或瓶皿开口部位;10%苯扎溴铵(新洁尔灭)用于擦洗工作台;0.1%苯扎溴铵可以对器械、皮肤、操作表面进行浸泡消毒;乳酸可用于空气消毒。
(二)培养用品的清洗和无菌处理
1.培养用品的清洗
(1)玻璃瓶皿的清洗:培养用玻璃器皿主要有:玻璃瓶,用于配制储存种种培养液、血清等液体,常以500ml、200ml、100ml的生理盐水瓶代替;培养瓶,用于培养细胞,有200ml、100ml、30ml、25ml、15ml等规格;培养皿,用于培养细胞和分离组织细胞及软琼脂培养等,分120mm、60mm等几种;吸管,包括刻度吸管及短尖吸管,用于吸取各种液体;离心管,用于离心、漂洗和分离细胞,常用离心管分为50ml、15ml、10ml、5ml等规格。其他还有三角烧瓶、烧杯、量筒、漏斗、试管、注射器等。
玻璃器皿清洗的一般步骤:煮沸10min→刷洗→流水振荡冲洗→烤干→清洁液浸泡24h流水振荡冲洗→沥水→蒸馏水浸泡2次,每次12h→烤干备用。
玻璃器皿清洗要领,①浸泡:初次使用的玻璃器皿使用前浸泡在5%稀盐酸中过夜,以中和玻璃表面的碱性物质并去除可能的霉斑,然后经简单刷洗,流水冲洗,蒸馏水浸泡,干燥备用。新玻片处理后,短时间不用时,须将它投入95%乙醇中保存,以防长霉。培养后的玻璃器皿应立即投入浅水中浸泡。②刷洗:用过的玻璃器材经自来水冲洗后,浸入水中煮沸,然后将适量洗涤剂(洗洁精或洗衣粉)投入沸水中继续煮沸10min,趁热刷洗器皿内外,刷洗后浸入浅水中进行冲洗。③酸泡:刷洗好的玻璃器皿干燥后置清洁液中浸泡24h,浸泡、煮沸、酸泡的器皿内要充满液体,不得有气泡。
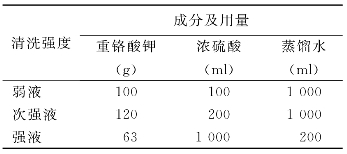
清洗液的配制:表2-1所示为常用的三种强度的清洁液。新配制的清洁液为棕红色,遇有机溶剂或水分增多时变成绿色,表明已失效。
配制时先在盆中加入蒸馏水,加热至重铬酸钾溶解,再将盆置流动自来水中。待重铬酸钾溶解后,缓慢加入浓硫酸,边加边用玻棒搅动,以混合液温度不过快上升和不出现重铬酸钾结晶为度。
表2-1 清洁液的配制
(2)橡胶用品的清洗:胶塞类橡胶用品,每次用后先用蒸馏水浸泡,然后用2% NaOH溶液煮沸15~20min,用自来水冲洗干净,再用1%稀盐酸溶液浸泡30min,再用自来水冲洗、蒸馏水漂洗2~3次,最后双蒸水漂洗1次,烤干备用。
(3)金属器械的清洗:金属器械主要用于解剖动物、取材和原代培养组织等,新的解剖器械应先用纱布擦去防锈油后,再用洗涤剂煮沸刷洗,然后用自来水、蒸馏水、双蒸水冲洗,烤干备用;用过的器械须擦净、晾干,以防生锈。
(4)塑料器皿的清洗:细胞培养用的塑料器皿主要有培养板(有4、6、12、24、96孔等规格)、培养皿(有30、60、100mm等规格)、培养瓶等。这些产品主要是进口的一次性商品,已经消毒灭菌,打开就可使用。如果要反复使用,可按如下方法清洗:用后立即用流水清洗或浸泡在水中,用脱脂棉轻轻擦拭掉残留附着物或用超声清洗机清洗后,流水冲净,浸泡在清洗液中过夜,再用自来水冲净,蒸馏水漂洗2~3次,晾干备用。
注意事项:通常单层细胞培养物在塑料瓶中比玻璃瓶中更易附着、生长更快。塑料瓶本身无活性,更适宜在4℃储存溶液,但其价格昂贵,不能重复使用。
2.消毒灭菌 所有培养用品在消毒灭菌前必须进行适当的包装,以保证灭菌后不受到外界的污染。吸管在清洗晾干后待消毒前,在管的根端口中须用尖镊取少许脱脂棉堵塞,松紧要适宜;堵塞过多妨碍透气,过少易脱落和不起防异物作用。
消毒灭菌的方法有多种,随物品不同,采用的方法也不同。总的来说有物理方法和化学方法两大类。物理方法有湿热(高压蒸汽)、干热、过滤和紫外线等;化学方法是使用化学消毒剂、抗生素等杀灭微生物。
(1)湿热灭菌:即高压蒸汽灭菌,是最常用和最有效的一种方法。布类、胶塞、金属器械、玻璃器皿及某些培养用液都可用此法消毒灭菌。
湿热消毒一般过程:打开排气阀→加热→排出冷空气后关闭排气阀→升到所需压力时调节火焰大小使压力稳定在所需数值并开始计时→到达所需时间后停止加热→压力指针降至零位后取出物品。各种物品有效消毒压力和时间不同,一般物品(如布类、金属器械、玻璃器皿等)消毒的要求是0.15MPa(126℃)20min;橡胶制品为0.1MPa(121℃)10min;常规液体消毒0.15MPa(126℃)15min。
注意事项:湿热消毒时,消毒物品不能装得过满,以保证消毒器内气体的流通。消毒过程中,消毒者不能离开岗位,要经常检查压力是否恒定,如有偏离,应及时调整。不可用安全阀摘子排气。
(2)干热灭菌:主要适用于一般器皿。用电热鼓风干燥箱加温到160℃,保持1h,可达到消毒目的。
(3)滤过除菌:大多数培养用液,如人工合成培养液,血清、酶溶液等,在高温下会变性,失去功能,因此必须采用滤过法除菌。目前常用微孔滤膜滤器进行滤过除菌时,有一次性和反复使用的两种。一次性滤器打开后就可使用。其他各种滤器如不锈钢正压滤器等必须清洗后经高压蒸汽消毒、烤干后方可使用。滤膜常使用0.22μm孔径,为一种特制的混合纤维素酯,其滤过速度快,效果较好。
(4)抗生素:主要适用于培养用液消毒灭菌,不同种类抗生素适于杀灭不同微生物,但多数是为了预防。最常用的抗生素为青霉素、链霉素等。常规培养用液抗生素浓度为:青霉素100U/ml、链霉素100U/ml。
此外还有前面提到的紫外线、消毒剂消毒及电离辐射消毒等。
(三)无菌操作的基本要领
1.培养前的准备 要充分做好培养前的实验用品准备工作,根据实验的要求进行物品清点包装,注明标签后灭菌、烤干备用。在工作前移入超净工作台内。
2.超净工作台的消毒 工作面要先用苯扎溴铵或乙醇擦拭一遍后,打开紫外线灯灭菌,用30W紫外线灯管直接归入20~30min。然后关闭紫外线灯,打开风机。培养用液和培养细胞不能放在紫外线下直接照射,在操作时携入。
3.洗手和着装 原则上与外科手术洗手相同。先用肥皂刷洗手和前臂,再用流水冲洗,然后用0.2%苯扎溴铵或70%乙醇擦洗。穿无菌服,戴无菌帽和口罩。
4.火焰消毒 在无菌条件下操作时,首先要点燃酒精灯,此后一切操作,如安装吸管橡皮头、打开瓶塞等都要经过火焰烧灼,或在近火焰处进行。注意金属器械不能在火焰烧灼时间过长。烧过的用具要待冷却后才能夹取组织,以免造成组织损伤。
5.无菌培养操作 进行细胞培养操作时,动作要准确敏捷,但又不能太快,以防空气流动,增加污染机会。不能用手接触器皿的无菌部分,如已接触,要更换或用火焰烧灼触及部。为拿取方便,工作台面上的实验用品布局要合理,原则上为右手使用方便的用品放在右侧,左手用品放在左侧。培养用液不要过早开瓶,不要长时间起立暴露开口,以免增加污染机会。吸取不同培养用液时,应分别使用不同的吸管,以防扩大污染或增加混淆不同细胞的机会。
6.注意事项 初学者向有经验的细胞培养操作人员学习吸管、细胞培养瓶、培养皿、各种瓶子等的简便操作方法是大有益处的,也可购买到技术操作训练相关的录像带或光盘。
二、细胞培养的基本条件
1.水 体外培养的细胞对水的质量非常敏感,要求培养细胞用液必须使用新鲜三蒸水配制。
2.温度 与多数哺乳类动物体内温度相似,培养细胞的最适温度为37℃,偏离此温度,细胞的正常生长及代谢将会受到影响甚至导致死亡。实践证明,细胞对低温的耐受性要比对高温的耐受性强些,低温下会使细胞生长代谢明显降低;一经恢复正常温度时,则细胞会再行生长。若在40℃左右,则几小时内细胞便会死亡。因此高温对细胞的威胁很大。
3.酸碱度 细胞培养的pH最适为7.2~7.4之间,当pH低于6或高于7.6时,细胞的生长会受到影响,甚至导致死亡。但是,多数类型的细胞对偏酸性的耐受性较强,而在偏碱性的情况下则会很快死亡。因此培养过程一定要控制pH。
4.渗透压 人血浆渗透压约290mmol/L,可视为培养细胞的理想渗透压。对大多数细胞来说,渗透压在260~320mmol/L范围内都适宜。
5.气体 细胞的生长代谢离不开气体,容器空间中的O2及CO2用以保证细胞体内代谢活动的进行,但作为代谢产物的CO2在培养环境中还有另一个重要作用:调节pH的作用。当细胞生长旺盛、CO2过多时,会使培养液中的pH下降;反之,若容器内的CO2外溢时,会使pH升高。CO2培养箱可根据需要持续地提供一定比例的CO2气体,这样便可以将培养环境中的氢离子浓度保持恒定以提供一个比较稳定的pH范围。
6.营养 体外培养的细胞所需营养必须从培养液中获取。目前在细胞培养中广泛使用的是合成培养基,其主要成分由氨基酸、维生素、糖类、无机盐和其他一些辅助物质组成。根据培养对象和目的不同,已设计出多种培养基,常用的有:RPMI 1640、Eagle’s MEM、DMEM、Ham’s F10、TC199与F12等。对于动物细胞来说,合成培养基只能维持细胞的生存,要想使细胞更好地生长和繁殖,还需补充部分天然培养基,如人和动物的血清、血浆和胎汁等。通常是添加10%~20%的小牛血清。无血清培养基是由基础培养基和替代血清的补充因子组成,如生长因子、激素、促贴附、转铁蛋白等活性物质,这类培养基价格比较昂贵。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















