一、血管内皮细胞的获取
血管内皮细胞是衬于在心、血管和淋巴管腔内表面的一种单层扁平上皮。内皮细胞极薄,在体内呈梭形,相邻细胞之间借少量黏合质彼此嵌合,细胞长轴与血流方向平行。其超微结构特点是在胞质中含有的特殊颗粒,称Weibel-Palade小体(内含有与凝血有关的第Ⅷ因子相关抗原);细胞间有紧密连接和缝隙连接。内皮细胞除了能保持血管壁内表面光滑和通透性外,还有多种生物学功能:维持正常的血液流动性、分泌多种生物活性物质,在调节细胞生长、改变脂质代谢、维持血管壁完整性、调节血管张力和选择性通透性以及免疫调节等方面起重要作用。体外培养中的内皮细胞形态呈“鹅卵石样”镶嵌排列,细胞长满后呈接触抑制现象。
下面简述猪主动脉内皮细胞的培养。
体外培养主动脉内皮细胞常用分离细胞培养法。这一方法也适用于牛、兔、鼠和人等动物较大血管的内皮细胞培养。
【实验材料】
(1)材料来源:幼猪的主动脉(幼猪体重8~10kg)。
(2)培养用液:M199培养液(含20%小牛血清);0.125%胰蛋白酶-0.01%EDTA(1∶1,V∶V)混合消化液;D-Hanks液、100U/ml链霉素。
(3)培养器具:培养瓶或皿,白内障刀,眼科剪、镊子等。
【原代培养操作】
(1)在37℃水浴中,预热培养用的所有无菌溶液,备用。
(2)在未麻醉状态下,将动物颈部和胸、腹正中线的毛剃去。用碘酒、乙醇行常规消毒。在颈部切口。分离并剪断颈动脉,放血处死。在无菌条件下,作胸、腹联合切口,迅速打开胸腔,分离并取出胸主动脉和腹主动脉,放入含D-Danks液的培养皿中。
(3)在超净工作台上,用眼科剪、镊尽量去除血管外膜的脂肪和纤维组织。然后用D-Hanks液多次冲洗血管外表及血管腔内的凝血。再放入新装有D-Hanks液的培养皿中。
纵向剪开血管,反复冲洗干净血管壁后,在另一无菌大培养皿中,滴加薄薄一层0.125%胰蛋白酶-0.01%EDTA的混合消化液2~3ml。将主动脉内膜面朝下铺在酶混合液上。在37℃条件下,让内膜与酶溶液充分接触并消化10~20min。再加入少量含小牛血清的M199培养液,以终止酶的作用。
(4)把上述主动脉移至另一无菌培养皿内,用白内障刀轻轻将内皮刮下。先顺向、有次序地刮内膜1~2次,然后横向刮1~2次。
(5)用M199培养液2~3ml,将内皮细胞收集到离心管中,以1 000r/min离心7~10min。也可省去离心,直接用含20%小牛血清的M199培养液,将刮下的内皮细胞收集到培养瓶中,并调至细胞密度1.5×105~2.0×105个/ml。
(6)离心后弃去上清液,加入新鲜的含20%小牛血清、100U/ml链霉素的M199培养液(pH7.2)。重新轻轻吹打悬起细胞,制成密度为1.5×105~2.0×105个/ml的细胞悬液,接种在培养瓶或培养皿内,置37℃、5%CO2培养箱中(湿度100%)培养。
(7)24h后,弃培养液,用D-Hanks液清清洗1次。换液时将原培养液弃掉1/2~2/3,然后加入新鲜的上述培养液至原来的量。待细胞长至融合状态后,即可传代。
(8)每2~3d换培养液1次。换液时将原培养液弃掉1/2~2/3,然后加入新鲜的上述培养液至原来的量。待细胞长至融合状态后,即可传代。
【传代培养操作步骤】 人或其他动物的内皮细胞传代培养方法基本相同。
(1)待原代培养的细胞长至融合状态后,弃培养液,用预温的D-Hanks液轻轻洗2次。加入0.125%胰蛋白酶-0.01%EDTA混合消化液,正好形成一浅层液面将细胞覆盖,室温(20~25℃)下消化1~2min。
(2)镜下见细胞稍收缩变圆、细胞间隙增宽后,立即反转培养瓶,弃酶液。可再用DHanks液轻轻洗1次。加入新鲜含20%小牛血清,100U/ml青霉素和100μg/ml链霉素的M199培养液(pH7.2)。
(3)用弯头吸管吸取培养液,轻轻将细胞吹打下来。调整细胞密度至大约1.5×105个/ml。按实验需要接种到新的培养瓶或其他培养器皿中。一般按1∶2或1∶3的比例传代(即1瓶传2~3瓶)。
(4)每隔2~3d换液1次,每次换掉2/3量。待细胞长至融合状态后,又可传代。
【结果】 用酶消化法进行的原代培养,从动脉内膜上消化收集下来的内皮细胞,半小时后即开始贴壁,呈扁平短梭形或多角形分散生长;4~6h后,大部分细胞已贴壁,并开始生长、分裂;24h后,内皮细胞形成数量不等的细胞群;约7d后细胞融合成片。
传代培养的内皮细胞,10min后贴壁,5~7d内即可融合成单层。
【讨论】
(1)接种材料的制备:血管取材的离体时间不宜过长,一般不超过6h。如不能当即培养,则应放置4℃下保存(但不应超过24h)。取材地点如远离培养室,应结扎血管两端带回,以防污染,并在培养前,减去结扎的血管两端,用含抗生素的D-Hanks液冲洗血管至少3次以上。取材的血管必须冲净管腔内外表面的血迹,以免残存的红细胞及血液中某些因子影响内皮细胞的贴壁或生长。而外膜要尽量去除干净,但不易拉扯太猛,以免损伤内膜。经酶消化的分离细胞培养法,适用于较大管径的、内皮细胞产量大的血管,是使用最广泛的内皮细胞培养方法。但操作较复杂、技术要求较高。使用酶消化时,若是血管内膜面朝下盖在酶液上,则酶液用量不宜过多,能覆盖内膜面即可。若是将整条血管的内膜反转并将泡在酶液中时,应注意防止外膜外露,以免酶液进入外膜腔内而导致外膜被消化。在酶消化过程被终止后,可轻轻搓揉血管,有利于内皮细胞从管壁上脱落下来。
根据实验需要选择有利于内皮细胞贴壁生长的酶、酶的适宜浓度和消化时间。一般以0.125%的胰蛋白酶-0.02%EDTA混合消化液,或使用0.1%胶原酶溶液。初次使用酶消化内皮细胞时,应先测试出最佳的消化时间和酶液浓度,即可避免消化不足时内皮细胞不能脱落,也防止消化过度导致平滑肌细胞和成纤维细胞混入。掌握好酶液的消化时间是内皮细胞存活的关键,一般消化15~20min.在相差显微镜下观察,可见成团细胞片从内膜上掉下,成团的细胞则更易存活。
(2)排除成纤维细胞:如消化时间过长或操作不慎刮取过重时,会造成血管内皮下层与外膜成纤维细胞以及中膜平滑肌细胞污染。由于这些杂细胞生长较快,随着传代次数越多,其污染的程度越重,从而使培养失败。排除杂细胞的方法有:①细胞传代时,加入酶液之后,置显微镜下观察,1~2min即可见大部分内皮细胞收缩变圆,而杂细胞仍然贴壁。此时,立即加入小牛血清的培养液以终止酶的活性,然后将液体弃去,加新鲜培养液,用弯头吸管轻轻将细胞吹下来,接种于另一培养瓶中,如此2~3次,可得到较纯的内皮细胞(王培勇等,1995)。②使用含肝素的培养液(在培养液中加入90U/ml的肝素),可使内皮细胞纯度提高(Magee et al.1994)。③在相差显微镜下刮去明显的杂细胞群。
(3)培养液:应挑选优质血清,胎牛血清较小牛血清更好。一般原代培养用20%的血清,而传代培养用10%的血清。培养基可根据实验而定,以M199培养基最常用,pH7.2为宜。另外塑料培养瓶或皿较玻璃瓶更利于内皮细胞生长。换新鲜培养液时,每次换原培养液的1/2~2/3为好,残留的原培养液会缓解新培养液所带来的影响,易使内皮细胞适应新环境。
(4)传代培养:一般内皮细胞的传代比例是1∶2或1∶3,若需要单次传代,扩大体外培养规模时,可以1∶20以上的比例进行传代(何红兵等,1995),这样可在短期内获得大量的内皮细胞,同时避免因多次传代而造成的污染机会增加;此外,减少酶的作用次数防止细胞膜易损以及内皮细胞形态和生物学功能改变等问题的出现,但单次传代,扩大体外培养规模,须在培养液中加入内皮细胞生长因子(ECGF),只是该因子价格较昂贵。不同动物和不同血管来源的内皮细胞,不仅培养时性状表现不同,且对各种刺激反应也有很大的差别。兔血管的内皮细胞培养便可传代多达40~60代。由于内皮细胞培养的建立并不很难,加上内皮细胞经过多次传代后,其形态和生物学特性会有所改变,故不宜做长期传代培养。如实验需要可重复从原代建立培养。因此,一般不做冷冻和复苏处理。
二、人脐静脉内皮细胞的培养
【实验材料】
(1)材料来源:婴儿脐带。
(2)培养用液:M199培养液(含20%小牛血清)、D-Hanks液、0.1%胶原酶溶液、100U/ml青霉素和100μg/ml链霉素。
(3)培养器具:玻璃插管与输液胶管,培养瓶或培养皿,手术刀、剪、镊子等。
【操作步骤】
(1)在无菌条件下,取健康产妇分娩后新鲜的婴儿脐带(长20cm以上,不宜超过6h),选择无夹痕、无扭曲、无凝血阻塞的部分。
(2)在脐静脉两端开口处,分别用丝线扎紧并固定在50ml注射器和带输液胶管的玻璃插管上,注入D-Hanks液冲洗脐静脉,至无血迹。
(3)用止血钳夹住玻璃插管上的输液胶管,从另一端的注射器向脐静脉徐徐注入0.1%胶原酶溶液,至血管充盈。注意两端封闭,以防液体反流。立即放入37℃的无菌DHanks液内,15min后取出。
(4)通过注射器吸取收集酶液,同时注入含20%小牛血清的M199培养液冲洗静脉,合并于同一离心管内,以1 000r/min离心7~10min。
(5)弃去离心沉淀后的上清液。加入20%小牛血清的M199培养液(pH7.2),重新悬浮细胞,并调整至细胞密度为1.5×105~2.0×105个/ml,接种于培养瓶或培养皿中。置37℃、5%CO2培养箱培养。
(6)第二天弃培养液,用D-Hanks液轻轻洗1次,以去除不贴壁的细胞或死细胞。换入新鲜含20%小牛血清、100U/ml青霉素和100μg/ml链霉素的M199培养液(pH7.2)。继续置37℃、5%CO2培养箱培养。
(7)每2~3d换培养液1次。换液时将原培养液弃掉1/2~2/3,然后加入新鲜的上述培养液至原来的量。待细胞长至融合状态后,即可行传代培养。
【结果】 同猪主动脉内皮细胞的培养结果。
【讨论】 人脐带来源容易,培养效果亦好,但细胞不易生长,且传2~3代后细胞就开始衰退,最多可传6~7代,难以长期维持。一般人脐静脉内皮细胞体外培养20d左右是进行有关研究的较佳时期。
三、血管内皮细胞体外培养的调控
(一)脐带离体时间的影响
脐带取材方便,一般取正常妊娠足月分娩的新生儿无菌脐带,立即浸入4℃的培养液中,保存6h或更多时间会使细胞容易分离,但最好不超过24h;有研究表明,人脐静脉离体后,随着时间延长,内皮某些物质的含量会发生变化,脐静脉离体后6h内,Ⅷ因子相关抗原与抗凝血酶功能的变化比较平缓,单位面积内前列环素的生成量均随放置时间的延长而呈下降趋势,变化显著;还有研究表明,脐带离体时间与细胞存活率呈负相关,脐带离体后3h内,内皮细胞存活达到90%,离体24h尚有50%的存活细胞。
(二)不同消化酶的影响
目前,各种消化酶的应用已代替了机械刮取来获取人脐静脉内皮细胞,它们各有优缺点。用胶原酶消化的细胞最多,平均每根脐带可获取(2~5)×105个细胞,但有时混杂少量成纤维细胞;链丝菌蛋白酶消化获取的细胞数略少于胶原酶,但很少混杂成纤维细胞;胰蛋白酶对细胞有毒性作用,且消化获取的细胞数较少,不利于细胞生长,在脐静脉内皮细胞培养时,现普遍使用0.1%的胶原酶,pH值调至7.4,作用10~15min后停止消化;但在传代培养时普遍用胰酶处理,因为用胰酶处理后,可以降低非内皮细胞的贴壁能力,内皮细胞的贴壁比平滑肌细胞、外膜细胞和成纤维细胞早,所以可以去除在接种1h后仍未贴牢的细胞,而这些非内皮细胞的污染如不去除,将抑制内皮细胞的增殖。
(三)不同培养液及血清的影响
DMEM、M199、RPMI1640培养液皆可供脐静脉内皮细胞生常繁殖,有研究发现MEM、RPMI1640液促进内皮细胞生长繁殖的速率无明显差异;亦有人使用条件培养液,认为条件培养基中含有平滑肌细胞和外膜细胞的生长抑制因子,可以防止污染细胞的生长。培养液用于培养时必须辅加血清,否则细胞贴壁、伸展能力较弱,贴壁细胞繁殖速度慢,且以后多悬浮、死亡;血清的选择是很严格的,许多人认为胎牛血清效果较好,但盛民立等认为,最好使用人血清,如果没有,可用肝素抗凝的人血浆代替。Gajdusek等认为培养液中须加入一定浓度血清的原因可能是血液凝固过程中血小板聚集时所释放的各种生长因子有刺激内皮细胞生长的作用,尤其是血小板能够释放一种血小板衍生的生长因子(PDGF),促进内皮细胞的生长繁殖。
(四)血管内皮细胞生长因子(VEGF)的影响
VEGF的发现亦使脐静脉内皮细胞的传代培养有了很大的发展。VEGF是一类新发现的生长因子,其心血管效应有:①具有提高血管渗透性的作用,故又名血管渗透因子(VPF);②具有收缩血管的效应;③还有很强的促新生血管形成作用。在兔下肢缺血模型中、动脉注入或肌注方法给予VEGF,经血管造影术和组织学鉴定均有明显的侧支血管和毛细血管形成,对体外培养的血管内皮细胞有高效特异的促有丝分裂作用,在体内则可刺激血管的发生与生长。1990年,何红兵等即利用牛下丘脑中所含VEGF的粗提物,将脐静脉内皮细胞在体外进行长期传代培养,又提取并纯化了该因子,并成功地进行了脐静脉内皮细胞的单次传代,大规模培养。打破了1∶2的内皮细胞传代比例,15d内使细胞数量扩增了333倍,并保留了原代细胞的形态结构,保留了与原代细胞相似的对激素刺激的反应能力。
(五)传代的影响
传代亦对脐静脉内皮细胞产生很大的影响,传代培养的优点在于在原代培养中很难去除单核-巨噬细胞,而巨噬细胞可产生白介素I和肿瘤坏死因子以激活内皮细胞,并使它们改变性状。但是巨噬细胞不能传代,故当内皮细胞传至2~3代后,基本可以去除这种细胞。有研究表明。脐静脉内皮细胞体外培养后,对新的生存环境有一个适应过程,结果表现为细胞的形态及功能发生一定的变化,而且随着培养时间的延长,这种改变愈加明显。因此作者认为脐静脉内皮细胞在体外培养20d左右,细胞呈典型的棱形或鹅卵石状,所培养的细胞有较好的分泌前列环素及Von Wille brand因子的功能,是进行有关基础医学研究的较佳时期。
(六)排除污染
细菌、真菌、支原体污染细胞培养物较常见,不但造成培养基等生物制品的极大浪费,且受染后的细胞在生理、生化、遗传等方面都已发生变化,只得废弃;对于细菌、真菌污染,常预防性地加入青霉素、链霉素和两性霉素B于细胞培养物中,当然,培养基应已过滤除菌;而支原体的污染一直是困扰细胞培养工作者的问题,Roulland-Doussix检测各种细胞系,发现污染率为23%,而Kuppeveld发现污染率为55%。检测支原体污染的方法中,反转录PCR法、RFLPS(限制性片段长度多态)技术精确、灵敏,而培养法、DNA荧光染色法因简单、快速、准确而更为常用,支原体污染的清除仍是一个难题,目前仍推荐使用抗生素,如B-Mcycline、MRA、Ciprobey;对于血清中支原体污染的去除,常采用56℃加热灭活20min或通过孔径0.1μm的滤膜过滤的方法清除支原体。
(七)其他一些因素的影响
有文献报道肝素能增强内皮细胞生长因子对血管内皮细胞的增殖作用;Roseubaum发现肝素单独作用于内皮细胞,在低浓度血清培养(<10%)时,抑制内皮细胞生长,当血清浓度升高后,其阻止内皮增殖的作用消失;当肝素和VEGF同时加入培养液时,肝素可显著增强VEGF对内皮细胞的增殖作用。
此外,培养箱的二氧化碳浓度亦对培养发生影响,据报道,二氧化碳浓度变高,培养箱中猪脑血管内皮细胞产生花生四烯酸代谢产物的量亦在一定范围内增加;培养液的pH值、温度亦是影响细胞生长的重要因素。
总之,尽管因血管内皮细胞由于供体的年龄、性别、种属、来源器官及动脉抑或静脉等的不同,其特性有一定的差异,但它们仍有许多共同的特性,且其他方法取材较为困难,培养方法亦不很成熟,故人脐静脉内皮细胞的培养仍不失为一项重要的基本技术,随着该方法的日趋成熟,与血管内皮有关的许多基础医学研究必将得到进一步发展。
四、血管内皮细胞的鉴定
1.光镜检查 包括活细胞直接观察与染色观察两种方法:①在倒置显微镜或相差显微镜下,内皮细胞呈扁平的短梭形或多角形,内皮细胞大小均匀,胞核清晰,呈卵圆形;有核的区域较无核的区域突出,细胞呈单层“鹅卵石样”镶嵌状排列生长,并有接触性抑制现象;②在微孔滤膜上培养(方法见后)的内皮细胞,可通过处理滤膜,再经HE染色后观察(图4-16);③AgNO3染色:将内皮细胞接种在盖玻片或微孔滤膜上,D-Hanks液和双蒸水各清洗2次,滴加新配制1%AgNO3溶液,即倾去双蒸水清洗,紫外线照射5min,在苏木精复染细胞核。光镜观察到银颗粒沉淀在内皮细胞边缘,使内皮细胞呈现出典型的多边形,细胞间锯齿状镶嵌紧密排列。
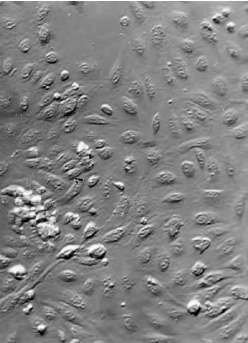
图4-16 倒置显微镜下观察原代培养的牛血管内皮细胞,细胞呈圆形或短梭形,单层生长(浮雕效果示细胞轮廓,× 100倍)
2.透射电镜检查 经固定、脱水、包埋、超薄切片、重金属染色后,透射电镜观察到内皮细胞具有Webel-Palade小体(W-P小体)的特征性细胞器,其外包单位膜的杆状细胞器,长约3μm,直径0.1~0.3μm,内有6~26条直径为15nm的平行细管。此外内皮细胞具有核大居中及微绒毛、吞饮小泡、细胞连接(尤其有大量紧密连接和部分缝隙连接)等特征。
3.第Ⅷ因子相关抗原的免疫组化检测(免疫酶ABC法或免疫荧光检测) 将内皮细胞接种在盖玻片上或微孔滤膜上,用免疫酶ABC法或免疫荧光方法染色,内皮细胞呈现细胞质中含棕色黄色的阳性反应物质(免疫酶ABC法),或核周胞质出现黄绿色的亮光环的阳性反应(图4-17,彩图15)。尽管某些种属的动物无W-P小体或由于电镜制作的问题而观察不到W-P小体,但由于内皮细胞的第Ⅷ因子相关抗原肯定存在,故Ⅷ因子相关抗原的免疫组化检测时间定内皮细胞的最有效方法。

图4-17 内皮细胞行Ⅷ因子抗原抗体染色,示明亮的黄绿色荧光,呈强阳性反应(×200倍)
(第四军医大学西京医院 熊 猛)
参 考 文 献
1Maciag T,Hoover GA,Stemerman MB,et al.Serial propagation of human endothelial cell in vitro.J Cell Biol,1981;91(2pt 1):420-426
2Masatsugu K,Itoh H,Chun TH,et al.Shear stress attenuates endothelin and endothelin-converting enzyme expression through oxidative stress.Regul Pept,2003;111(1-3):13-19
3Passerini AG,Milsted A,Rittgers SE.Shear stress magnitude and directionality modulate growth factor gene expression in preconditioned vascular endothelial cells.J Vasc Surg,2003;37(1):182-190
4Chen H,Wu L,Liu X,et al.Effects of laminar shear stress on IL-8mRNA expression in endothelial cells.Biorheology,2003;40(1-3):53-58
5Greisler HP,Johnson S,Joyce K,et al.The effects of shear stress on endothelial cell retention and function on expanded polytetrafluoethylene.Arch Surg,1990;125(11):1622-1625
6Brooks AR,Lelkes PI,Rubanyi GM.Gene expression profiling of human aortic endothelial cells exposed to disturbed flow and stready laminar flow.Physiol Genomics,2002;9(1):27-41
7Peng X,Haldar S,Deshpande S,et al.Wall stiffness suppresses Akt/e NOS and cytoprotection in pulse-perfused endothelium.Hypertension,2003;41(2):378-381
8Orlidge A,D’Amore PA.Inhibition of capillary endothelial cell growth by pericytes and smooth muscle cells.J Cell Biol,1987;105(3):1455-1462
9Jones PA.Construction of an artificial blood vessel wall from cultured endothelial and smooth muscle cells.Proc Natl Acad Sci USA,1979;76(4):1882-1886
10Davies PF,Kerr C.Co-cultivation of vascular endothelial and smooth cells using microcarrier techniques.Exp Cell Res,1982;141(2):455-459
11Saunders KB,D’Amore PA.An in vitro model for cell-cell interaction.In Vitro Cell Dev Biol,1992;28A(7/8):521-528
12Fillinger MF,Sampson LN,Gonenwett JL,et al.Co-culture of endothelial cells and smooth muscle cells in bilayer and conditioned media models.J Surg Res,1997;67(2):169-178
13Di Luozzo G,Bhargava J,Powell RJ.Vascular smooth muscle cell effect on endothelial cell endothelin-1production.J Vasc Surg,2000;31(4):781-789
14Imberti B,Seliktar D,Nerem RM.The reponse of endothelial cells to fluid shear stress using a co-culture model of the arterial wall.Endothelium,2002;9(1):11-23
15Vouyouka AG,Salib SS,Cala S,et al.Chronic high pressure potentiates the antiproliferative effect and abolisheds contractile phenotypic changes caused by endothelial cells in co-cultured smooth muscle cells.J Surg Res,2003;110(2):344-351
16Mosquera DA,Goldman M.Endothelial cell seeding.Br J Surg,1991;78(6):656
17 盛民立,陈思白,金立芳等 .血管内皮细胞培养及鉴定.上海医科大学学报,1987;14(1):71
18 唐 博,罗文军,严润彬,等 .肝细胞生长因子促血管内皮细胞增殖及迁移的研究 .重庆医科大学学报,2005;30(1):85-88
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















