皮肤作为人体最大的组织,是与外界环境接触的屏障。当由于外界损伤或疾病等因素造成皮肤缺损时(如烧伤),常常造成创面水分、电解质及蛋白质丢失,开放的创面还增加了感染的概率。早期、有效地封闭创面可以减少上述并发症的发生,临床上常用的是凡士林纱布和断层/全厚皮片,其中自体断层皮片移植是公认的标准疗法。但在大面积皮肤缺损患者,仍存在着供区不足及造成机体新的损伤等缺陷。因此,寻找一种理想的皮肤代用品一直是临床上一个急需解决的难题。
随着细胞生物学、材料学、生物化学、生物工程学、移植学的飞速发展,特别是近25年来,人们对表皮角质形成细胞的生物学特性、人工材料的加工与合成等有了更深入的认识,使在体外构建组织工程皮肤成为可能。组织工程化皮肤领域的研究一直是组织工程学的一个重点和热点,用组织工程技术构建的皮肤组织已有多种产品问世。考虑到皮肤的结构和功能特点,“理想”的组织工程化皮肤应具备以下特征:①能防止体液丢失;②有效阻止细菌入侵;③提供“现货供应”(off the shelf);④较长的储备时间;⑤无抗原性;⑥在创面持久存在;⑦一定的柔韧度;⑧容易获取,价格能为大多数人所接受;⑨随儿童的生长而生长;⑩应用方便,一次手术即可完成。
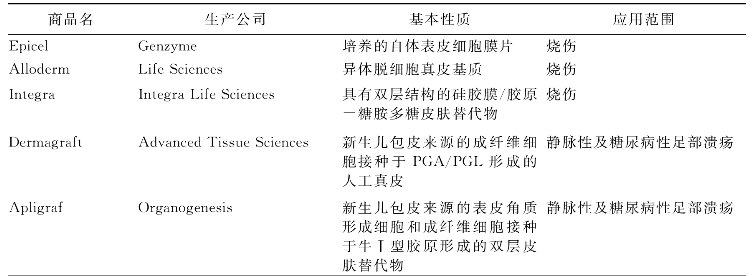
组织工程化皮肤按照不同的标准可分为:组织工程化表皮、组织工程化真皮和组织工程化复合皮肤;暂时性皮肤替代物、永久性皮肤替代物;生物性替代物和化学合成人工皮肤替代物等。几种商品化的组织工程皮肤产品见表15-1。
表15-1 商品化的组织工程皮肤产品
一、组织工程化表皮
创面的再上皮化是创伤愈合的重要指标。表皮可以减少体液丢失及降低感染的发生率,临床上,愈合时间超过3周的烧伤创面形成增生性瘢痕的概率很高,这主要是由于缺少表皮细胞对成纤维细胞的有效调控。
重建表皮的方法很多,从表皮细胞悬液移植到包含分化完善表皮层的全厚皮片移植。虽然硅胶膜很早就被用作临时性的表皮替代物,但永久的生物性修复仍有赖于具备活性的表皮角质形成细胞。
1975年,Rheinwald和Green以3T3细胞作为滋养层连续培养人类表皮角质形成细胞获得成功,其基本方法是用胰蛋白酶消化分离表皮角质形成细胞,以加有小牛血清、胰岛素、转铁蛋白、氢化可的松、表皮生长因子及霍乱毒素的培养基,经过培养得到平铺生长的表皮细胞,再经过传代扩增,得到大量表皮细胞。Green随即提出构想:培养的表皮角质形成细胞融合成片后可用于修复自体皮肤缺损。1981年,O′Connor等首次应用此方法在体外培养出适于移植的人自体表皮细胞膜片(cultured epidermal autograft,CEA),在2例烧伤患者的切痂后创面上,培养的表皮细胞膜片附着良好,观察到8周时仍可见到移植的细胞膜片。组织学也证实自体表皮细胞膜片覆盖全厚创面后,最终可形成分化完全的基底层、棘层、颗粒层及角质层,但生发层缺乏突起的棘状结构。Woodley等观察了4例烧伤后移植CEA患者的组织标本。发现其CEA下重建的基底膜结构都不完整,缺乏Ⅳ型胶原和锚着纤维。免疫荧光证实在CEA和真皮结合的部位有锚着纤维胶原(Ⅶ型胶原)存在,但未形成成熟的锚着纤维。
CEA移植技术的优点是可以应用极少量的自体标本获得大面积的永久性创面覆盖,而且细胞可以冻存备用。其缺点是获得表皮细胞膜片的周期较长,2~3周;且形成的膜片较脆弱,不易操作;创面接受率低;形成真皮不完整,新生真皮的形成需要数年。
1994年,Genzyme公司将培养的表皮细胞膜片商业化,注册商标为Epicel。Epicel一般用于烧伤面积占体表面积30%以上、累及真皮深层或全层的严重烧伤。这时缺损处丧失了再生表皮的能力,只能通过移植自体断层皮片来覆盖创面,而由于烧伤面积较大,存在着自体皮源不足的矛盾,移植CEA成为最佳选择之一。首先取患者少量健康皮肤在体外分离、培养、扩增自体表皮细胞,2~3周细胞融合成膜片后附着于凡士林纱布上,应用于烧伤创面。
因为自体表皮细胞膜片培养需要周期较长,许多研究者尝试培养异体表皮细胞膜片用于移植。排斥反应是异体移植必须考虑的问题。排斥反应的发生是因为主要组织相容性抗原存在所致,对于皮肤而言,免疫排斥反应主要与表皮中的郎格汉斯细胞有关,郎格汉斯细胞是上皮组织中能够激活免疫系统,正常表达HLA的惟一细胞。表皮细胞在传代培养过程中,郎格汉斯细胞逐渐丢失,因此新形成的上皮组织缺乏郎格汉斯细胞,表现为免疫惰性,故从理论上讲,培养的异体上皮组织能够为受体接受。1983年Hefton最先将异体表皮细胞膜片移植成功应用于临床,修复了3例通常需要移植自体断层皮片的严重烧伤创面。随后许多临床应用证实这种异体表皮细胞膜片的作用,受体接受率30%~100%。
该种异体表皮细胞膜片能够冷冻保存,不需患者活检标本,即可为临床提供即时可用的创面覆盖物,解决了自体表皮细胞膜片培养周期较长的缺点。但是这种表皮细胞膜片由于缺乏真皮,存在诸如:愈合后创面收缩严重、起水疱、易于溃破等缺点。
为了克服上述问题,学者们大致探索了两条途径:一是结合真皮替代物以形成复合皮;二是利用液态或固态细胞投递系统将亚融合状态(pre-confluent)的表皮细胞直接种植到创面,即由体外培养转到体内培养构建表皮。亚融合状态的表皮细胞保持着旺盛的增生能力,还没有因为细胞间接触抑制而降低活力。目前,用于研究或临床的细胞投递系统又分两种。第一种为各种合成或半合成的薄膜。如Kopp等应用Biobrane——一种外层为硅胶薄膜、内层由整合有牛Ⅰ型胶原颗粒的尼龙网组成的、长期以来在临床上被用作临时性敷料的双层膜状物;Rennekampff等应用Polyurethane,Myers等利用透明质酸膜等。Stark等试验了数种薄膜,包括人工真皮Integra,Laserskin(一种含有激光微孔的透明质酸膜)。发现这些薄膜在体外对细胞均无毒性,可以有效的作为底物支持表皮细胞的生长。细胞在特定的培养条件下,保持其旺盛的增殖潜能,待达到亚融合状态时,可以连同薄膜一起,无需酶消化过程,直接移植到创面。细胞贴附到创面后,可以从薄膜上移行到创面,继续增殖、分化以形成新生表皮。在此之前,薄膜继续留在创面,对细胞起到很好的保护作用。另一种细胞投递系统是由Hunyadi创用,Kaiser等完善并首先用于烧伤患者创面的纤维蛋白胶悬液(keratinocytes fibrin glue suspension,KFGS),主要是由血浆提取的纤维蛋白原和凝血酶组成,市售的纤维蛋白胶将两种成分分开包装,两者均为透明液体。可以利用其中之一将细胞制成悬液,然后用特制的注射器边推注边与另一种成分相混合,形成具有黏性的凝胶状物。焦向阳等用细胞标记的方法证明表皮细胞可以在这种凝胶中至少存活5d。表皮细胞的KFGS悬液涂布到创面后,细胞在这种网络状结构中继续增殖、移行,最后形成复层的分化良好的新生上皮。KFGS不仅为细胞的生长代谢和移行提供场所和支架,而且其中的一些成分,如纤维蛋白原、纤维连接素及Ⅷ因子等对细胞功能起到一定的促进作用。Stark利用这种方法临床应用10余例患者,证明可以有效封闭全厚创面。如果结合异体真皮,新生的皮肤组织的结构和功能更加接近正常。
二、组织工程化真皮
1.真皮在创面愈合中的重要作用 真皮(dermis)位于表皮和皮下脂肪组织之间。真皮的浅层——乳头层通过基底膜与表皮紧密相连,乳头层是由松散交织排列的胶原构成,真皮的深层——网状层较厚,由粗大、水平排列的胶原束构成。真皮中含有胶原纤维、弹力纤维、网状纤维和无定形基质,它的成纤维细胞合成所有这些纤维和基质,并可对它们进行分解代谢。真皮胶原组织坚韧而有弹性,占真皮成分的70%以上,起保护、维持内环境稳定,增强表皮外屏障的作用。真皮与表皮无论在结构上还是在功能上都是不可分割的有机整体。
在全层皮肤缺损,真皮层通过瘢痕增生来修复(repair)受损的真皮组织,而不像表皮的愈合是通过再生(regeneration)的方式。真皮层损伤越深,愈合后的瘢痕增生越重。因此,在皮肤移植中,真皮成分是很重要的。移植物中的真皮成分越多,创面愈合越快,而且愈合后创面质量明显改善,形成瘢痕少,创面收缩轻。临床上常采用经处理的天然真皮或人工合成材料替代真皮,不仅能加速创面愈合,减少皮肤收缩,而且能减少供区皮肤切取的厚度,加快供皮区愈合。经处理的天然真皮如Alloderm,人工合成材料有Integra、Biobrane、Dermagraft等。
2.几类组织工程化真皮替代物
(1)脱细胞真皮基质:尸体皮被用于皮肤缺损修复已有近百年的历史。1942年Brown和McDowell提出应用尸体皮作为烧伤后创面的应急的临时性覆盖物。他们同时指出由于免疫排斥尸体皮只能在创面存留3到10周,“如果有朝一日能有方法使异体皮片在创面存活,整形外科最大的难题将被攻克。”
1974年,Burke等第一次将免疫抑制疗法引入异体皮移植。尽管免疫抑制能使异体皮在烧伤后创面较长时间存活,但由于随之而来的感染、脓毒血症的巨大风险,使这种方法未能被大多数人所接受。
Gibson和Medawar在研究中发现,对异体皮片的排斥主要是针对表皮与真皮中的细胞成分,而真皮中的胶原等几乎没有任何免疫排斥反应。1964年,Grillo和McKhann用连续冻融法将真皮中的细胞成分杀死,然后将处理后的真皮覆盖皮肤缺损,10d后在其上覆盖自体断层薄皮片。结果证明这种真皮与创底结合良好,自体断层薄皮片亦成活。
在Grillo和McKhann的启发下脱细胞真皮基质(acellular dermal matrix)研究受到了许多学者的关注,脱细胞的方法也越来越完善。早期的脱细胞方法主要有反复冻融法、胰蛋白酶法等,但这些方法处理得到的脱细胞真皮基质免疫原性较强,移植于创面后被排斥的概率高。近年来发展的方法有NaCl-SDS法及Dispase-Triton法,Robert J.W的研究指出NaCl-SDS法制备的ADM较Dispase-Triton法制备的ADM保留了相对较多的细胞外基质成分(如laminin,Ⅳ、Ⅶ型胶原,纤维结合素等),更有利于细胞的黏附、生长,但同时与细胞相关抗原(如HLADR)的表达也相应增加。
AlloDerm是一种商品化的脱细胞真皮基质。新鲜尸体皮在1MNaCl中处理15h后撕去真皮,然后在室温下于0.5%SDS中连续振摇1h去除细胞成分,PBS清洗后,冻干保存备用。组织学检测见AlloDerm仍保持真皮层的正常结构,免疫组化染色表明基底膜的主要成分层粘连蛋白仍存在于脱细胞真皮基质表面。将脱细胞真皮基质应用在裸鼠和猪的全层皮肤缺损创面的结果证实脱细胞真皮基质能够在创面成活,诱导成纤维细胞长入、新生血管形成,能够支持移植于其表面的表皮角质形成细胞生长和迁移。将AlloDerm缝合在裸鼠背部的2cm×2cm的全厚皮肤缺损上,再在其表面接种一层培养的人表皮细胞膜片,术后21d可见分化良好的表皮层覆盖创面,且伤口收缩较单纯应用表皮细胞膜片的对照组明显缩小。复合移植Alloderm和自体表皮细胞膜片于患者烧伤后创面,CEA的接受率提高到95%。同单纯CEA移植比较,表皮钉突形成早。
(2)胶原-糖胺多糖(Integra):1980年,Yannas和Burke将从牛跟腱提取的Ⅰ型胶原和糖胺多糖(主要是6-硫酸软骨素)共价交联,再在其表面被覆一层薄的硅胶膜 (临时性的“表皮”)制成一种多孔状的皮肤替代物。
1996年由Integra Life Sciences公司制造的这种组织工程化皮肤(Integra被FDA批准应用于烧伤患者)。Integra呈多孔状结构,孔径(50±20)μm ,当植入创面后毛细血管及成纤维细胞可浸润生长形成新的真皮组织。上层硅胶膜的作用与表皮相当,可控制水分蒸发,防止细菌感染。它的主要特点是多孔洞性,且能在冻干交联的过程中,通过控制基质中冰晶的形态控制孔洞的大小。植入创面约2周后新的真皮组织形成,此时,揭去硅胶膜,再以薄的自体网状皮片或培养的自体表皮细胞膜片覆盖。临床试验表明,此种人工真皮可永久的修复创面,产生瘢痕少,伤口挛缩小,外形佳,异种牛胶原未引起明显免疫反应。
在一项回顾性研究中,121例应用Integra的烧伤患者无一例有严重增生性瘢痕形成,7%的患者有中度的增生性瘢痕,其余93%的患者无或仅有轻度瘢痕增生,其中63例患者有涉及关节活动部位的皮肤创伤,在应用Integra治疗后,患者的关节活动功能均良好。
Integra不包含有活性的细胞成分,无疾病传播的危险。但Integra仍有一些局限性,比如:Integra缺乏正常皮肤的免疫防御能力,对创面的要求较高,对出血、感染抵御能力差,必须加强移植后的日常监护,早期发现并处理感染区;其次,表层的硅胶膜在2周后仍需移植自体薄皮片覆盖创面,延长了患者的住院时间,增加了治疗费用。
(3)Dermagraft:Dermagraft是由Advanced Tissue Sciences公司生产的一种基于PGA/PGL的人工真皮。聚羟基乙酸(Polyglycolic acid,PGA)、聚羟基乙酸-共-乳酸(Polyglactin-910,PGL)是最常用的人工合成高分子可降解材料,外科用的可吸收缝线就是由聚羟基乙酸和(或)聚乳酸纤维编织而成。PGA、PGL已被用于多种组织的替代或再造。PGA、PGL炎性反应较轻,主要是通过水解而不是酶解的过程降解吸收,在皮下组织一般需60~90d完全吸收。
将从新生儿包皮中获取的成纤维细胞接种于PGA/PGL支架上,2周后,成纤维细胞大量增殖并分泌胶原、纤维连接蛋白、蛋白多糖、生长因子等,形成由成纤维细胞、细胞外基质和可降解生物材料构成的人工真皮。Dermagraft纤维连接素高水平表达并接近胎儿皮肤中的水平,这对于真皮替代品具有重要意义,纤维连接素具有促进上皮细胞的生长爬行,促进基底膜形成的作用。动物及临床试验显示该种人工真皮可以获得良好的创面黏附,血管化快。结合自体网状皮片移植,14d内可以获得创面的良好愈合。Dermagraft已经在临床上用于烧伤及慢性溃疡创面的治疗。研究表明,Dermagraft能有效减小创面收缩,促进接种于其上的表皮细胞膜片黏附、生长(基底膜分化良好,可见锚着细丝、层粘连蛋白等)。
(4)暂时性真皮替代物(Biobrane、Dermagraft-TC/Trancyte):Biobrane长期以来在临床上被用作一种临时性敷料来覆盖大面积烧伤创面。它是双层结构,外层是薄的硅胶膜,内层整合有大量的胶原颗粒,可以迅速与创面紧密贴附。Biobrane允许创面生理性液体蒸发,同时可防止蛋白等大分子物质丢失;Biobrane还可以有效减轻疼痛,促进表皮再生并减小脓毒血症发生的风险。
Dermagraft-TC是Advanced Tissue Sciences公司的一种人工真皮,它作为一种临时性敷料被用于烧伤创面。将新生儿成纤维细胞接种于人工合成敷料Biobrane上,成纤维细胞在Biobrane的胶原层黏附、扩增,分泌基质,外层的硅胶膜发挥着表皮的屏障作用。研究表明,Dermagraft-TC对烧伤创面的黏附情况以及随后植入其上的表皮细胞膜片的接受率均与尸体皮相似,并且没有免疫排斥反应的发生。
三、组织工程化复合皮肤
理想的组织工程化皮肤应包含表皮与真皮两层,因为无论在解剖上还是在功能上两者都是相互依存的整体。
1981年,Bell等将培养、扩增的SD大鼠成纤维细胞融铸于胶原网格中,胶原收缩后成为一种真皮类似物,5~7d后再在其表面种入未经培养的自体表皮细胞,这种人工复合皮肤被固定在供体鼠背部的开放创面上。表皮细胞植入后第4天,就可观察到胶原网格被表皮细胞部分覆盖,5周后可见多层分化的表皮细胞覆盖创面并且具有规整、光滑的基底层;移植后1周就有血管长入真皮层,7周时血管形成情况与周围组织无明显差别;术后50d,80%的移植物仍保持原来的大小和形状。这种人工皮肤类似物应该是第一种真正意义上的复合皮替代物(composite skin replacements)。
Apligraft(又称作Graftskin)是第一种商品化的既含有表皮层又含有真皮层的组织工程化皮肤,这种由Organogenesis公司注册生产的产品已在加拿大和美国获准用于临床治疗静脉性溃疡。将从新生儿包皮中获取的成纤维细胞溶于牛胶原中塑形,再在其表面接种新生儿表皮角质形成细胞。10d左右,表皮角质形成细胞融合成片,覆盖其下的“真皮层”。整个复合物随后被置于气—液界面以促使角朊细胞分化形成角质层。在一项临床研究中,Apligraft与传统治疗静脉性溃疡的压迫疗法相比较,6个月治愈率分别为63%和48.8%(P=0.012);平均愈合时间分别为61d和181d(P=0.003);对于超过6个月的难治性溃疡Apligraft治疗组愈合时间明显短于对照组(92d/190d,P=0.001)。
四、结 语
皮肤作为最先面市的组织工程化产品,有着极其巨大的社会和商业价值以及广阔的研究和临床应用前景。现有的几种组织工程化皮肤虽然在治疗烧伤及慢性溃疡上取得了长足进步,但无论在功能上还是在外形上仍有待于进一步改善。目前此领域的研究方向是:①选择与开发适于细胞生长的支架材料,进一步研究细胞与基质的相互作用。②基因转染技术的应用。暂时性皮肤替代物中如果包含能够选择性高效分泌特殊生长因子的皮肤细胞,不但可以提高创面修复质量,并且有可能促使永久性组织工程化皮肤的出现。③表皮干细胞。表皮干细胞具有无限分裂增殖能力,在皮肤组织的自我更新及维护机体自稳态中具有重要作用,随着对表皮干细胞的定位、表面标志及分化调控的深入研究,表皮干细胞有可能成为组织工程皮肤的种子细胞,从而构建出功能完善的皮肤替代物。④将黑色素细胞、郎格汉斯细胞引入皮肤构建等。
随着21世纪生命科学、材料科学以及诸多相关学科的飞速发展,在未来几年内,构建出一种理想的组织工程化皮肤(功能与外形近乎正常的人工皮肤)永久性替代物将不再仅仅是梦想。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















