WHO髓系肿瘤的诊断标准中将同时具有骨髓增殖和病态造血特征的患者归类于MDS/MPD,包括CMML、aCML、JMML和MDS/MPD-U。常见的染色体异常类似见于MDS,最常见的异常为+8和-7/7q-,-5/5q-发生率明显低于典型MDS。CMML的核型异常检出率较高,25%~35%的患者可发现存在异常,+8、7号染色体异常和复杂核型多见。JMML患者常见的重现性染色体异常为-7/7q-,见于6%~20%的患者,而且往往表现为单独的核型异常改变。由于染色体异常缺乏特征性,因此MDS/MPD患者进行核型分析的目的主要在于排除CML可能以及明确异常克隆的存在。
七、典型病例核型分析
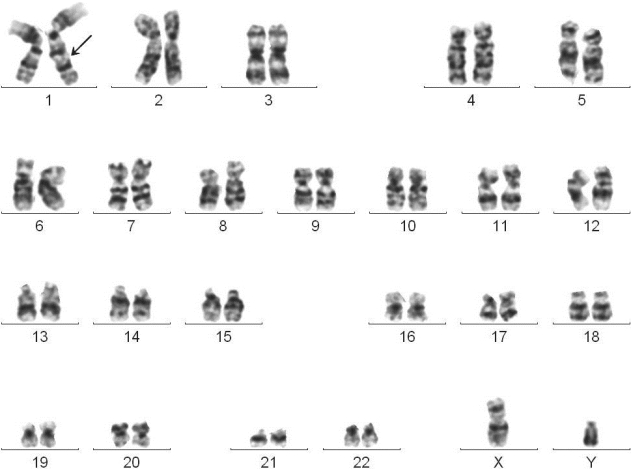
图4-1 慢性骨髓增殖性肿瘤G带核型
46,XY,dup(1)(q21q32)
临床诊断:原发性血小板增多症。
骨髓病理活检:骨髓增殖性疾病改变。
分子遗传学检测:BCR/ABL融合基因阴性,JAK2基因V617F突变阳性。

图4-2 慢性骨髓增殖性肿瘤G带核型
46,XX,der(6)t(1;6)(q21;p21)
临床诊断:嗜酸性细胞增多症。
分子遗传学检测:BCR/ABL融合基因阴性。
讨论:该异常被认为是骨髓纤维化特征性的染色体改变,大部分为原发性骨髓纤维化,小部分为继发于PV或ET的骨髓纤维化,中位生存时间为7.8年[2]。

图4-3 慢性骨髓增殖性肿瘤G带核型
46,XY,+1,der(1;7)(q10;p10)
临床诊断:MDS/MPD。
讨论:涉及1q的整臂间易位可累及其他各条常染色体,往往同时伴有1号染色体的复制,具体机制不明,最常见的为der(1;7)和der(1;16)。除常发生于血液系统恶性肿瘤外,非血液系统的实体肿瘤亦可发生。最常见于MDS/AML,其次是MM,偶见于ALL、CLL以及MPN。
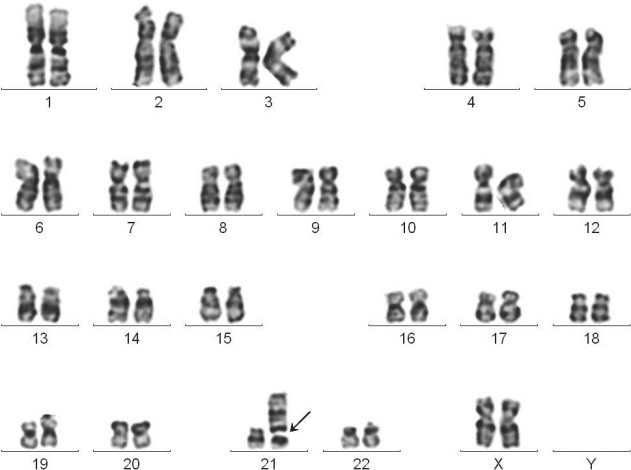
图4-4 慢性骨髓增殖性肿瘤G带核型
4
6,XX,+1,der(1;21)(q10;p10)
临床诊断:MPN。
分子遗传学检测:JAK2基因V617F突变阳性,BCR/ABL融合基因阴性。
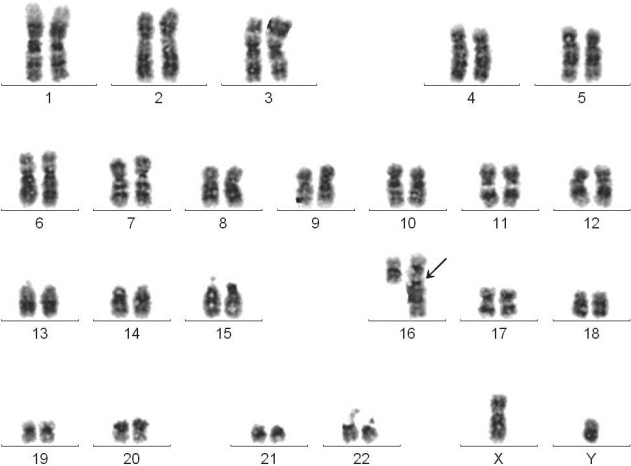
图4-5 慢性骨髓增殖性肿瘤G带核型
46,XY,der(16)t(1;16)(q12;q24)
临床诊断:MDS/MPD。
骨髓形态学检查:增生极度活跃,各阶段粒细胞均见增生,中晚幼比例增高,部分粒细胞可见颗粒增多增粗;巨核细胞数量增多,可见单圆及多圆核巨核细胞。
分子遗传学检测:JAK2基因V617F突变阴性,BCR/ABL融合基因阴性。

图4-6 慢性骨髓增殖性肿瘤G带核型
47,XY,+1,del(1)(p13)
临床诊断:MDS/MPD。
分子遗传学检测:JAK2基因V617F突变阴性,BCR/ABL融合基因阴性。
病历摘要:女性,5岁。发现白细胞增高2周。
骨髓形态学检查:有核细胞增生极度活跃,早幼粒细胞占15%,中晚幼粒细胞比例增高,粒系胞质中可见颗粒增粗,部分细胞可见核浆发育失衡,考虑MDS/MPD。
分子遗传学检测:BCR-ABL融合基因阴性。

图4-7 慢性骨髓增殖性肿瘤G带核型
46,XX,inv(3)(p21q29)
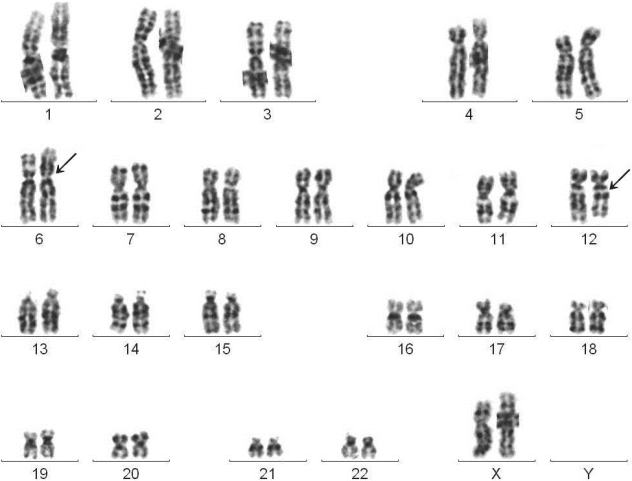
图4-8 慢性骨髓增殖性肿瘤G带核型
46,XX,t(6;12)(p11;q13)
临床诊断:MPN。
骨髓形态学检查:骨髓增生极度活跃,各阶段粒细胞均可见,比例均增高,可见粒细胞胞质内颗粒增多增粗,可见嗜酸、嗜碱性粒细胞;巨核细胞数量增多,血小板呈片状分布。
分子遗传学检测:JAK2基因V617F突变阳性,BCR/ABL融合基因阴性。
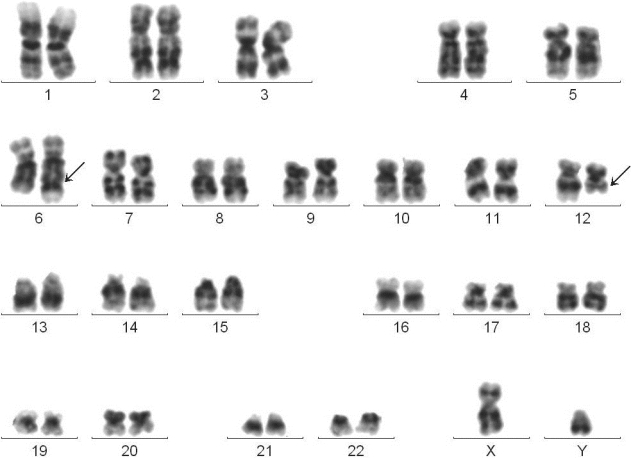
图4-9 慢性骨髓增殖性肿瘤G带核型
46,XY,t(6;12)(q25;q15)
诊断:原发性血小板增多症。
分子遗传学检测:BCL/ABL融合基因阴性,JAK2基因V617F突变阳性。
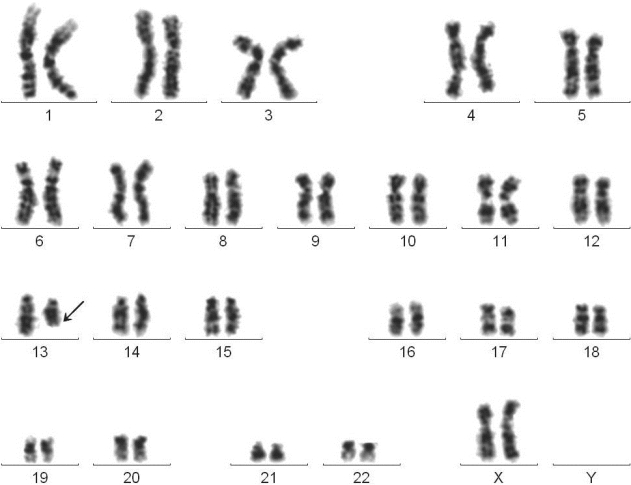
图4-10 慢性骨髓增殖性肿瘤G带核型
46,XX,del(13)(q14q22)
临床诊断:白细胞、血小板升高查因。
骨髓细胞形态学及骨髓活检提示骨髓纤维化改变。
分子生物学检测:BCL/ABL融合基因阴性,JAK2基因V617F突变阳性。讨论:在PMF患者中,单独13q-提示细胞遗传学预后较好。
参 考 文 献
[1] Dingli D, Schwager SM, Mesa RA, et al. Presence of unfavorable cytogenetic abnormalities is the strongest predictor of poor survival in secondary myelofibrosis.Cancer,2006,106:1985-1989
[2] Dingli D, Grand FH, Mahaffey V, et al. Der(6)t(1;6)(q21-23;p21.3): a specific cytogenetic abnormality in myelofibrosis with myeloid metaplasia.Br J Haematol,2005,130:229-232
[3] Hussein K1, Van Dyke DL, Tefferi A. Conventional cytogenetics in myelofibrosis:literature review and discussion.Eur J Haematol,2009,82:329-338
[4] Baxter EJ, Scott LM, Campbell PJ, et al. Acquired mutation of the tyrosine kinase JAK2 in human myeloproliferative disorders. Lancet,2005,365:1054-1061
[5] Scott LM, Tong W, Levine RL, et al. JAK2 exon12 mutations in polycythemia vera and idiopathic erythrocytosis. N Engl J Med,2007,356:459-468
[6] Pardanani AD, Levine RL, Lasho T, et al. MPLW515 mutations in myeloproliferative and other myeloid disorders: a study of 1182 patients.Blood,2006,108:3472-3476
[7] Nangalia J, Massie CE, Baxter EJ, et al. Somatic CALR mutations in myeloproliferative neoplasms with nonmutated JAK2.N Engl J Med,2013,369:2391-2405
[8] Rumi E, Pietra D, Ferretti V, et al.JAK2 or CALR mutation status defines subtypes of essential thrombocythemia with substantially different clinical course and outcomes.Blood, 2014, 123: 1544-1551
[9] Maxson JE, Gotlib J, Pollyea DA, et al. Oncogenic CSF3R mutations in chronic neutrophilic leukemia and atypical CML.N Engl J Med,2013,368:1781-1790
[10] Pardanani A, Lasho TL, Laborde RR, et al.CSF3R T618I is a highly prevalent and specific mutation in chronic neutrophilic leukemia.Leukemia,2013,27:1870-1873
[11] Vandenberghe P, Wlodarska I, Michaux L, et al. Clinical and molecular features of FIP1LI-PDGFRA(+) chronic eosinophilic leukemias. Leukemia,2004,18:734-742
[12] David M, Cross NC, Burgstaller S, et al. Durable responses to imatinib in patients with PDGFRB fusion gene-positive and BCR-ABL-negative chronic myeloproliferative disorders. Blood,2007,109:61-64
[13] Macdonald D, Reiter A, Cross NC. The 8p11 myeloproliferative syndrome:a distinct clinical entity caused by constitutive activation of FGFR1. Acta Haematol,2002,107:10 1-107
[14] Fioretos T, Panagopoulos I, Lassen C, et al. Fusion of the BCR and the fibroblast growth factor receptor-1 (FGFR1) genes as a result of t(8;22)(p11;q11) in a myeloproliferative disorder: the first fusion gene involving BCR but not ABL. Genes Chromosomes Cancer,2001,32:302-310
[15] Demiroglu A, Steer EJ, Heath C, et al. The t(8;22) in chronic myeloid leukemia fuses BCR to FGFR1: transforming activity and specific inhibition of FGFR1 fusion proteins.Blood, 2001, 98: 3778-3783
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















