一、核酸及蛋白质常用数据
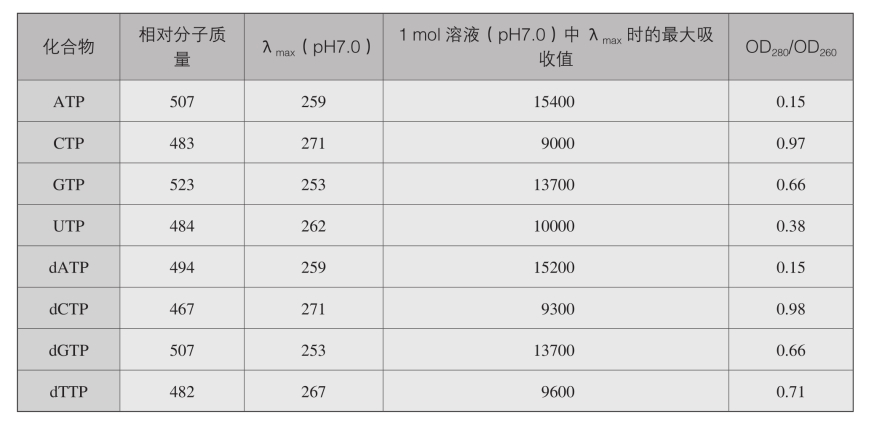
1.核苷三磷酸的物理常数
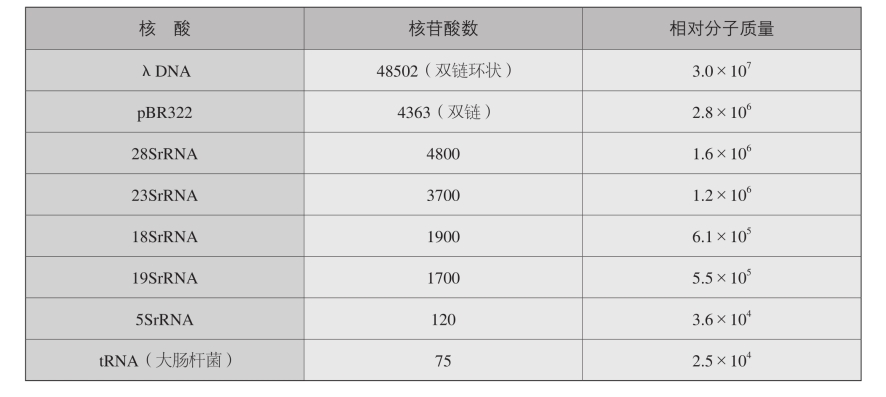
2.常用核酸的长度与相对分子质量
3.常用核酸蛋白换算数据
(1)质量换算:
1 μg=10-6 g 1 pg=10-12 g
1 ng=10-9 g 1 fg=10-15 g
(2)分光光度换算:
1A260双链DNA=50 μg/mL
1A260单链DNA=30 μg/mL
1A260单链RNA=40 μg/mL
(3)DNA物质的量换算:
1 μg 100 bp DNA=1.52 pmol=3.03 pmol末端
1 μg pBR32 DNA=0.36 pmol
1 pmol 1000 bp DNA=0.66 μg
1 pmol pBR322=2.8 μg
1 kb双链DNA(钠盐)=6.6×105 Dal
1 kb单链DNA(钠盐)=3.3×105 Dal
1 kb单链RNA(钠盐)=3.4×105 Dal
(4)蛋白物质的量换算:
100 pmol相对分子质量为100000蛋白质=10 μg
100 pmol相对分子质量为50000蛋白质=5 μg
100 pmol相对分子质量为10000蛋白质=1 μg
氨基酸的平均相对分子质量=126.7 Dal
(5)蛋白质/DNA换算:
1 kb DNA=333个氨基酸编码容量=3.7×104mW蛋白质
10000mW蛋白质=270 bp DNA
30000mW蛋白质=810 bp DNA
50000mW蛋白质=1.35 kb
100000mW蛋白质=2.7 kb DNA
二、常用缓冲液
1.分子克隆常用缓冲液
2.磷酸缓冲液
(1)25 ℃下0.1mol/L磷酸钾缓冲液的配制※

(2)25 ℃下0.1mol/L磷酸钠缓冲液的配制※
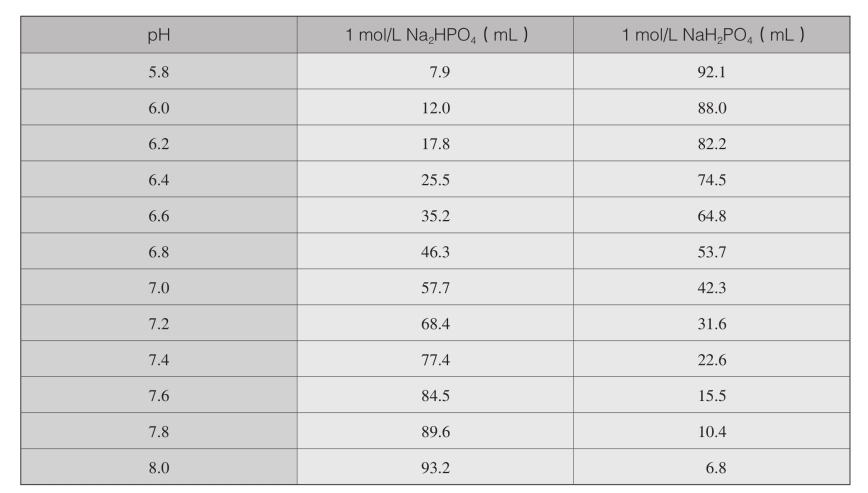
※:用蒸馏水将混合的两种1mol/L贮存液稀释至1000mL,根据Henderson-Hasselbalch方程计算其pH值:
pH=pK′+1 g([质子受体]/[质子供 体])
在此,pK′=6.86(25 ℃)。
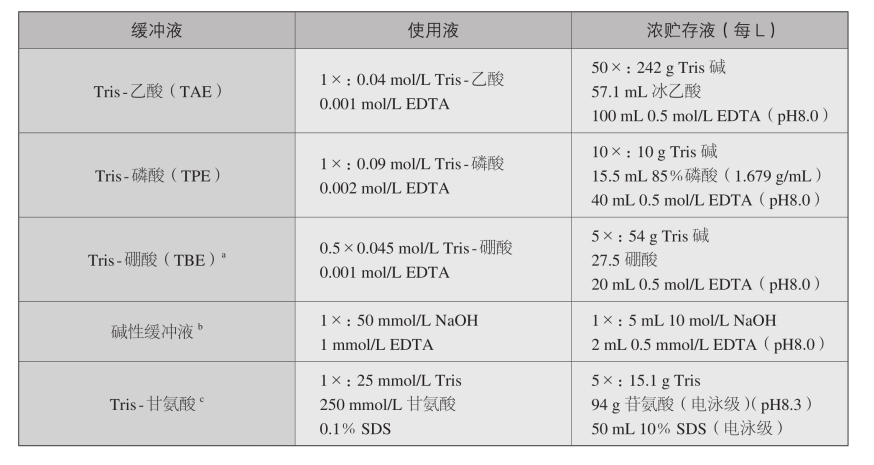
3.电泳缓冲液
常用的电泳缓冲液
说明:
① TBE溶液长时间存放后会形成沉淀物,为避免这一问题,可在室温下用玻璃瓶保存5×溶液,出现沉淀后则予以废 弃。
以片都以1×TBE作为使用液(即1 :5稀释浓贮液)进行琼脂糖凝胶电泳。但0.5×的使用液已具备足够的缓冲容量。目前几乎所有的琼脂糖胶电泳都以1 :10稀释的贮存液作为使用 液。
进行聚丙烯酰胺凝胶垂直槽的缓冲液槽较小,故通过缓冲液的电流量通常较大,需要使用1×TBE以提供足够的缓冲容量。
② 碱性电泳缓冲液应现用现配。
③ Tris-甘氨酸缓冲液用SDS聚丙烯酰胺凝胶电泳。
2×SDS凝胶加样缓冲液:
100mmol/L Tris·HCl(6.8)
200mmol/L二硫苏糖醇(DTT)
4%SDS(电泳级)
0.2%溴酚蓝
20%甘油
不含DTT的2×SDS凝胶加样缓冲液可保存于室温,应在临用前取1mol/L贮存液现加于上述缓冲液中。
4.凝胶加样缓冲液

续表
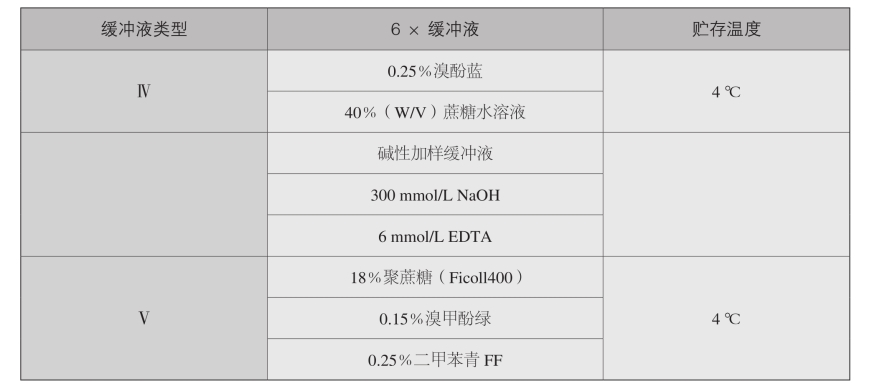
使用以上凝胶加样缓冲液的目的是:一是增大样品密度;二是确保DNA均匀进入样品孔内;三是使样品呈现颜色,从而使加样操作更为便利,含有在电块中能以可预知速率向阳极泳动的染料。溴酚蓝在琼脂糖中移动的速率约为二甲苯青FF的2.2倍,而与琼脂糖浓度无关。以0.5×TBF作电泳液时,溴酚蓝在琼脂糖中的泳动速率约与长300 bp的双链线状DNA相同,而二甲苯青FF的泳动则与长4 kb的双链线状DNA相同。在琼脂糖浓度为0.5%~1.4%的范围内,这些对应关系受凝胶浓度变化的影响并不显 著。
选用哪种加样染料均可。但是,对碱性凝胶应使用溴甲酚绿作为示踪染料,因为在碱性pH条件下其显色较溴酚更蓝更鲜明。
5.各种pH值的Tris缓冲液的配制
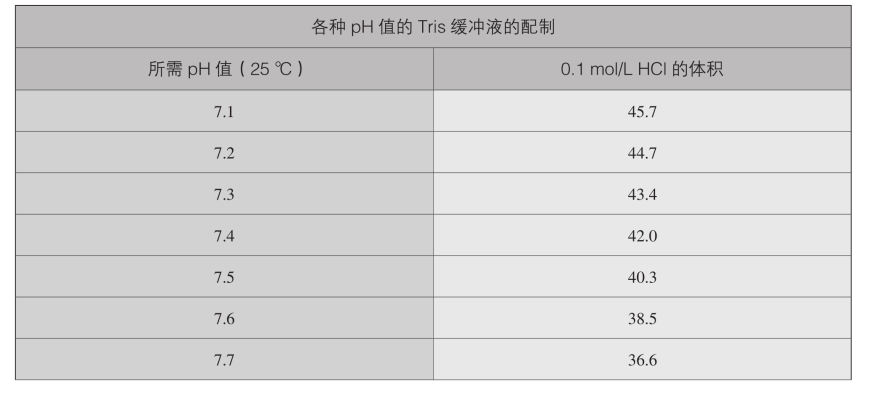
续表

某一特定pH值的0.05mol/L Tris缓冲液的配制:将50mL 0.1mol/L Tris碱溶液与上表所示相应体积(单位:mL)的0.1mol/L HCl混合,加水将体积调至100mL。
三、常用抗生素溶液
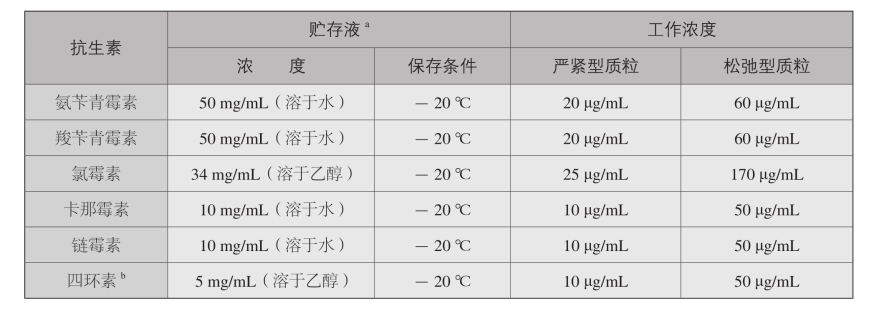
a:以水为溶剂的抗生素贮存液通过0.22 μm滤器过滤除菌。以乙醇为溶剂的抗生素溶液不需要除菌处理。所有抗生素溶液均应放于不透光的容器内保 存。
b:镁离子是四环素的拮抗剂,四环素抗性菌的筛选应使用不含镁盐的培养基(如LB培养基)。
四、常用贮存液的配制
1mol/L CaCl2溶液
【配制方法】
在200mL蒸馏水中溶解54 g CaCl2·6H2O,用0.22 μm滤器过滤除菌,分装成10mL小份贮存于-20 ℃。
【注意】制备感受态细胞时,取出一小份解冻并用蒸馏水稀释至100mL,用Nalgene滤器(0.45 μm孔径)过滤除菌,然后骤冷至0 ℃。
2.5mol/L CaCl2溶液
【配制方法】
在20mL蒸馏水中溶解13.5 g CaCl2·6H2O,用0.22 μm滤器过滤除菌,分装成1mL小份贮存于-20 ℃。
脱氧核苷三磷酸(dNTP)溶液
【配制方法】
把每一种dNTP溶解于水至浓度各为100mmol/L,用微量移液器吸取0.05mol/L Tris碱分别调节每一dNTP溶液的pH为7.0(用pH试纸检测),把中和后的每种dNTP溶液各取一份适当稀释成终浓度为50mmol/L的dNTP,分装成小份贮存于-70 ℃。
0.5mol/L EDTA(pH8.0)溶液
【配制方法】
在800mL水中加入186.1 g二水乙二胺四乙酸二钠(EDTA-Na·2H2O),用磁力搅拌器进行剧烈搅拌,用NaOH调节溶液的pH值至8.0(约需20 g NaOH颗粒)然后定容至1 L,分装后高压灭菌备用。
【注意】EDTA二钠盐需加入NaOH将溶液的pH值调至接近8.0,才能完全溶 解。
IPTG溶液
【配制方法】
IPTG为异丙基硫代-β-D-半乳糖苷(相对分子质量为238.3),在8mL蒸馏水中溶解2 g IPTG后,用蒸馏水定容至10mL,用0.22 μm滤器过滤除菌,分装成1mL小份贮存于-20 ℃。
1mol/LmgCl2溶液
【配制方法】
在800mL水中溶解203.4 gmgCl2·6H2O,用水定容至1 L,分装成小份并高压灭菌备用。
【注意】MgCl2极易潮解,应选购小瓶(如100 g)试剂,启用新瓶后勿长期存 放。
β-巯基乙醇(BME)溶液
【配制方法】
一般得到的是14.4mol/L溶液,应装在棕色瓶中保存于4 ℃。
【注意】BME或含有BME的溶液不能高压处理。
酚的氯仿溶液
【配制方法】
把酚和氯仿等体积混合后用0.1mol/L Tris·HCl(pH7.6)抽提几次以平衡这一混合物,置于棕色玻璃瓶中,上面覆盖等体积的0.01mol/L Tris·HCl(pH7.6)液层,保存于4 ℃。
【注意】酚腐蚀性很强,并可引起严重灼伤,操作时应戴手套及防护镜,穿防护服。所有操作均应在化学通风橱中进行。与酚接触过的皮肤部位应用大量水清洗,并用肥皂和水洗涤。
1mol/L乙酸钾(pH7.5)溶液
【配制方法】
将9.82 g乙酸钾溶解于90mL纯水中,用2mol/L乙酸调节pH值至7.5后加入纯水定容到1 L,保存于-20 ℃。
乙酸钾溶液(用于碱裂解)
【配制方 法】
在60mL 5mol/L乙酸钾溶液中加入11.5mL冰乙酸和28.5mL水,即成钾浓度为3mol/L,而乙酸根浓度为5mol/L的溶液。
3mol/L乙酸钠(pH5.2和pH7.0)溶液
【配制方法】
在80mL水中溶解408.1 g三水乙酸钠,用冰乙酸调节pH值至5.2或用稀乙酸调节pH值至7.0,加水定容到1 L,分装后高压灭 菌。
5mol/L NaCl溶液
【配制方法】
在800mL水中溶解292.2 g NaCl加水定容至1 L,分装后高压灭菌。
10%十二烷基硫酸钠(SDS)溶液
【配制方法】
在900mL水中溶解100 g电泳级SDS,加热至68 ℃助溶,加入几滴浓盐酸调节溶液的pH值至7.2,加水定容至1 L,分装备用。
【注意】
SDS的微细晶粒易扩散,因此称量时要戴面罩,称量完毕后要清除残留在称量工作区和天平上的SDS,10%SDS溶液无须灭菌。
1mol/L Tris溶液
【配制方法】
在800mL水中溶解121.91 g Tris碱,加入浓HCl调节pH值至所需值。
pH HCl
7.4 70mL
7.6 60mL
8.0 42mL
应使溶液冷却至室温后方可最后调定pH值,加水定容至1 L,分装后高压灭菌。
【注意】如1mol/L溶液呈黄色,应重新制备质量更好的Tris。
Tris溶液的pH值因温度而异,温度每升高1 ℃,pH值大约降低0.03个单位。例如,0.05mol/L的溶液在5 ℃、25 ℃和37 ℃时的pH值分别为9.5、8.9和8.6。
X-gal溶液
【配制方法】
X-gal为5-溴-4-氯-3-吲哚-β-D半乳糖苷。用二基甲酰胺溶解X-gal配制成的20mg/mL的贮存液。保存于玻璃管或聚丙烯管中,装有X-gal溶液的试管须用铝箔封裹以免因受光照而被破坏,应贮存于-20 ℃。X-gal溶液不需要过滤除菌。
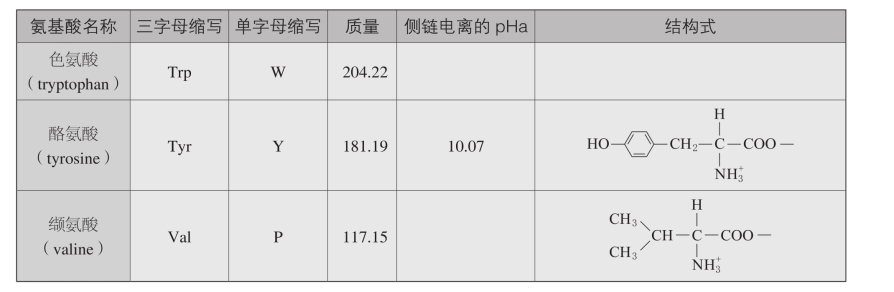
五、氨基酸的特性
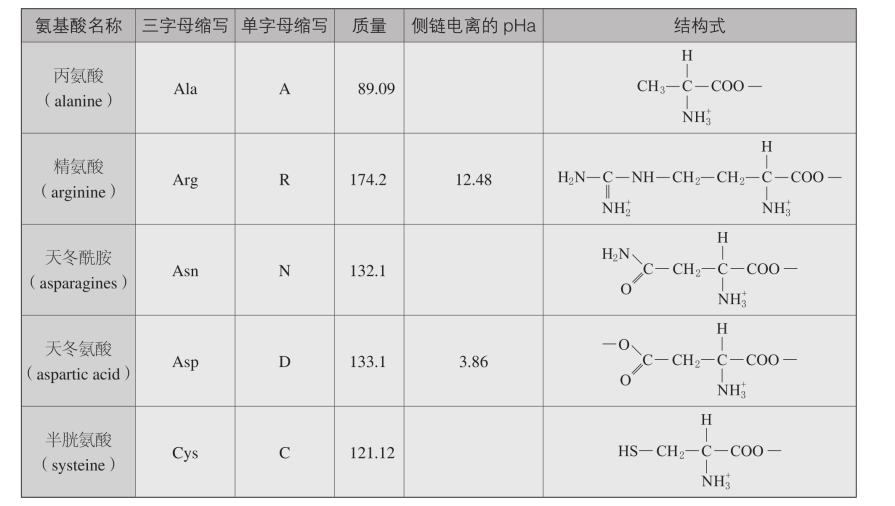
续表

续表
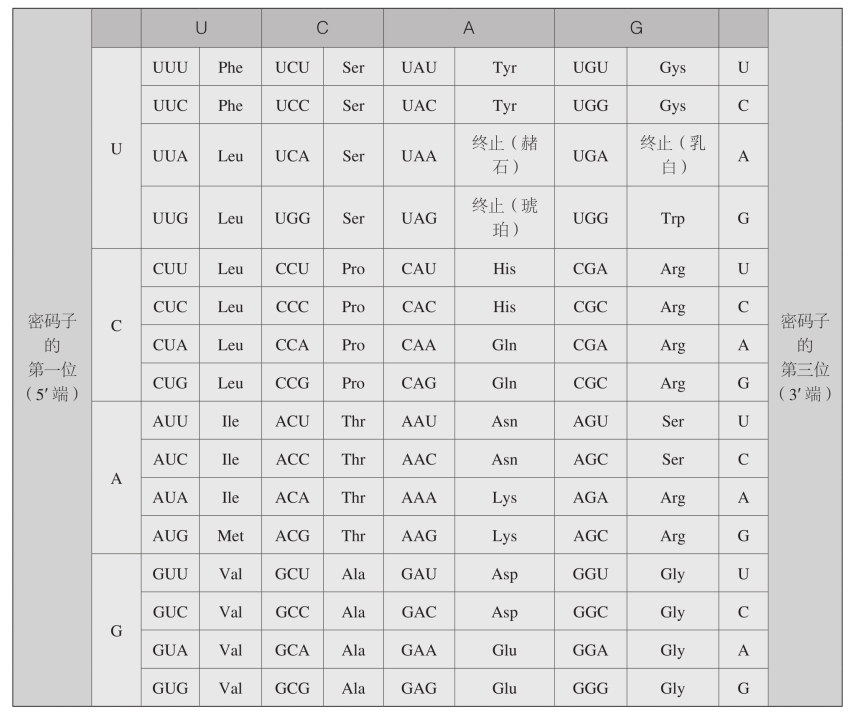
六、遗传密码
密码子的第二位
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














