真核生物基因组的活性主要取决于核小体,不仅因为核小体定位在DNA链上,还因为核小体内组蛋白的精确化学结构是决定一段染色质包装程度的主要决定因素。
(一)组蛋白乙酰化的影响
组蛋白可进行不同类型的修饰,其中研究最为深入的是组蛋白乙酰化(histone acetylation)修饰,即每个核心组蛋白N端的赖氨酸连上乙酰基因(图2-11)。
这些经过修饰的N末端从核小体核心八聚体(图2-12)伸出突出的尾,它们的乙酰化使组蛋白对DNA的亲和力降低,同时使30nm染色质纤丝变得不稳定,降低了核小体之间的相互作用。异染色质中的组蛋白一般不被乙酰化,而功能域中的组蛋白常被乙酰化,这些清楚地表明这种类型的修饰与DNA包装相关。
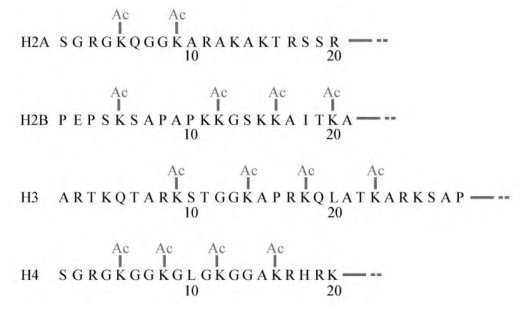
图2-11 四个核心组蛋白N端区域上结合乙酰基(Ac)的位置(每个序列开始于N端的氨基酸)
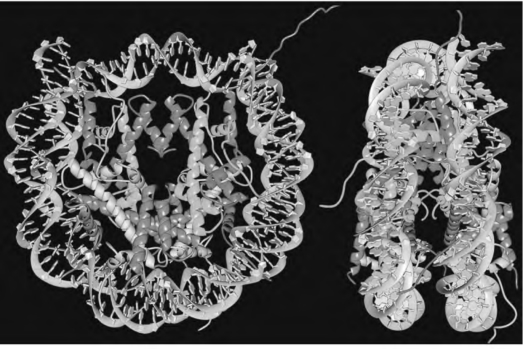
图2-12 核小体核心八聚体的两种观察结果
左边的视图是从桶状八聚体的顶部往下看,右边的视图是从侧面看。八聚体包含中间两个组蛋白H3和两个组蛋白H4亚基组成四聚体,它们上、下方为一对H2A和H2B。注意从核心八聚体伸出的组蛋白N端尾部
组蛋白乙酰化与基因组表达的相关性于1996年被发现,当时经过几年的努力,人们终于首次分离出了催化组蛋白添加乙酰基的酶,即组蛋白乙酰转移酶(histone acetyltransferases,HATs)。当时已经知道对基因表达有重要影响的一些蛋白质具有HAT活性。例如,首先被发现的HATs之一,即被称为p55的四膜虫蛋白,与酵母蛋白GCN5具有同源性,而GCN5已知可以激活转录起始复合物的装配。类似的,哺乳动物中一种叫做p300/CBP的蛋白在多个基因的激活中都有作用,它是一种组蛋白乙酰转移酶。这些现象以及不同类型的细胞具有不同的组蛋白乙酰化方式都表明,组蛋白乙酰化在基因组表达调控中起着重要作用。
单独的HATs可以在试管中乙酰化组蛋白,但在完整的核小体中不具备活性,这表明在核中HATs几乎不能独立工作,而是形成多蛋白复合物。例如,酵母SAGA和ADA复合物,人类TFTC复合物。这些复合物是典型的大分子多蛋白质结构,在基因组表达中催化和调节多个步骤。比如说SAGA,包含了至少15个蛋白质,总分子量约180万,大小约18nm× 28nm,而核小体八聚体加上DNA仅11nm×13nm,也就是说它比核小体还要大,和30nm染色质纤丝相当了。SAGA复合物包括一系列与TATA结合蛋白(TBP)相关的蛋白,像具有HAT活性的GCN5,在起始基因表达过程中起作用,5个TBP相关因子辅助TBP行使其功能。SAGA和其他HAT复合物都非常复杂,在这些复合物中很多蛋白在基因表达起始过程中发挥着各自的作用,说明在基因活化的整个过程中,各个单独的事件都是紧密连接的,组蛋白乙酰化是一个完整的部分,却也只是整个过程的部分。
HAT蛋白至少有5个不同的家族。GCN5相关的乙酰化酶,或者GCNTs,都是SAGA,ADA和TFTC的组成成分,它们都和基因转录活化相关,同时也参与损伤DNA的修复,尤其是紫外照射引起的双链缺损的修复。另外一类HAT,称之为MYST,得名于其同家族的4个蛋白首字母,它们同样参与了转录激活和DNA修复,也被揭示参与细胞周期的调控,只不过这可能反映DNA修复功能的另一方面,因为基因组广泛受损的时候,细胞周期会停滞。不同的复合物乙酰化不同组蛋白,并且一些复合体可以乙酰化与基因表达相关的其他蛋白,例如通用转录因子TFⅡE和TFⅡF。因此,HATs蛋白功能多样,参与了基因组的表达、复制和维持。
(二)组蛋白去乙酰化的抑制作用
基因活化应该是可逆的,否则被活化的基因将始终保持激活状态。因此,存在一套能去除组蛋白末端的乙酰基团的酶也就不奇怪了,由此来逆转上述的HATs的转录激活效应。这是组蛋白去乙酰化酶(histone deacetylases)(HDACs)的功能。HDAC活性和基因沉默之间的联系建立于1996年,此间第一个被发现的哺乳动物HDAC与酵母转录抑制因子Rpd3蛋白存在相关性。正如乙酰化与基因活化的关系一样,去乙酰化与基因沉默也同样存在相关性。人们早先认为这两类蛋白具有不同活性,原来实际上是相关的。这些是在基因和蛋白质功能研究中体现出同源分析价值的优秀范例。
像HATs一样,HDACs被包含在多蛋白复合体中。哺乳动物Sin3复合体是一种至少7种蛋白质组成的复合体,包括HDAC1和HDAC2及其他无去乙酰化活性但对此过程提供了必要辅助功能的蛋白质。辅助蛋白质如Sin3复合体成员RbAp46和RbAp48,它们被认为有助于结合组蛋白。对RbAp46和RbAp48最初的认识来自于其与视网膜母细胞瘤蛋白的结合。视网膜母细胞瘤蛋白通过抑制多种不同基因的表达调控细胞增殖,直到需要这些基因的活性时才解除抑制,而在突变时则导致癌症。Sin3和这个与癌症相关蛋白之间的联系强有力地证明了基因沉默中去乙酰化反应的重要性。在哺乳动物中其他去乙酰化复合体包括NuRD,通过一系列的辅助蛋白质与HDAC1和HDAC2结合;而酵母Sir2与其他HDACs不同,因为它需要能量。Sir2的特性表明HDACs实际上比以前认识到的更为多样化,可能组蛋白去乙酰化酶还有其他新功能有待发掘。
对HDAC复合体的研究开始揭示了基因组活化与沉默不同机制之间的联系。Sin3与 NuRD复合体中都含有甲基化DNA结合蛋白,并且NuRD包含与核小体重塑复合物Swi/Snf组分非常相似的蛋白质。NuRD实际上被认为是经典的体外核小体重塑器。进一步的研究必将揭示不同类型的染色体修饰系统之间的其他联系,但实际上这些系统可能仅是一个单一的宏大体系的不同部分。
(三)组蛋白其他修饰方式
赖氨酸的乙酰化和去乙酰化是研究最为深入的组蛋白修饰方式,但绝不是唯一的类型。已知还有其他三类的共价修饰方式:①组蛋白H3、H4的N端赖氨酸和精氨酸残基的甲基化。原来认为甲基化都是不可逆的,因此会造成染色质结构的永久性改变。随着赖氨酸和精氨酸去甲基化酶的发现,这种观点受到了挑战,但总的来说,甲基化修饰还是相对长期的。②H2A、H2B、H3、H4的N端的丝氨酸磷酸化。③H2A和H2B的C末端赖氨酸的泛素化,就是将常见的叫做泛素的小分子或称为SUMO的蛋白加到赖氨酸上。
像乙酰化一样,这些修饰方式也可以影响染色质结构并对细胞活性具有重要影响。例如,组蛋白H3及组蛋白H1的磷酸化也与中期染色体的形成相关,并且组蛋白H2B的泛素化是泛素调控细胞周期功能的部分体现。组蛋白H3的N末端第4与第9位赖氨酸残基的甲基化效应尤其有趣。第9位赖氨酸的甲基化形成一个HP1蛋白的结合位点,而HP1蛋白可引发染色质包装并使基因表达沉默,但在第4位赖氨酸加上两个或三个甲基之后,其效应却是相反的,它可促进形成开放的染色质结构,促进基因活化。在β珠蛋白功能域及其他可能位置,第4位赖氨酸的甲基化排斥NuRD去乙酰化酶,使其不能与组蛋白H3结合,确保组蛋白保持乙酰化状态。因此第4位赖氨酸甲基化和组蛋白乙酰化这两种修饰类型可能协同作用活化染色质区域。
总的来说,4个核心组蛋白N端和C端共有29个位点可以被共价修饰(图2-13)。目前我们对不同组蛋白修饰及不同修饰类型共同作用途径的认识在增长,这提示我们存在一个组蛋白密码(histone code),即通过它们化学修饰的形式来确定特定的基因组区域在特定时间被表达,还决定了基因组生物学的其他方面,如损伤位点的修复、基因组复制和细胞周期的协调等。尽管这个概念还有待证实,但很明确的是,基因组内的特异组蛋白修饰的形式与基因活性是紧密相关的。比如,对人第21、22号染色体的研究发现,在这些染色体上发生H3第4位赖氨酸三甲基化以及第9、第14位赖氨酸乙酰化的区域正好对应着活化基因的转录起始位点(图2-14)。至于研究染色质修饰的各方面,一个关键的问题是要分清因果关系:组蛋白修饰的形式决定了特定基因的活化,或者仅仅是基因活化的副产物。
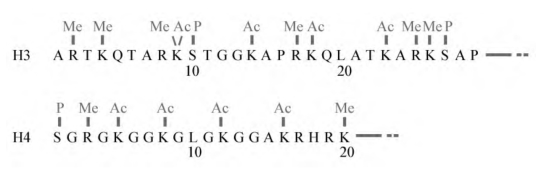
图2-13 哺乳动物组蛋白H3、H4的N端修饰
Ac为乙酰化;Me为甲基化;P为磷酸化
如图2-14显示的是人第21、22号染色体的片段,每段100kb。肺成纤维细胞中,相对已知基因的富含第4位赖氨酸双甲基化、三甲基化和第9、14位赖氨酸乙酰化的区域被标识。图中箭头指示了基因转录的方向。
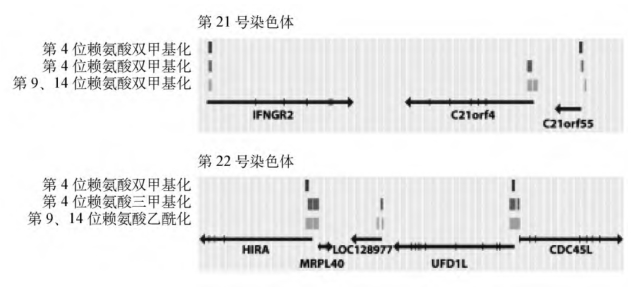
图2-14 组蛋白修饰的形式与基因活性的关系
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















