(一)酸和碱的解离平衡常数
酸(HB)与H2O的质子传递反应,生成B-和H3O+,达到平衡后反应物和产物的浓度都不变,则有:
![]()
这是HB与水的质子传递平衡。达到平衡时,产物浓度的乘积与反应物浓度的乘积之比则为其质子传递平衡常数,即:
![]()
在稀溶液中,[H2O]可看成是常数,上式改写为:
![]()
Ka称为酸的解离平衡常数,简称酸常数。在一定温度下,其值一定。一些弱酸的Ka非常小,为使用方便,也常用pKa表示酸的解离平衡常数的负对数,即:pKa=-lgKa。
Ka的大小表示酸在水中释放质子能力的大小。Ka越大,表示酸在水中释放质子能力的大小越强,形成的H3O+越多,即酸性越强。例如,HAc、![]() 和HCN的Ka分别为:1.74×10-5、5.59×10-10和6.16×10-10,所以这3种酸的强弱顺序为:HAc>HCN>
和HCN的Ka分别为:1.74×10-5、5.59×10-10和6.16×10-10,所以这3种酸的强弱顺序为:HAc>HCN>![]() 。Ka>10时为强酸,如HCl、HClO4、HNO3、H2SO4等都是强酸。Ka与溶液浓度无关。
。Ka>10时为强酸,如HCl、HClO4、HNO3、H2SO4等都是强酸。Ka与溶液浓度无关。
同理,一元弱碱B-在水溶液中的质子传递平衡通式:

Kb为碱的解离平衡常数,简称碱常数。在一定温度下,Kb是定值。Kb的大小表示碱在水中接受质子能力的大小。Kb越大,说明该碱在水中接受质子能力越大,形成的OH-越多,即碱性越强。Kb与溶液浓度无关。pKb是碱的解离平衡常数的负对数。
(二)共轭酸碱解离平衡常数的关系
酸的解离平衡常数Ka与其共轭碱的解离平衡常数Kb之间有确定的对应关系。
如,酸的质子传递平衡:![]()
![]()
其共轭碱的质子传递平衡:
![]()

Ka×Kb=Kw,Ka与Kb成反比,这说明酸越弱,其共轭碱越强;碱越弱,其共轭酸越强;若已知酸的解离平衡常数Ka,就可求出其共轭碱的解离平衡常数Kb。应用Ka×Kb=Kw求酸、碱的Ka或Kb。如:

多元弱酸和多元弱碱在水中的质子传递反应都是分步进行的。例如:H3PO4的质子传递分3步进行,每一步都有相应的质子传递平衡。
H3PO4、H2![]() 都是酸,因为Ka1>Ka2>Ka3,故酸的强度H3PO4>H2
都是酸,因为Ka1>Ka2>Ka3,故酸的强度H3PO4>H2![]() >
>![]() ;多元弱酸一般都是Ka1>Ka2>Ka3,即第二级、第三级解离很弱,可以忽略。在比较多元酸强度时可以只比较Ka1的大小。
;多元弱酸一般都是Ka1>Ka2>Ka3,即第二级、第三级解离很弱,可以忽略。在比较多元酸强度时可以只比较Ka1的大小。
以上酸的共轭碱分别为![]()
![]() 、
、![]() ;酸的Ka越大,其共轭碱的Kb就越小,故H3PO4的各级共轭碱的强弱顺序为
;酸的Ka越大,其共轭碱的Kb就越小,故H3PO4的各级共轭碱的强弱顺序为![]() 。各级共轭碱的质子传递平衡为:
。各级共轭碱的质子传递平衡为:
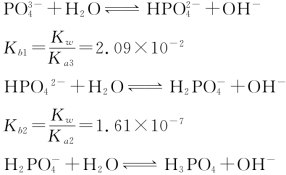
Kb3=![]() =1.44×10-12可见,Kb1>Kb2>Kb3因此,在比较多元弱碱强弱时,也可只比较Kb1。
=1.44×10-12可见,Kb1>Kb2>Kb3因此,在比较多元弱碱强弱时,也可只比较Kb1。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















