(一)实验目的与主要原理
DNA存在于细胞核中。通过裂解组织和细胞,使细胞膜破碎,暴露出DNA与蛋白质的混合物。此时,通过蛋白酶的消化,使DNA与蛋白质进行分离,而后利用硅胶柱或者酚:氯仿法,去除蛋白质,从而获取高纯度DNA。
(二)实验材料
蛋白酶K(20mg/mL),裂解液(100mmol/LTris(pH8.0),500mmol/LEDTA(pH8.0),20mmol/LNaCl,10%SDS),硅胶柱,TE(10mmol/LTris-HCl,1mmol/LEDTA(pH8.0),0.5×TAE(20mmol/LTris-乙酸,0.5mmol/LEDTA,pH8.0),10×Loadingbuffer(50mmol/LEDTA,60%甘油,0.25%溴酚蓝,pH7.0)。
(三)实验方法
DNA提取的方法目前主要有两种,一种是利用酚∶氯仿抽提的方法,另一种是利用硅胶柱吸附的方法。其中酚∶氯仿抽提法由于试剂具有较强的腐蚀性和毒性,且对环境污染较大,目前使用者较少。而硅胶柱的方法操作比较简单,且毒性很低,对环境的影响较少,故而被广大实验者所使用。目前硅胶柱的生产厂家较多,以沉淀方法较为多见,主要步骤如下。
1.样本前处理
(1)对于贴壁细胞,用胰蛋白酶或其他方法收集细胞,对于悬浮细胞,直接收集细胞。用PBS洗3次。
(2)加入3倍体积的裂解液,加入蛋白酶K终浓度达到500μg/ml,37℃孵育4~6h。
动物组织:提前准备55℃,70℃水浴。
(1)将25mg动物组织切碎,置于一无菌的1.5ml离心管中(注意,尽量越碎越好)。
(2)加入150~200μl的裂解液(含500μg/ml的蛋白酶K),55℃孵育直至完全裂解,(因组织不同而异,鼠尾6~8h,可以过夜裂解,每小时颠倒2~3次)。
(3)如果需要去除RNA,可以加入适量RNase A于样品中,室温孵育2min。
(4)12000r离心5min,转移上清于一无菌的离心管中。
2.DNA提取过程
(1)利用2倍体积无水乙醇和1/10体积的3mol/L醋酸钠沉淀DNA(注意沉淀为DNA,不能弃去)。
(2)将上述的混合物加入到硅胶柱中,12000r离心1min,后用75%的乙醇清洗杂质,洗2~3次。
(3)将硅胶吸附柱置于干净的离心管中,在柱的中央加入200μl预热TE(60℃),或去离子水(pH>7.0)室温静置1min,12000r离心1min,洗脱DNA。
(4)为得到更多的DNA,进行第二次洗脱,在柱的中央加入200μl预热TE(60℃),或去离子水(pH>7.0),室温静置1min,12000r离心1min,洗脱DNA。洗脱出的DNA于-20℃保存。
(1)1%琼脂糖凝胶的配制:例如:0.15g琼脂糖+15ml0.5×TAE微波炉加热至沸腾,待降低至70℃加入Gold view染料(5μl/100ml),倒入小型胶槽中(其他规格胶槽按此比例配制)。室温静置40min。
(2)取50~100ngDNA,用去离子水补充体积至10μl,加入1μl10×DNAloading Buffer,进行电泳。电泳120V20~30min(电泳液为0.5×TAE)。
(四)注意事项
1.裂解液与样品的比例要适当,过少的裂解液可能导致样本裂解不完全,而过多的裂解液也可能会影响提取效果。
2.尽量切碎组织,以免影响裂解效果;完全裂解后可以呈黏稠状。
3.组织样本一般要保存在-80℃冰箱或液氮中,且避免反复冻融;使用无菌离心管和枪头,避免DNA酶污染。
(五)主要问题及解决方法
1.为什么在琼脂糖电泳时,提取的DNA有许多片段?
答:这主要是因为DNA发生了酶解或断裂。主要原因包括:组织不新鲜,或者保存过程中发生了冻融,离心管或枪头有DNA酶的污染。解决方案:保证组织的新鲜和避免反复冻融,避免DNA酶污染。
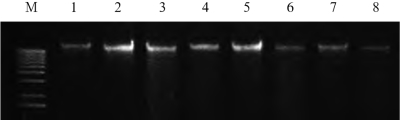
图2-1 人白细胞基因组DNA
M.1kbmarker;1~8.从不同人白细胞中提取的基因组DNA
2.为什么提取的DNA量很少?
答:这主要是因为裂解不完全,可能是组织裂解液用量不够或蛋白酶K的浓度不够或活性下降。解决方案:要使用足够量的裂解液,要使用活性很高的蛋白酶K。
(六)结果示例
这是我室从人白细胞中提取的基因组DNA,从图2-1上可以看出,基因组DNA片段完整,无明显的降解。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















