(一)弱酸强碱盐的水解
以NaAc单弱盐为例,NaAc在水中全部电离:
NaAc→Na++Ac—
H2O■■■OH—+H+
Na+与OH—不能结合成分子,不影响水的电离平衡。但是Ac—可以和水电离产生的H+结合成弱电解质HAc分子,破坏了水的电离平衡,使水的电离平衡向右移动,当再次建立新的平衡时,溶液中的c(OH—)>c(H+),溶液显碱性。
从上讨论可知,NaAc的水解实质是Ac—的水解:
水解离子方程式为:Ac—+H2O■■■HAc+OH—
达平衡时:
K■h为水解平衡常数。
Ac—的水解平衡,实际上是HAc的电离平衡与H2O的电离平衡的共同作用结果。
将分子分母上同乘以ceq(H+),便可得到:
所以弱酸强碱盐的水解平衡常数
该式表明弱酸强碱盐的水解决定于组成盐的弱酸的相对强弱。当温度一定时,酸越弱,其酸根离子水解倾向越大;酸越强,其酸根离子水解倾向越小。
除了用K■h表示盐的水解倾向大小外,通常也可用水解度h来表示。水解度
【例6-11】求0.1mol·L—1NaAc溶液的pH值和水解度h。已知HAc K■a=1.75×10—5。(1)求溶液的pH值;(2)求h。
解:(1)求溶液pH值,忽略水电离出的OH—
设平衡时溶液中的ceq(OH—)=x
Ac—+H2O■■■HAc+OH—
相对起始浓度 0.1 0 0
相对平衡浓度 0.1—xxx
(2)求h
通过例6-11的计算,可导出计算一元弱酸强碱盐OH—离子相对平衡浓度的近似计算公式。
可见,弱酸强碱盐水溶液的OH—离子浓度与弱酸电离平衡常数的平方根成反比,与盐浓度的平方根成正比。
需要指出的是,上式忽略了已水解的盐的浓度,当已水解的盐浓度较大时,即
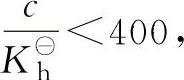
则必须解一元二次方程,否则误差太大。
(二)强酸弱碱盐的水解
此类单弱盐的水解与弱酸强碱盐的水解相似,只是发生水解的是组成盐的阳离子。以NH4Cl为例。
NH4Cl→NH4++Cl—
H2O■■■OH—+H+
溶液中存在着NH4+、Cl—、H+、OH—四种离子,Cl—与H+碰撞,相互不能结合。NH4+与OH—碰撞,结合生成NH3·H2O。由于OH—浓度减少,水的电离平衡遭到破坏,水的电离平衡向右移动。当新的电离平衡建立时溶液中的ceq(H+)>ceq(OH—),水溶液呈酸性。
同样可知:【强酸弱碱盐水解的是组成盐的阳离子,其结果溶液呈酸性】。
NH4Cl水解离子方程式:
NH4++H2O■■■NH3·H2O+H+
当达到水解平衡时,

,若在上式分子、分母上各乘以ceq(OH—),则得到

所以强酸弱碱盐的水解平衡常数
用同样的方法可以导出,强酸弱碱盐H+离子相对平衡浓度的近似计算公式。
以上两类盐发生水解的仅是组成盐的某一种离子,所以这类盐也称为单弱盐。
(三)弱酸弱碱盐的水解
由弱酸与弱碱反应生成的盐称为弱酸弱碱盐,组成盐的阴阳离子在水溶液中可发生水解。
以NH4Ac为例
NH4Ac→NH4++Ac—
H2O■■■OH—+H+
溶液中存在NH4+、Ac—、OH—、H+等四种离子,NH4+与OH—可结合为NH3·H2O,Ac—与H+可结合为HAc。因此,该盐的水解倾向比起单弱盐要强烈得多,故又可称其为双弱盐。
NH4Ac水解离子方程式
由上式可知,NH4Ac的水解平衡,实质是H2O的电离平衡、HAc的电离平衡以及NH3·H2O的电离平衡共同作用的结果。
将分子、分母同乘以ceq(H+)、ceq(OH—)
则
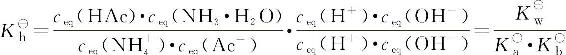
所以弱酸弱碱盐的水解平衡常数
因为K■a、K■b一般均较小,所以K■h相对于单弱盐的K■h要大得多,说明该类型盐的水解倾向较强烈。
当K■a>K■b,溶液呈酸性;K■a<K■b,溶液呈碱性;K■a=K■b,溶液呈中性。由于HAc的K■a与NH3·H2O的K■b几乎相等,因此NH4Ac溶液呈中性。
以NH4Ac为例推导出计算弱酸弱碱盐H+离子浓度的计算公式
由于HAc的K■a与NH3·H2O的K■b基本相等,所以ceq(NH3·H2O)=ceq(HAc),ceq(NH4+)=ceq(Ac—)
即
将(2)式代入(1)式,

可见,弱酸弱碱盐溶液的pH值与盐的浓度无关,仅与组成该盐的弱酸和弱碱的电离常数有关。
【例6-12】求0.1mol·L—1NH4CN溶液的pH值。
已知:HCNK■a=6.17×10—10 NH3·H2OK■b=1.74×10—5
解:NH4CN为弱酸弱碱盐

答:NH4CN溶液的pH值为9.23。
(四)多元弱酸强碱盐的水解
多元弱酸强碱盐在水溶液中进行的水解,同多元弱酸电离一样,是分级进行的。以Na2CO3为例
Na2CO3→2Na++CO23—发生水解的是CO23—
第一级水解
第二级水解
由于多元弱酸的K■a1■K■a2,所以多元弱酸强碱盐的K■h1■K■h2,同时,第一级水解产生的OH—对第二级水解起了抑制作用。因此,对多元弱酸强碱盐来说,只需考虑第一级水解即可。计算这类盐溶液的pH值,可参照弱酸强碱盐的计算方法。当

时

当
时,则不能采用盐的原始浓度,应用平衡浓度,即必须解一元二次方程。
【例6-13】计算0.1mol·L—1Na3PO4溶液的pH值。
已知:H3PO4K■a1=7.59×10—3K■a2=6.31×10—8K■a3=4.37×10—13
解:Na3PO4为多元弱酸强碱盐,只要考虑其第一级水解
PO34—+H2O■■■HPO24—+OH—
需解一元二次方程。
设水解后

解得x=0.14
即ceq(OH—)=0.14 pOH=0.85 pH=13.15
答:0.1mol·L—1Na3PO4溶液的pH值为13.15。
(五)弱酸的酸式盐的水解
弱酸的酸式盐在溶液中水解的情况比较复杂,酸根离子既可发生电离又可发生水解。
以NaHCO3为例
NaHCO3→Na++HCO—3
HCO—3发生电离:HCO—3■■■H++CO23—K■a2=5.62×10—11HCO—3发生水解:
因为K■h>K■a2,说明HCO—3在水溶液中水解倾向大于电离倾向,溶液呈碱性。
HCO—3水解后,其c(OH—)=ceq(H2CO3),HCO3—电离产生的H+与OH—要结合为H2O,被H+结合的c(OH—)=ceq(CO23—)。
即ceq(OH—)=ceq(H2CO3)—ceq(CO23—)(1)
根据
将(2)、(3)式代入(1)式得:

两边同乘以K■a1和ceq(H+),并整理得:

由于
因此
得:
式(6-27)说明弱酸的酸式盐的水溶液ceq(H+)近似地等于弱酸两级电离平衡常数乘积的平方根,该式适用于多元弱酸的次级盐。
【例6-14】计算0.1mol·L—1NaH2PO4、0.1mol·L—1Na2HPO4溶液的pH值。
已知:H3PO4K■a1=7.59×10—3K■a2=6.31×10—8K■a3=4.37×10—13
解:0.1mol·L—1NaH2PO4
H2PO—4■■■H++HPO24— H2PO4—+H2O■■■H3PO4+OH—
根据(6-27)式:

根据(6-27)式的推导方法可得到:

由于强酸强碱盐的离子均不能与水电离出的H+与OH—结合为弱电解质,因此,强酸强碱盐不发生水解,溶液呈中性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














