【摘要】:溶度积K■sp从平衡常数角度表示难溶强电解质溶解的趋势,溶解度s也可以表示难溶物溶解的程度,两者之间存在着必然的联系。因此,溶液中阳离子或阴离子的相对浓度在数值上就等于该物质的溶解度。已知298.15K时AgCl和AgBr的溶度积分别为1.8×10—10和5.2×10—13,分别求它们的溶解度s1、s2。对于AB2型或A2B型的难溶强电解质,如Mg2、PbI2、Ag2CrO4等,它们的溶度积与溶解度之间的关系讨论如下:
溶度积K■sp从平衡常数角度表示难溶强电解质溶解的趋势,溶解度s也可以表示难溶物溶解的程度,两者之间存在着必然的联系。因此K■sp与s之间可以互相换算。溶解度用mol·L—1表示。
不同类型的难溶强电解质,溶度积与溶解度之间的定量关系不同,现分类型讨论如下。
(一)AB型难溶强电解质
对于AB型难溶强电解质,如AgCl、BaCO3等。在达到沉淀-溶解平衡时,生成的阳离子和阴离子的物质的量相等。因此,溶液中阳离子或阴离子的相对浓度在数值上就等于该物质的溶解度。
设AB型难溶强电解质的溶解度为s,则:
AB(s)■■■A++B—
相对平衡浓度
【例7-1】已知298.15K时AgCl和AgBr的溶度积分别为1.8×10—10和5.2×10—13,分别求它们的溶解度s1、s2。
解:在AgCl的饱和溶液中存在如下平衡:
AgCl(s)■■■Ag++Cl—
相对平衡浓度
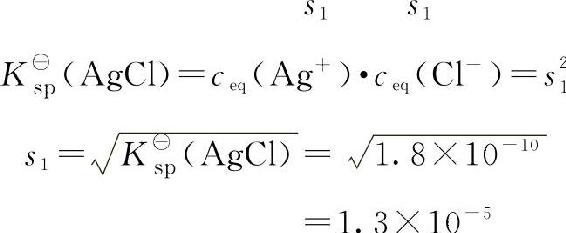
同理,在AgBr饱和溶液中:
AgBr(s)■■■Ag++Br—
相对平衡浓度

(二)AB2型或A2B型难溶强电解质
对于AB2型或A2B型的难溶强电解质,如Mg(OH)2、PbI2、Ag2CrO4等,它们的溶度积与溶解度之间的关系讨论如下:
以AB2型为例,设其溶解度为s,则:
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















