(一)元素电势图
许多元素具有多种氧化值。将某一元素各种氧化值按从高到低(或低到高)的顺序排列,在两种氧化值之间用直线连接起来并在直线上标明相应电极反应的标准电极电势值,这样构成的图,称为元素电势图。
元素电势图是拉特默(Latimer)于1952年首先提出的,故又称为拉特默图。根据溶液pH值的不同,又可以分为两大类:EA(A表示酸性溶液)表示溶液的pH=0;EB(B表示碱性溶液)表示溶液的pH=14。书写某一元素的电势图时,既可以将全部氧化值列出,也可以根据需要列出其中的一部分。例如氯的元素电势图:酸性溶液:
碱性溶液:
在元素电势图中,任何连线相邻的两个物质可以组成一个电对。如上述在酸性溶液中,ClO3——Cl—,ClO3—是氧化态物质,Cl—是还原态物质,E■(ClO—3/Cl—)=+1.45V。
元素电势图能比较清楚地标示出同一元素各氧化值间氧化还原性的变化。利用元素电势图,可以考察元素各氧化值在水溶液中的化学行为,计算未知电对的标准电极电势等。
(二)元素电势图的应用
1.判断能否发生歧化反应
歧化反应即自身氧化还原反应。它是指在氧化还原反应中,氧化作用和还原作用发生在同种物质中相同氧化值的某一元素上,也就是该元素的原子(或离子)一部分被氧化而另一部分被还原。该物质在反应中既是氧化剂又是还原剂。
由某元素不同氧化值的三种物质所组成的两个电对,按其氧化值高低可排列为
AE■左BE■右C
E■MF=E■(+)—E■(—)=E■右—E■左
B变成C是得到电子的过程,电对B/C是电池的正极;B变成A是失去电子的过程,电对A/B是电池的负极,所以
E■MF=E■右—E■左>0 即E■右>E■左
假设B不能发生歧化反应,则
E■MF=E■右—E■左<0 即E■右<E■左
根据以上原则,Cu+是否能够发生歧化反应?
有关的电势图为:
E■A/V Cu2+0.158Cu++0.552Cu因为E■右>E■左,所以在酸性溶液中,Cu+离子不稳定,它将发生下列歧化反应:
2Cu+■■■Cu+Cu2+又如Br2的元素电势图:
E■右>E■左,所以在碱性溶液Br2会发生歧化作用,其反应式为:
3Br2+6OH—■■■5Br—+BrO—3+3H2O
该歧化反应的电动势E■MF=E■右—E■左=0.547V,说明上述反应能自发地从左向右进行。
由上两例可推广为一般规律:
在元素电势图AE■左BE■右C中,若E■右>E■左,物质B将自发地发生歧化反应,产物为A和C;若E■右<E■左,当溶液中有A和C存在时,将自发地发生歧化反应的逆反应,产物为B。
2.从已知电对求未知电对的标准电极电势
假设有一元素的电势图:
n1、n2、n3分别为相应电对的电子转移数,其中nx=n1+n2+n3。
根据化学热力学原理,理论上可导出下列公式:
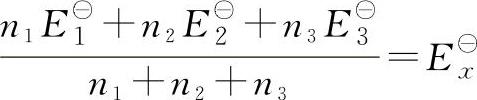
若有i个相邻电对,则
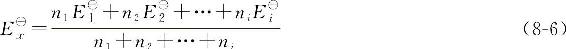
根据此式,可以从已知电对的E■计算出欲求电对的E■值。
【例8-16】已知298.15K时,氯元素在碱性溶液中的电势图,试求出E■1(ClO4—/Cl—),E■2(ClO—3/ClO—),E■3(ClO—/Cl2)的值。
解:298K时氯元素在碱性溶液中的电势图

【例8-17】已知:E■B/V H2PO2——1.82P4—0.87PH3
求:E■(H2PO2—/PH3)值。
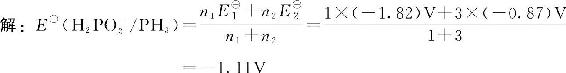
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















