【目的及要求】
(1)巩固掌握常压蒸馏、减压蒸馏技术;
(2)了解并掌握分液萃取、盐析的应用;
(3)复习巩固酯缩合反应。
【反应式】
1.常量合成
【所需试剂】
乙酸乙酯18.0 mL(0.19 mol);金属钠2.0 g(0.08 mol);50%醋酸水溶液;饱和氯化钠溶液;无水硫酸镁;无水氯化钙。
【操作步骤】
在一个干燥的100 mL圆底烧瓶中,加入18 mL干燥的乙酸乙酯和2 g金属钠丝[1],迅速装上回流冷凝管和氯化钙干燥管,反应即开始。用热水维持沸腾状态,至金属钠完全反应。
将反应物冷却到50℃,在不断振荡下慢慢加入约12 mL 50%的醋酸水溶液至呈微酸性(过量的乙酸水溶液会增大乙酸乙酯的溶解度)。加入等体积的氯化钠饱和溶液,充分振荡,将液体转移至分液漏斗中静置。待乙酸乙酯完全析出后分出,用无水硫酸镁干燥。滤入蒸馏瓶,水浴蒸出未反应的乙酸乙酯。然后进行减压蒸馏[2],收集乙酰乙酸乙酯4~5 g。
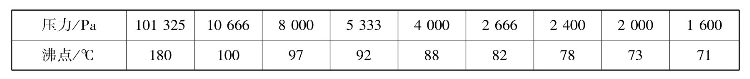
乙酰乙酸乙酯沸点与压力的对应关系见表4-3。
表4-3 乙酰乙酸乙酯沸点与压力的对应关系
【注释】
[1]金属钠遇水即爆炸,使用时应严格注意。
[2]常压蒸馏乙酰乙酸乙酯会发生部分分解。
【思考题】
(1)实验中用饱和氯化钠的目的何在?
(2)何为互变异构现象?如何用实验来证明乙酰乙酸乙酯式两种互变异构体的平衡混合物?
2.半微量合成
【所需试剂】
金属钠1.30 g(56.5 mmol);乙酸乙酯14 mL(142.9 mmol)。
【操作步骤】
在干燥的50 mL圆底烧瓶中,加入14.0 mL乙酸乙酯和1.3 g新切的钠丝,迅速安装回流冷凝管和氯化钙干燥管,反应即开始。用水浴维持沸腾状态,至金属钠完全反应。此时生成的是橘红色透明的乙酰乙酸乙酯溶液。
将反应物冷却到50℃,在不断振荡下慢慢加入8.0 mL 50%的醋酸(等体积冰醋酸和水配成),在此过程中出现大量固体,继续加入醋酸,逐渐溶解,溶液呈微酸性(pH=5)。加入等体积的50%饱和氯化钠溶液,充分振荡,转移至分液漏斗中静止,待有机层完全析出后,分出有机层,并用无水硫酸镁干燥。滤入蒸馏瓶,水浴蒸出未反应的乙酸乙酯[1],然后进行减压蒸馏[2],得到产品3.2~3.6 g。
【注释】
[1]蒸馏乙酸乙酯要慢,以免带出产品。
[2]蒸馏乙酰乙酸乙酯时,必须减压蒸馏,以避免其分解,且体系压力越低越好。
【思考题】
同常量合成。
【产物谱图】
乙酰乙酸乙酯的红外谱图如图4-14所示,乙酰乙酸乙酯的1H-NMR谱图如图4-15所示。
图4-14 乙酰乙酸乙酯的红外谱图
图4-15 乙酰乙酸乙酯的1H-NMR谱图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















