(1/4) 呼吸链的概念
呼吸链:氢原子(2H)通过酶和辅酶催化的反应与氧结合生成水,酶和辅酶称为呼吸链或电子传递链。 组成:递氢体和电子传递体(2H2H++2e) 递氢体同时也是递电子体,递电子体不一定是递氢体。 递氢体:NAD NADP FAD FMN CoQ 递电子体:Cyt Fe-S 2002A-24、下列关于呼吸链的叙述错误的是:(D) A、在传递氢和电子过程中可偶联ADP磷酸化 B、CO可使整个呼吸链的功能丧失 C、递氢体同时也是递电子体 D、递电子体也都是递氢体 E、呼吸链的组分通常按Eo值由小到大的顺序排列 解析:呼吸链中酶和辅酶排列顺序是根据标准氧化还原电位(E0)由低到高排列。CO能抑制递电子体CytC,使电子不能传递给氧,造成氧化受阻,导致整个呼吸链功能丧失。 1996X-145、同时传递电子和质子(H+)的辅酶有:( AC) A.辅酶Q B.铁硫蛋白 C.FMN D.细胞色素aa3 解析:呼吸链中除铁硫蛋白和细胞色素外均即传递电子又传递质子。 细胞色素Cyt 铁卟啉为辅基单电子传递蛋白; 呼吸链中有a、b、c三类; 呼吸链排列顺序:Cytb→c1→c→a→a3 bc1caa3

2006A-29.下列关于细胞色素的叙述正确的是:(A) A.是一类以铁卟啉为辅基的酶 B. 都紧密结合在线粒体内膜上 C.是呼吸链中的递氢体 D.在呼吸链中按Cytb-Cytc-Cytcl-Cytaa3排列 E.又称为细胞色素氧化酶 解析:铁卟啉中铁原子可进行Fe2+-Fe3++e反应传递电子,细胞色素是呼吸链中的电子传递体。不是所有细胞色素都紧密结合,如Cytc呈水溶性,与线粒体内膜外表面结合不紧密。细胞色素氧化酶构成复合体IV。
(2/4) 呼吸链的组成
1. NADH呼吸链 NADH →复合体Ⅰ→Q→复合体III→Cytc→复合体Ⅳ→O2 2. 琥珀酸呼吸链琥珀酸→复合体Ⅱ→Q→复合体III→Cytc→复合体Ⅳ→O2

各组分按标准氧化还原电位(E0)由低到高排列-人往高处走 (泛醌和Cyt c结合疏松不在复合体) A、NADH/NADH+H B、FAD/FADH2 C、Cytb Fe3+/Fe2+ D、Cyta Fe3+/Fe2+ 2009B-129、呼吸链中氧化还原电位最高的是: (D) 2009B-130、呼吸链氧化还氧化还原对中参与构成呼吸链复合体II的是: (B) 1996X 同时传递电子和质子(H+)的辅酶有: (AC) A.辅酶Q B.铁硫蛋白 C.FMN D.细胞色素aa3
(3/4) 重要代谢物氧化途径
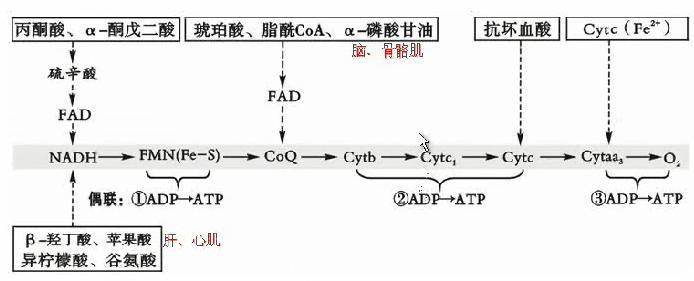
电子传递过程中偶联ADP磷酸化生成ATP 偶联磷酸化ATP生成的部位 3 生成FADH2的反应 琥珀酸→延胡索酸 β氧化第一步脱氢:脂酰CoA→烯酰CoA α磷酸甘油穿梭:3-磷酸甘油→磷酸二羟丙酮 2005A-27.下列代谢物经相应特异脱氢酶催化脱下的2H,不能经过NADH呼吸链氧化的是:(D) A、异柠檬酸 B.苹果酸 C.酮戊二酸 D.琥珀酸 E.丙酮酸 解析:琥珀酸脱下的2H经FAD进入琥珀酸氧化呼吸链。 牢记:琥珀酸、α-磷酸甘油、脂酰CoA经FAD 抗坏血酸:不走寻常路 A.进人呼吸链生成3分子ATP B.进人呼吸链生成2分子ATP C.二者均对 D.二者均不对 1997B-123.3-磷酸甘油醛在3-磷酸甘油醛脱氢酶作用脱下氢 1997B-124.谷氨酸在谷氨酸脱氢酶作用下脱下的氢 解析:3-磷酸甘油醛脱下氢被NAD+接受进入线粒体有两种机制: ①经α-磷酸甘油穿梭进入呼吸链产生2ATP ②经天冬氨酸-苹果酸穿梭进入呼吸链产生3ATP。 1996A-32.下列哪种物质脱下的氢经呼吸链传递后P/O比约为3?:(A) A.β-羟丁酸 B.琥珀酸 C.α-磷酸甘油 D.抗坏血酸 E.脂酰CoA 解析:P/O比值是指物质氧化时每消耗1摩尔氧原子所消耗无机磷的摩尔数即生成ATP的摩尔数。抗坏血酸直接通过Cyt c。
(4/4) 氧化磷酸化抑制剂
(1)呼吸链抑制剂阻断呼吸链中电子传递。 (2)解偶联剂使氧化与磷酸化偶联过程脱离,如解偶联蛋白代表物质:二硝基苯酚(DNP)。 (3)ATP合酶抑制剂对电子传递及ADP磷酸化均有抑制作用,如寡霉素。 2012A-30.2,4-二硝基苯酚抑制氧化磷酸化机制:(A) A.解偶联 B.抑制电子传递 C.抑制ATP合酶 D.与复合体I结合 2007A-29.下列关于线粒体氧化磷酸化解偶联的叙述,正确的是:(C) A.ADP磷酸化作用加速氧的利用 B.ADP磷酸化作用继续,但氧利用停止 C.ADP磷酸化停止,但氧利用继续 D.ADP磷酸化无变化,但氧利用停止 解析:脱偶联剂使ATP的生成受到抑制,以电化学梯度储存的能量以热能形式释放。


2010A-30.CO抑制呼吸链的部位是:(D) A、复合体I B、复合体II C、复合体III D、复合体Ⅳ
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















