根霉PE-8菌株淀粉降解酶类的研究
刘建军 赵祥颖 李丕武 田延军 张家祥
(山东省食品发酵工程重点实验室 济南 250013)
摘要:从淀粉厂土样等样品中分离筛选到一支产淀粉降解酶的根霉菌株P78,经紫外线及Co60辐射诱变和自然分离、获得一支突变菌株PE-8,在麸曲培养基上,46~48℃、固态培养22~24小时,酶活力达3000U/g (干) 。经高压液相色谱和纸层析分析证明,其分泌的淀粉降解酶类作用于适当液化的玉米淀粉产物中麦芽三糖至麦芽八糖的比例达77.6%、葡萄糖含量仅为3.03%,属于麦芽低聚糖,说明根霉PE-8菌株分泌的淀粉降解酶类不同于葡萄糖淀粉酶或a-淀粉酶,属于低聚糖酶。
关键词:根霉;选育;低聚糖;低聚糖酶
根霉在自然界分布极其广泛,在许多基质上普遍存在,如土壤、空气、酒药、酒曲等。根霉的用途非常广,我国用根霉制曲酿酒已有悠久的历史,如米根霉(Rhi.oryzae)等淀粉酶活力相当强,大多用作糖化菌,某些根霉菌株产生乳酸、反丁烯二酸、脂肪酶、果胶酶等[1]。另外,根霉产生麦芽低聚糖酶也已见报道[2,3],低聚糖的生产技术研究已引起人们的广泛关注[4,5]。本文报道了根霉PE-8菌株的选育过程及其淀粉降解酶类的研究情况。
1 材料与方法
1.1 分离样品
粮食酒曲、酒药、发霉馒头、淀粉厂土样、废水等15个样品。
1.2 培养基组成
平板分离及斜面培养基:新鲜去皮土豆200g,加入1000ml自来水,微沸20分钟,取清汁定容1000ml,补加10g葡萄糖,20g琼脂,pH自然,0.08~0.1Mpa灭菌20分钟。
三角瓶麸曲培养基:新鲜麸皮和水按1∶1.4~1.8的比例搅拌均匀,分装三角瓶,500ml三角瓶装料20克,0.1Mpa灭菌30分钟。
1.3 诱变方法
孢子悬液的制备:取45℃培养3~4天的试管斜面菌种,加生理盐水洗下孢子,转移到无菌弹子瓶中振荡打散,用脱脂棉过滤,调整单孢子悬液的浓度为106~108个/ml。
紫外线(U.V.)诱变:在暗室中,吸取10ml制备好的孢子悬液于9cm培养皿中,置于15W紫外灯下,照射距离30cm,用磁力搅拌保持悬液均匀,选择不同的照射时间,吸取样品适当稀释后涂布分离平板,45℃恒温避光培养,挑取单菌落。
Co60诱变:取5ml单孢子悬液于灭菌试管中,用不同剂量Co60射线照射,适当稀释后涂布平板,45℃培养,挑取单菌落。
1.4 菌种筛选方法
麸皮加水1∶1.4~1.8,充分搅拌,0.1MPa灭菌30分钟冷却后接种孢子,45~46℃培养22~24小时,测定酶活力。
1.5 麦芽低聚糖酶活力的定义及测定
1.5.1 麦芽低聚糖酶活力单位定义
在pH6.4、40℃条件下,作用于可溶性淀粉每小时产生1mg麦芽三糖的酶量定义为一个酶活力单位(麦芽低聚糖以麦芽三糖为主,酶活力计算以麦芽三糖计) 。
1.5.2 麦芽低聚糖酶活力测定
1.5.2.1 试剂配制[6]
a. 2%可溶性淀粉溶液
b. 2%氢氧化钠溶液
c. 3,5-二硝基水杨酸试剂(DNS试剂)
1.5.2.2 葡萄糖标准曲线的绘制
1.5.2.3 酶活力测定
a.样品处理:称取一定数量的成熟麸曲,加入10倍的水,于55℃恒温水浴中保温浸提2小时,纱布过滤取清液,作适当稀释测定酶活力。
b.测定:精确吸取2%的可溶性淀粉5ml,pH6.4的磷酸缓冲液1ml,在40℃水浴中预热5分钟,加入0.5ml稀释酶液,立即摇匀,在此温度下准确反应30分钟,立即加入0.5ml2%的氢氧化钠溶液,终止反应。空白管加入0.5ml2%的氢氧化钠溶液后,补加0.5ml酶液。
吸取上述反应液、空白液各0.2ml分别至于比色管中,各加入1.8ml蒸馏水,加1.5mlDNS试剂,沸水浴显色5分钟,冷却后定容25ml,在540nm下比色测定吸光度(OD) 。
c.麸曲(干)酶活力的计算:
酶活力单位(u/g) =392×OD×V×n/[k×W× (1-X) ]
OD──吸光度
V──浸提酶液体积(ml)
W──麸曲重量(g)
X──麸曲水分含量(%)
k──葡萄糖标准曲线斜率
n──酶液稀释倍数
392──常数
1.6 其他分析方法
1.6.1 还原糖的测定[7]
快速滴定法
1.6.2 总糖的测定
快速滴定法
2 结果与讨论
2.1 菌种分离
2.1.1 分离方案
样品→加无菌水稀释→涂布分离平板→45℃恒温培养18小时→挑取单菌落→产酶试验。为定向筛选丝状菌类,在平板培养基中加入少量青霉素,抑制细菌生长,同时加0.1%的去氧胆酸钠抑制菌落的过分生长,以保证得到单菌落。
2.1.2 分离及筛选结果
从采集的样品中分离得到根霉13支,曲霉7支,经麸曲瓶培养,其浸提酶液用于糖化适度液化的淀粉实验,证明有5支根霉、3支曲霉糖化能力较强。液化淀粉乳起始DE值为18.62%、55~60℃恒温糖化20小时后,有2支根霉的糖化液具有明显的麦芽糖香味,结果见表1。
表1 菌种的筛选结果

P-56、P-78两支菌株糖化样品经品评甜味纯正、口感厚实,并且具有麦芽糖特有的香味,纸层析结果证明葡萄糖斑点与液化样相比变化不大,而且麦芽三糖至麦芽八糖的斑点明显增大,且颜色深,P-78菌株的纸层析结果更优于P-56菌株,因此选择P-78菌株作为今后工作的研究对象。
2.2 诱变育种
2.2.1 紫外线诱变处理
以P-78为出发菌株进行紫外线诱变,经平板筛选共挑取单菌落121个,经麸曲瓶初筛、复筛获得几株酶活较高的突变株,结果见表2。
表2 P-78紫外线处理复筛结果

结果表明P78-12菌株酶活力比较高,经多次分离,性能稳定,以P78-12菌株作为Co60辐射诱变处理的出发菌株。
2.2.2 Co60辐射诱变处理
PE78-12菌株经Co60照射处理,经筛选共挑取单菌落84株,进行麸曲瓶初筛、复筛,结果见表3。
表3 P78-12菌株Co60照射复筛结果

PE-8菌株酶活力达3036U/克(干) ,纸层析结果几乎没有葡萄糖斑点,。经多次自然分离,产酶性能稳定,并且抗污染能力强,易于培养,是一支具有开发潜力的低聚糖酶生产菌株。
2.3 PE-8菌株酶糖化淀粉产物的鉴定以及与葡萄糖淀粉酶、a-淀粉酶作用结果比较
淀粉液化DE值控制在5%~10%,分别加入PE-8菌酶、葡萄糖淀粉酶、a-淀粉酶,55~60℃保温,将糖化DE值控制在37%左右,三种酶作用产物经高压液相色谱分析及纸层析分析结果见表4。
表4 三种酶作用于淀粉的产物分析结果
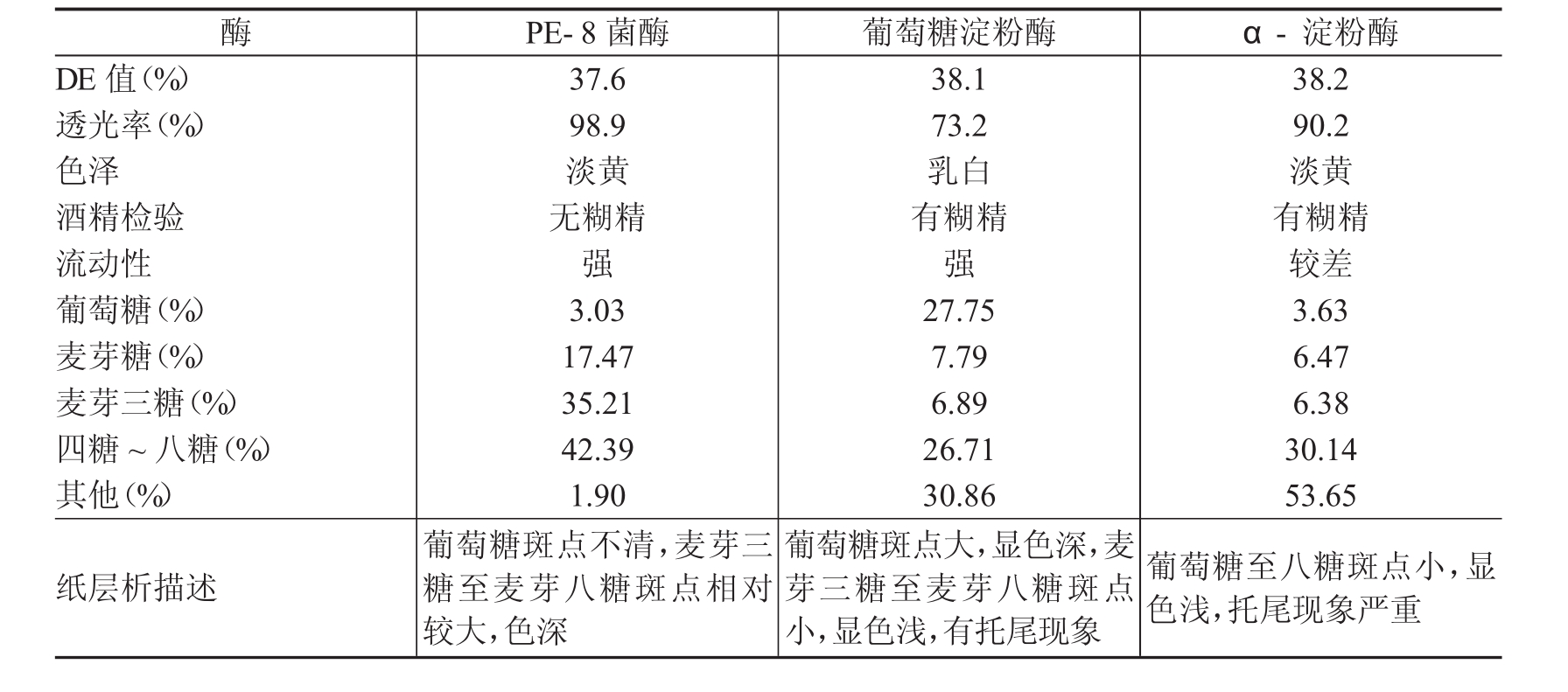
表中结果可以看出,PE-8菌株低聚糖酶作用于淀粉的产物中麦芽三糖至麦芽八糖含量达77.6%、葡萄糖含量仅为3.03%,不含糊精,属于麦芽低聚糖类,而葡萄糖淀粉酶、a-淀粉酶作用于淀粉对应的两项指标分别为33.9%、27.75%和36.52%、3.63%,说明PE-8菌株分泌的淀粉降解酶类不同于葡萄糖淀粉酶、a-淀粉酶。由此可以推断PE-8菌株分泌的淀粉降解酶类属麦芽低聚糖酶。产酶条件的优化、酶学性质及酶的应用研究有待于进一步研究。
3 结论
3.1 从采集的样品中分离得到根霉13支,曲霉7支,其中有5支根霉、3支曲霉糖化液化淀粉乳的能力较强。
3.2 以分离得到的根霉P78为出发菌株,经紫外线及Co60辐射诱变处理获得一支根霉突变菌株PE-8,在麸曲培养基上,46~48℃、固态培养22~24小时,酶活力达3000U/克(干)以上,其分泌的淀粉降解酶类作用于适当液化的玉米淀粉产物经高压液相色谱和纸层析分析证明,麦芽三糖至麦芽八糖的比例达77.6%、葡萄糖含量仅为3.03%,属于低聚糖类;而葡萄糖淀粉酶、a-淀粉酶对应的两项指标分别为33.9%、27.75%和36.52%、3.63%,说明根霉PE-8菌株分泌的淀粉降解酶类不同于葡萄糖淀粉酶或淀粉酶,属于低聚糖酶。
3.3 突变株PE-8菌株营养要求低、抗污染能力强、易于培养,且性能稳定,是一支适合于工业生产要求的较优菌株。
参考文献:
[1]无锡轻院,等.微生物学[M].北京:中国轻工业出版社,1983. 93~96
[2]金其荣,徐云.高温根霉低聚糖酶制备淀粉原料低聚直链葡萄糖浆[J].食品科学,1991.7: 8~12
[3]金其荣.低聚糖及根霉低聚糖的生理功能[J].食品科学,1994,1: 5~7
[4] TAKASHI K,MICHIYOY,HIROKI T,et al.A new way of producing isomalto-oligosaccharide syrup by using the transglycosylation reaction ofneoppullulanase[J]. APPL. Environ. Microbiol,1993,8:953~959
[5]胡新平,等.功能糖类—异麦芽低聚糖[J].食品与发酵工业,1996,5: 70~72
[6]张龙翔,等.生化实验方法和技术[M].北京:人民教育出版社.1981.95~98
[7]朱懿德,梁国庆,包守懿.发酵工业分析[M].北京:中国轻工业出版社,1991.38~41
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















