2.1.5 能量按自由度均分原理
![]()
1.分子自由度
确定一个物体在空间的位置所需要的独立坐标数目,称为该物体的自由度。
在常温下可不考虑分子内原子之间的振动,即认为分子是刚性的。
单原子分子可视为自由质点,只有3个平动自由度t=3,其总自由度i=t=3。如惰性气体:氦气、氖气、氩气等。
刚性双原子分子有3个平动自由度t=3和2个转动自由度r=2,其总自由度i=t+r=5。如:氢气、氧气、氮气等。
刚性多原子分子有3个平动自由度t=3和3个转动自由度r=3,其总自由度i=t+r=6。如:水分子。
2.能量按自由度均分原理
从理想气体分子的平均平动动能公式出发,考虑到大量气体分子作无规则热运动应服从统计规律,即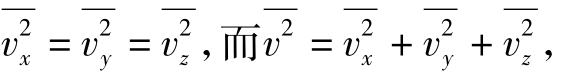 所以
所以
![]()
此式表明,按照统计的观点,气体分子沿x、y、z三个方向运动的平均平动动能都相等,气体分子的平均平动动能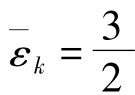 kT是均匀地分配到三个平动自由度上的,每个平动自由度分得的能量是
kT是均匀地分配到三个平动自由度上的,每个平动自由度分得的能量是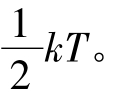
由于分子本身具有一定的大小和复杂的内部结构,分子除平动外,还会有转动以及分子内部原子之间的振动。对刚性分子,在讨论分子热运动动能时,除考虑分子平动动能外,还要考虑分子的转动动能。
将上述平均平动动能按自由度均分的结论推广到复杂分子,可得:在热平衡状态下,理想气体分子的每个自由度都具有相同的平均动能,其数值为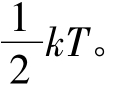 这就是能量按自由度均分原理。
这就是能量按自由度均分原理。
根据能量按自由度均分原理,总自由度为i的理想气体分子的平均能量为
![]()
单原子分子的平均能量为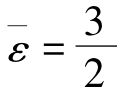 kT,刚性双原子分子的平均能量为
kT,刚性双原子分子的平均能量为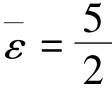 kT,刚性多原子分子的平均能量为
kT,刚性多原子分子的平均能量为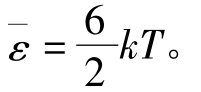
【例2.1-2】温度、压强相同的氦气和氧气,它们分子的平均能量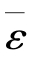 和平均平动动能
和平均平动动能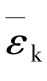 的关系是( )。
的关系是( )。
![]()
解:温度相等,则平均平动动能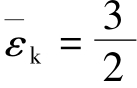 kT相等;而平均能量
kT相等;而平均能量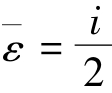 kT与分子自由度i有关,氦气是单原子气体,氧气是双原子气体,两者i不相等,因而-ε不相等。正确答案为(C)。
kT与分子自由度i有关,氦气是单原子气体,氧气是双原子气体,两者i不相等,因而-ε不相等。正确答案为(C)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















