3.3.6 电极电位的应用
1.判断氧化剂或还原剂的相对强弱
电极电位代数值越大,表示电对中氧化态物质越易得到电子,其氧化性越强。反之,电极电位代数值越小,表示电对中还原态物质越易失去电子,其还原性越强。例如,已知
![]()
则氧化剂的氧化性依次为
![]()
>Fe3+>Sn4+>Fe2+,而还原剂的还原性依次为Fe>Sn2+>Fe2+>Mn2+。
2.判断氧化还原反应进行的方向
氧化还原反应进行的方向是电极电位代数值最大的电对中氧化态物质作为氧化剂,氧化电极电位较小的电对中的还原态物质。即
强氧化剂+强还原剂→弱还原剂+弱氧化剂
【例3.3-1】(1)判断下列反应在标准状态下能否向右进行?
MnO2(s) +4HClMnCl2+Cl2(g)+2H2O
+4HClMnCl2+Cl2(g)+2H2O
(2)用计算结果说明为什么实验室中可用浓盐酸与MnO2作用制取Cl2?
(2)实验室使用浓盐酸制取Cl2
浓HCl中:[H+]=[Cl-]=12mol·dm-3
假设溶液中[Mn2+]=1.0mol·dm-3,pCl2=100kPa,则对于电极反应:
MnO2(s)+4H+ +2e Mn2++2H2O
+2e Mn2++2H2O
可计算:

而对电极反应: +2e,可计算:
+2e,可计算:

此时,EMnO2/Mn2+>ECl2/Cl-,该反应可向右进行,因此实验室可用浓盐酸加入到MnO2中制取Cl2。
(1)计算原电池的电动势
E电池=E+-E-

由于实际上电池的电动势总是大于零的,若根据计算E+<E-,说明设定的正负极应该反过来。
(2)计算氧化还原反应的平衡常数
氧化还原反应达到平衡时,电池电动势为零,即E电池=E+-E-=0,E+=E-,所以即电池的标准电动势。而当氧化还原反应达平衡时,各项电极反应物的浓度皆为相应的平衡浓度。它们的商即为平衡常数K-(参见3.4节)。所以在298K时,原电池的标准电动势 和氧化还原反应平衡常数K-之间有如下定量关系:
和氧化还原反应平衡常数K-之间有如下定量关系:
![]()
【例3.3-2】计算下列反应在298K时的平衡常数
2Fe3++Cu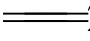 2Fe2++Cu2+
2Fe2++Cu2+
解:查表得标准电极电位:

(记住:K-与反应物实际浓度无关)
答:该反应的平衡常数为3.14×1014。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














