第二节 单克隆抗体技术
1975年Kohler和Milstein创立了生产单克隆抗体(简称单抗)的淋巴细胞杂交瘤技术。这项技术的诞生推动了整个生物医学领域的迅速发展。单抗作为抗原物质的分子识别工具除在生物医学基础研究、免疫和治疗方面得到广泛应用外,在疫病诊断和检疫中正在并将继续发展重要作用。
一、基本原理
作为抗体生成理论的克隆选择学说是杂交瘤技术产生的理论依据,细胞融合技术和杂交细胞的选择方法是杂交瘤技术产生的技术基础。
(一)克隆选择学说
1957年Burnet提出的克隆选择学说认为:每一个B淋巴细胞有一个独特的受体(现在认为一个B淋巴细胞,产生与受体特异性相同的抗体分子)。一个淋巴细胞只产生一种抗体分子。因此,根据克隆选择学说,一个B淋巴细胞克隆只能产生一种抗体分子。这就是生产单克隆抗体的理论依据。
(二)抗体多样性能的分子基础
抗体分子生物学的研究为克隆选择学说提出了新的依据。抗体分子是对称的,由两条完全相同的糖基化重链(H)和两条完全相同的非糖基化轻链(L)组成。根据重链稳定区(CH)的不同,免疫球蛋白(Ig)可分为IgM、IgD、IgG、IgE和IgA五类,它们分别带有μ、δ、γ、ε和α重链,又可进一步分为不同的亚类。重链和轻链均有一个可变区,分别用VH和VL表示,决定抗体的特异性。每个抗体分子只有一种轻链。重链和轻链可变区具有抗原结合部,决定抗体的特异性。每个抗体分子都有两个相同的抗原结合部。对抗体基因的研究表明:重链和K链V区基因的数目分别为250个左右。任意一个VK基因片段可以与任意一个JK基因片段结合(J基因为连接基因)。JK有4片段,故可产生1000(250×4)个不同的VK区编码基因。同样,任意一个VH基因片段可以与任意一个D基因片段(D基因为多样性基因,在VH和JH基因之间,约有12个)及JH基因片段结合。这样可产生10000(250×10×4)个不同的重链V区编码基因。重链与轻链的联合是随机的,因此可产生107(1000×10000)个特异性抗体。此外,轻链和重链基因重排时的移码、重链D基因5’端和3’端的修剪及随机延伸,不可产生多样性,因此特异性抗体的数目多得几乎是无限的。
(三)细胞融合、筛选和杂交瘤技术的建立
肿瘤细胞DNA生物合成有两条途径:一条由糖、氨基酸合成核苷酸,进而合成DNA,这是主要途径。这条途径可被叶酸拮抗物——氨基喋呤(A)所阻断。但如果培养基中含核苷酸“前体”次黄嘌呤和胸腺嘧啶核苷,即便有A存在,细胞通过另一途径(称替代途径或应急途径)也可合成核苷酸。但后一途径需次黄嘌呤鸟嘌呤磷酸核糖转化酶(HGRPT)和胸腺嘧啶核苷激酶(TK)存在。
一些骨髓瘤细胞系在体培养过程中常常失去生产重链能力,甚至既不生产重链,也不生产轻链。有的还可丧失合成次黄嘌呤-鸟嘌呤磷酸核糖转移酶的能力。但在自然变异中,这种HGRPT(-)细胞在群体中只有百万分之几。如果在培养基中加入8-氮鸟嘌呤(8-AG)或瘤细胞系SP2/0、NS-1和X63/Ag-8(都是人工筛选的8-AG细胞),则在含氨基喋呤(A)的选择培养基中因DNA所有生物合成途径被阻断而死亡,但杂交细胞得到另一亲本(如脾细胞)的HGPRT,则可通过那条应急途径利用次黄嘌呤和胸腺嘧啶核苷合成DNA而得以生存下来。由此,可将杂交瘤细胞筛选出来。
Kohler和Milstein将HGPRT(-)骨髓瘤细胞与经绵羊红细胞免疫的Balb/c动物脾细胞通过仙台病毒介导进行融合,在含次黄嘌呤(H)、氨基喋呤(A)和胸腺嘧啶核苷(T)的选择培养基(HAT)中进行培养。结果未融合的骨髓瘤细胞因无HGPRT和A的阻断而死亡,未融合的脾细胞因不具备连续培养特性也死亡,只有骨髓瘤细胞与脾淋巴细胞形成的杂交瘤细胞因得到HGPRT酶并具备连续培养特性而生存下来。所获得的杂交瘤细胞经过克隆纯化后,具有能稳定分泌抗绵羊红细胞抗体的能力,注射动物能产生肿瘤,其腹水和血清含有高效价的同质抗体。由于该项技术的创立对生物医学做出了重大贡献,作者荣获1984年度诺贝尔生理和医学奖。
(四)单克隆抗体与多克隆抗体的本质区别
如上所述,单克隆抗体是源于一个B淋巴细胞的杂交瘤细胞分泌的针对抗原的同一表位的抗体;而多克隆抗体(简称多抗)是由免疫动物的无数不同的B淋巴细胞分泌的针对抗原不同表位的性质各异的混合抗体。单抗是同质的,多抗是异质的。把握单抗与多抗的这些重要区别,对于正确应用这两类抗体是十分重要的。
二、单克隆抗体技术的发展
自1975年建立该项技术以来,目前已取得新的重要进展,主要是:
(一)融合技术 除用聚乙二醇融合剂外,发展了融合、激光融合和定向融合技术。用FOX系骨髓瘤细胞与Rb8-12Balb/c动物脾细胞融合,存活的杂交瘤细胞均能分泌抗体。有的细胞生长因子可促进瘤细胞生长,在融合和克隆时把它加进培养液中,可不加饲养细胞,并能提高融合率、克隆成活率和阳性率。
(二)发展了异源和非鼠源杂交瘤 用动物骨髓瘤细胞与其他动物(如兔、牛、猪、绵羊等)脾细胞融合,获得异源杂交瘤。但融合率低,稳定性差。近年来报道了鸡和猪骨髓瘤细胞系研究成功,为研究鸡和猪源单抗准备了前提条件。
(三)发展了双特异性抗体 这是两种分泌不同单抗的杂交瘤细胞间融合产生的杂交瘤。其方法是先研制对HAT敏感的亲本杂交瘤细胞,然后与另一杂交瘤细胞融合,筛选。筛选出的杂交瘤分泌的单抗为双特异性。如单抗的一臂结合过氧化物酶,另一臂结合抗原,省去标记酶的过程。
(四)发展了嵌合抗体、重构抗体和小分子抗体 嵌合抗体是应用重组DNA技术对抗体基因进行置换,从而改变原来抗体性质。如用编码HRP或AP酶基因取代鼠单抗C区基因,表达产物既具有抗体活性,又具有酶活性。再如将毒素分子的编码基因与单抗V区基因拼接,表达产物即为免疫毒素,可特异地杀伤靶细胞。重构抗体是将动物单抗中与抗原决定簇互补的结构,即互补性决定区(CDR)基因取代人抗体可变区的CDR基因,表达具有动物单抗特异性的入源抗体。通过DNA重组技术可以得到大小为完整IgGl/3的Fab片段、为完整IgGl/6的只由重链可变区构成的单链抗体以及为完整IgG分子1/12的只有VH区的单域抗体。
免疫球蛋白与抗原的结合主要决定于重链,轻链作用差些。一些不同特异性的抗体的VL区很相似。因此抗体基因库中VH基因与有限数目的VL基因排列组合可以构成任何需要的抗体。抗体基因工程可按人的需要构建新的抗体分子,将从根本上改变领先免疫获得抗体的状况。
三、单克隆抗体的应用
自1975年Kohler和Milstein报道,通过细胞融合建立能产生单克隆抗体的杂交瘤技术以来,这个最基础的具有开创性的理论在生物科学的基础研究以及医学、预防医学、农业科学等领域的广泛的实践,充分显示它对生命科学各领域产生的巨大而深远的影响。由于单抗有着免疫血清或抗体无法比拟的优点,迄今全世界已研制成数以千计的单抗,有的已投入市场,有的正在进行应用考核和深入观察。
(一)在诊断学中的应用 单抗应用最广泛的是诊断,主要用于病原诊断,病理诊断和生理诊断,随着微生物学、寄生虫学、免疫学的研究进展,人类对感染性和寄生虫性疾病有了新的认识,一个病原体存在许多性质不同的抗原,在同一抗原上,又可能存在许多性质不同的属、种、群、型特异性抗原,采用杂交瘤技术,可以获得识别不同抗原或抗原决定簇的单抗,从而可以对感染性疾病和寄生虫病进行快速准确的诊断,同时可以用于调查疾病流行情况,流行毒株或虫株分类鉴定,为病原的防疫治疗提供资料。目前应用单抗诊断试剂诊断的人、畜禽、植物等病毒、细菌或寄生虫病已有上百种,其中乙肝、狂犬病、乙型脑炎等人兽共患病30余种;鸡新城疫、马立克氏、猪瘟等畜禽病20余种;植物病毒病10余种;人、畜禽细菌病20余种;弓形虫、疟疾、旋毛虫等寄生虫病30余种。另外,单抗还成功应用于含量低微的激素、细菌毒素、神经递质的肿瘤细胞抗原的诊断。
(二)单抗应用于临床治疗 用单抗治疗肿瘤是医学界寄予厚望的一项研究,目前已研制了的肿瘤单抗有:胃肠道肿瘤、黑色毒瘤、肺癌等数十种,用单抗可能的治疗途径是采用高亲和并特异的单抗,偶联药物或毒素后(生物导弹)以定向杀伤肿瘤,目前该研究在实验动物中已获得成功,而单独使用单抗治疗人类恶性肿瘤获得成功的例子国外也有报道。使用单抗治疗畜禽传染病,尤其是病毒病如鸡传染性法氏囊,成效十分显著。近年来采用基因工程技术将抗体基因转入植物可以生产大量的单抗,另外具有不同用途的嵌合抗体、人源单抗、重构抗体、小分子抗体的出现,为应用单抗治疗各类疾病拓宽了道路。
(三)单抗是生物学研究的有力工具 目前,单抗已广泛应用于不同学科,其中一部分是为基础理论研究服务的,在病原方面可用于分类、分型和鉴定毒株,可用于探查抗原结构以及用于抗感染免疫机制和中和抗原的研究,结合分子生物学方法,可以确认病毒抗原蛋白的编码基因,基因突变和转译产物的加工、处理、组装过程,从而进一步研制基因重组疫苗。作为一种特异的生物探针,通过单抗的免疫组化定位,研究细胞的生理功能和疾病的病因、发病机制,对激素和受体可采用单抗的免疫分析、免疫细胞的定位,大大促进了激素和受体结构与功能、激素作用机理以及内分泌自身免疫性疾病病因的研究进展,另外单抗已应用于神经系统、血液系统、药理学和系统发育学、畜牧育种及性别控制等学科的研究工作中,从而极大的推动了整个生物学科的发展。
四、试剂的配制
细胞融合和杂交瘤细胞培养用试剂的配制方法如下。
(一)RPMI-1640基础培养液1000ml
![]()
用900ml三蒸水(或无离子水再经过双蒸),通CO2搅拌溶解。称取1.8gNaHCO3,用少量三蒸水溶解,边搅拌边加入RPMI-1640液中。补足1000ml,通过0.22μm滤膜正压过滤除菌(用CO2钢瓶加压),分装,置30℃,菌检48h,4℃存放。有效期不超过3个月。

用时现配,4℃下存放不超过1周,用于细胞融合和克隆化培养的全培养液,可将小牛血清增至20%。
(三)200ml(3%)L-谷氨酰胺溶液
![]()
加热至50℃使全溶,0.22μm膜滤除菌,-20℃保存。
(四)双抗溶液

溶于100ml灭菌三蒸水中,小量分装,-20℃冻存。
(五)筛选小牛血清的方法 取一份生长旺盛的杂交瘤细胞(或骨髓瘤细胞),按有限稀释法用不含血清的培养液稀释成每毫升5个或100个细胞,按每孔0.1m1分种于不含饲养细胞的96孔板中。其中,一部分板孔加待试小牛血清,一部分板孔加已知优良血清,每孔1滴(约0.025ml)。在37℃5%~7% CO2温箱中培养7d左右,计数每孔细胞克隆数并估测群落大小,按克隆细胞的相对成活率和生长速度评价血清优劣。
(六)50%聚乙二醇(PEG)溶液 取约3gPEG(MW l520或4000)放入试管中,加盖包有硫酸纸的棉塞,121℃0.069~0.075MPa,高压灭菌10min。当融化的PEG温度降至41℃左右时,加入等量的1640基础培养液(已预热至41℃左右,并用7.5% NaHCO3调pH至8.2),用温热的吸管吹吸混拌均匀,按0.8ml/支分装在安瓿中,放-20℃冻存备用。
(七)7.5% NaHCO3溶液 取7.5g NaHCO3溶于100ml三蒸水中,0.22μm膜滤除菌,分装小瓶中,4℃保存。
(八)氨基喋呤(A)贮存液 取1.76ml A,加90ml三蒸水,滴加0.05ml NaOH助溶,待完全溶解后,加0.5mllmol/L HCl中和,补足100ml三蒸水,0.22/μm膜滤除菌,分装4ml/瓶,-20℃保存。
(九)次黄嘌呤和胸腺嘧啶核苷(HT)贮存液 取136.1ml H和388ml T,加45℃~50℃三蒸水至100ml,使之溶解,0.22μm膜滤除菌,分装4ml/瓶,-20℃保存。
(十)HT培养液 在完全培养液中按1%加HT贮存液。
(十一)HAT培养液 在完全培养液中分别按1%加A贮存液和HT贮存液。
(十二)8-氮鸟嘌呤贮存液 取200ml 8-氮鸟嘌呤加入1ml 1mol/L NaOH中,溶解后加三蒸水至100ml,0.22μm膜滤除菌,按4ml/瓶分装,-20℃保存。
(十三)8-氮鸟嘌呤培养液 向全培养液中按1%加入8-氮鸟嘌呤,即为含20μg/ml的全培养液。
五、操作方法
(一)抗原制备
选用什么形式的抗原免疫动物?选用什么形式的抗原作筛检抗原?这是研制单抗设计中需要着重考虑的策略。一般来说,免疫抗原越纯,杂交瘤细胞的阳性率越高。某些抗原甚至不提纯,杂交瘤细胞也有相当高的阳性率。应根据研究对象的具体情况和研究目的而定。研制病毒特异性单抗往往经密度梯度离心或层析纯化过的病毒作免疫抗原和筛检抗原。但用粗提或不提纯的病毒抗原免疫动物也能获得成功。如以新城疫病毒浓缩尿囊液或疫苗、马立克氏病毒感染细胞的超声波粉碎抗原、口蹄疫病毒和猪水疱病病毒聚乙二醇或硫酸铵浓缩抗原作免疫抗原、进行杂交瘤试验,均曾获得成功。研制细菌单抗往往用全菌或其裂解物作免疫抗原。研制抗原特定表位的单抗时需精心设计技术路线。如研制羊布氏菌疫苗弱毒菌株特有抗原成分单抗,先分析强弱菌株各种抗原成分,找出抗原,然后通过亲和层析法分离纯化抗原用于免疫和筛检。但是,研制不同型口蹄疫病毒12s抗原的群特异性单抗时,就不采取先分离群特异性抗原的技术路线,而是用一个型(A型)口蹄疫病毒12s抗原作免疫抗原,用另一个型(O型)口蹄疫病毒12s抗原作筛检抗原,获得成功。免疫抗原用鼠组织毒制备,不必精提,因为鼠源杂蛋白与Balb/c动物是同种,应属弱抗原,显然,后者的技术路线比前者的简便得多。
(二)免疫
免疫的目的是为了获得分泌特异性抗体的杂交瘤细胞,并使B细胞在抗原刺激下分化,易于细胞融合,通常选用与骨髓瘤细胞系同系动物进行免疫。如用动物骨髓瘤细胞系,则选用2~3月龄的Balb/c动物;如用大鼠骨髓瘤细胞系则选用Lou/c大鼠。采用什么样的免疫程序取决于具体抗原性状和免疫对象以及要制备什么样性质的单抗而定。但在多数情况下都是参照制备抗血清的常规免疫方法。基础免疫,如病毒抗原,多用福氏腹腔注射无佐剂抗原。一般认为,最后加强免疫采用静脉途径比腹腔好。具体方法:如制备口蹄疫病毒单抗,用福氏完全佐剂抗原,腹腔接种于Balb/c动物,每只20~30μg抗原,4~6周后用同样剂量的无佐剂抗原静脉注射,之后第三天取脾融合。用活毒免疫,方法简便,易获得IgM类中和单抗。如研制口蹄疫病毒单抗时所采用的活毒免疫法为:100LD50的O型口蹄疫病毒活毒,用适当剂量(接种待免疫的同龄动物至致死率为10%左右),腹腔接种90日龄Balb/c动物,之后第7天融合,可获得高滴度IgM类中和单抗。
此外,也有用其他动物的免疫脾细胞与动物骨髓瘤细胞融合,制备异源杂交瘤,生产非鼠源单抗。但这种杂交瘤不够稳定,染色体易丢失。在免疫方法上,还有把抗原直接注入脾内或取外周血淋巴细胞在体外培养中免疫。用这种免疫方法,3天后即可融合。对于来源困难、免疫原性差或对机体有害的抗原可用体外免疫。体外免疫的具体操作方法为:取脾细胞或外周血淋巴细胞制成单细胞悬液,用无血清培养液洗2~3次,然后悬浮于含10%小牛血清的全培养液中,加适量抗原(可溶性抗原一般为0.5~5.0μg/ml,细胞抗原为105~106个/ml),在37℃,5%~7% CO2箱中培养3~5d,即融合。
(三)融合和选择性培养
1.饲养细胞的制备 在HAT培养液中加入饲养细胞可促进融合后杂交瘤细胞的生长。动物腹腔巨噬细胞、正常脾细胞、胸腺细胞均可作为饲养细胞。由于腹腔巨噬细胞清除死亡的能力强,制备方便,故最为常用。具体操作是:在融合前1~2d,取Balb/c动物3~4只,拉颈致死,浸入75%酒精中消毒体表,然后用大头针固定在蜡板上,在无菌条件下小心将腹部皮肤剪一小口(切勿剪破腹膜!),剥离皮肤,暴露腹膜,用10ml注射器将5~7ml预冷的无血清培养液注入腹腔,不拔针头,用弯头镊子夹住针眼处的腹膜,固定针头,封住针口,用另一弯头镊子挤压、揉动腹部约1min,然后吸出注入液体,加入冰浴冷却的50ml尖底塑料离心管中,1000r/min,离心5~10min,弃上清,用10ml无血清基础培养液重悬定容,计数细胞。根据需要留取适量细胞悬液,离心弃上清,用HAT培养液重悬,使细胞浓度为每毫升105~2×105个,加到96孔板中,每孔0.1ml,置37℃CO2培养箱中待用。也可以在融合当天制备饲养细胞,加入HAT培养液中与融合细胞混合物一起分种于细胞板中。活细胞计数方法为:取0.1ml细胞悬液,加0.9m10.4%台盼蓝染液混匀,用血球计数板计数。死细胞为蓝色,活细胞不着色。镜检时,计数板四角大格内细胞数,压线者只计上线和右线细胞。
2.骨髓瘤细胞的培养:维持动物骨髓瘤细胞于最佳生长状态是融合成功的因素之一。这种细胞倍增时间一般为10~16h,在融合前一周内使其保持对数生长期。刚复苏的细胞需2周时间才能达到适于融合状态。融合时需收集2×107个以上骨髓瘤细胞。具体操作为:将细胞培养瓶中液体吸出(或倒出),加入适量无血清基础培养液,用弯头吸管将细胞从瓶壁吹洗下来,用尖底塑料离心管收集细胞悬液,离心沉淀,弃上清,加入10ml无血清培养液重悬,进行活细胞计数。活细胞数应在90%。
为防止在传代过程中部分骨髓瘤细胞返祖,可用含15~20g/ml 8-氮鸟嘌呤的完全培养液定期处理骨髓瘤细胞,使其对HAT呈均一敏感性。
3.免疫脾细胞的制备 取加强免疫后3d的Balb/c动物1~2只,先眶下窦采血,供测抗体用,然后拉颈致死,浸入75%酒精中体表消毒,无菌剥离腹部皮肤,剪开腹膜,取脾,去脂肪和结缔组织,放入约含5ml无血清培养液的平皿中的铜网上,用弯头镊子挤压研磨,使细胞分散在液体中,弃渣,离心沉淀,弃上清,加入10ml无血清培养液重悬,按上述方法计数活细胞。
(四)细胞融合操作程序
1.融合
(1)按骨髓瘤细胞与脾细胞1∶5的比例取两种细胞。一般取约2×107个骨髓瘤细胞和108个脾细胞加入50ml尖底塑料离心管中,混匀。
(2)以1000r/min离心10min,弃上清,倒置灭菌滤纸上吸几次管口残液,然后用手指弹击管底,使沉淀细胞团成松散状,置37℃水杯中预热。
(3)用1ml吸管取0.7ml已在37℃温箱中预热的50% PEG(pH8.0)缓缓滴入含混合细胞的离心管中,边滴边摇动(离心管不离开水面),60s内滴完,然后在水中静置90s。
(4)用20ml注射器取15ml预热的无血清培养液,在2min内向融合管内滴完。开始时慢加,1min后加快,直至滴完。再补加15ml无血清培养液。
(5)以1000r/min,离心10min,弃上清,加入40ml含20%小牛血清HAT全培养液,轻轻吹吸几次,分散细胞,用弯头滴管分装于含饲养细胞的4块96孔板中,每孔0.1ml,盖盖,用胶纸(布)固定。
(6)将培养板置37℃,5%~7% CO2温箱中培养。
2.选择性培养
(1)融合后用HAT全培养液培养7d后,用HT全培养液对培养板中液体进行半量换液。
(2)融合3d后开始镜检,观察是否融合成功,不必天天镜检。
(3)融合后7d左右,逐孔镜检,标出每孔细胞群总数。
(4)当细胞群落已超过显微镜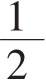 视野大时(培养10d左右),取上清液供抗体检测,同时补加HT培养液。去掉A液后,细胞将恢复叶酸代谢途径。
视野大时(培养10d左右),取上清液供抗体检测,同时补加HT培养液。去掉A液后,细胞将恢复叶酸代谢途径。
(五)杂交瘤细胞的筛选
融合后10d左右,如前所述采集待检样品,进行杂交瘤细胞的筛选。由于在一天内要报告几百个样品的检测结果,且细胞上清液中抗体含量低微、过度生长的细胞转移时成活率低,所以应采用快速、敏感、准确、稳定的筛检方法。以下简单介绍抗体检测技术的操作程序。
1.酶联免疫吸附试验(ELISA) 该法在杂交瘤细胞的筛选和单抗的鉴定中最为常用。根据反应方式不同,可将其分为以下四类。
(1)羊抗鼠或兔抗鼠双抗体夹心ELISA:能识别所有鼠源抗体。凡是分泌鼠源抗体的杂交瘤细胞均可被筛选出来,然后再通过间接ELISA或捕获ELISA或其他特异性检测方法确定目的杂交瘤细胞。如果通过一次融合企图获取不同特异性的两种或两种以上的单抗,或在筛检抗原制备困难而数量有了的情况下研制单抗时,均可采用此法先作初筛,缩小范围,待进一步特异性筛检。
(2)间接ELISA和捕获ELISA:能识别与抗原相对应的特异性抗体。一般用于分泌特异性抗体的杂交瘤细胞的筛选和单抗特异性鉴定。其中捕获ELISA,由于首先用多抗致敏酶标反应板、增强板对抗原的结合能力,因此一般来说它比间接ELISA更稳定和敏感。
(3)液相ELSA:由于抗原和抗体在液相中反应,可以保持自然构型,所有表位处于完好状态,并可与抗体进行全方位反应,其结果与中和反应较为一致,适于中和性单抗的筛选和病毒抗原表位分析。
在进行ELISA试验时,每块酶标板应设阴性和阳性对照。阴性对照可用骨髓瘤细胞上清或其腹水,或用其他单抗上清液或腹水;阳性对照用已建立的杂交瘤细胞上清或其腹水,或免疫动物多抗血清。结果常以P/N≥2.1,或P≥N+3SD公式判定阳性。P代表阳性孔OD值,N代表一组阴性对照孔OD值的平均值,SD代表阴性对照标准差。因细胞上清样品单抗含量低微,检测时不作稀释。
2.免疫酶组化法 主要用于检测针对细胞抗原成分或细胞上病毒抗原成分的单抗。常用间接免疫过氧化物酶试验(IIP)或碱性磷酸酶-抗碱性磷酸酶桥联标技术(APAAP),镜检判定结果。
3.免疫荧光技术 与免疫组化法相似,主要用于各种细胞抗原成分和感染细胞中病毒抗原成分的检测,具有操作简便、敏感,可对抗原成分直观定位等优点,常用于单抗的筛选和鉴定。凡检测针对细胞内成分的单抗,将细胞片经-20℃冷丙酮固定后作荧光染色;而检测针对细胞内成分的单抗,则用活细胞作膜荧光染色。
4.放射免疫测定 在筛选和鉴定单抗时常用固相抗原法,其反应原理与ELISA相似,所不同的是用放射性同位素(如125 I)标记的羊或兔抗鼠抗体代替酶标抗体作指示系统。由于同位素半衰期的限制,操作规程同位素污染对人的危害以及废物处理的困难,一般实验室很少采用。
5.间接血凝试验(IHA) 该法快速、简便、较为敏感、影响因素少,易掌握,也常应用于单抗的筛检。但因敏感性和反应范围的限制,不如ELISA应用广。
(六)杂交瘤细胞的克隆化
融合后必须对阳性孔中杂交瘤细胞进行克隆化,其原因是:融合后阳性孔中的杂交瘤细胞不一定都是目的细胞;一些杂交瘤细胞是不稳定的,可能丢失染色体,丧失产生抗体能力,需不断清除变异细胞;在液氮中长期保存的杂交瘤细胞也有丧失分泌抗体的可能。所有这些情况说明,需对杂交瘤细胞进行连续克隆化,以纯化目的细胞。
最常用的克隆化方法是有限稀释法,操作步骤如下。
1.提前1~2d向96孔板加动物腹腔巨噬细胞,置CO2培养箱中备用,方法见细胞融合操作程序。
2.待克隆化的阳性融合细胞,可先转入24孔板扩大培养后再克隆,也可边扩大边从96孔板取样直接克隆。用吸管将细胞群吹打分散,制成悬液,按前述方法精确计数活细胞数。从96孔板直接取样克隆,计数取样只用1滴悬液,用另一支滴管加无血清培养液9滴作10倍稀释,计数。用HT培养液将细胞稀释至每毫升5、30或50个细胞各40ml;
3.每种杂交瘤细胞用一块备用的含饲养细胞的96孔板,每个稀释度32孔,每孔加细胞悬液0.1ml,每孔应含0.5、3和5个细胞。由于计数和加样的误差,往往偏高或偏低。如从96孔板直接取细胞克隆时,应在克隆完后立即把孔中和稀释管中剩余细胞全部转入24孔中扩大培养,以备失败时重新克隆。
4.在37℃5%~7%培养箱中培养7d左右,镜检,标出所有板孔的细胞群落数。按融合所述方法采样,进行抗体检测。
5.将单克隆阳性的细胞先转入24孔,后在培养瓶中扩大培养,然后冻存。
6.对于新融合的杂交瘤细胞,一般至少克隆2~3次。对于冻存的克隆细胞株,在复苏时,最好同时克隆化,以不断清除变异细胞,保持分泌抗体的稳定性。
(七)细胞的冻存和复苏
1.冻存液 20%小牛血清,10%二甲基亚砜(DMSO),70%基础培养液,混匀,冰浴或冰冷。
2.冻存方法与步骤 收集处于对数生长期的细胞,离心沉淀,按5×106~5×107个/ml的最终细胞浓度,重悬于冻存液中,按每瓶1ml,分装于2ml安瓿中,火焰封口,标上细胞名称、冻存日期,装入布袋中。将细胞置于泡沫塑料容器内,放入-70℃超低温冰箱内,次日取出,立即投入液氮罐保存。或将细胞在4℃放置1h,然后移入液氮罐口,每5min下降2cm,在液氮面上停留30min以上,再浸入液氮中。
3.复苏方法与步骤 从液氮中取出细胞安瓿,放人37℃水浴中,轻轻摇动,当只剩一点冰块时,即取出置冰浴上。打开安瓿,将细胞移入含10ml无血清基础培养液的尖底离心管中,轻轻摇动,离心沉淀,弃上清,用3~4ml全培养液或HT培养液重悬,移入5ml细胞培养瓶中,置37℃,5%~7% CO2温箱中培养。如镜检时死细胞较多,可向培养液中加入最终浓度为104~105个/ml动物腹腔巨噬细胞。
(八)单克隆抗体的生产
单抗分体内生产法和细胞培养生产法,在一般实验室条件下,体内生产法最为常用。
1.动物体内生产法 将0.5ml液体石蜡或降植烷注入Balb/c动物腹腔;7d后每只动物腹腔接种0.2ml计5×105个细胞;5d后每天观察动物腹部,当用手触摸时皮肤有紧张感时,即用16~18号针头采集腹水,如采2~3次,每只可采5~10ml腹水,抗体含量为每毫升1~5mg左右;离心管去细胞和其他沉淀物,收集上清,测定效价,分装,-70℃存放。纯化前,膜滤或高速离心再次除渣。
2.细胞生产法 一般实验室制备单抗常用单层培养法。当细胞密度为1×106~2×106个/ml时,上清中的单抗体浓度为10~50μg/ml,所以大量生产单抗必须提高细胞密度。目前用于大量生产的是悬浮培养和细胞固定化培养两大类,请参阅有关文献。
(九)杂交瘤技术操作中应注意的主要问题
1.对所用的骨髓瘤细胞的使用历史要清楚,一定是没有污染的曾获得高融合率的可靠细胞。融合时,骨髓瘤细胞要处于最佳生长状态。
2.用于融合的主要试剂,如聚乙二醇(PEG)、胸腺嘧核苷(T)、次黄嘌呤和小牛血清的质量要可靠,特别是小牛血清和PEG,就是同一厂家不同批次产品的质量差异也影响融合的培养效果。在实验室中一定要贮备经过融合考验的主要试剂。对每批小牛血清都要作细胞生长试验。
3.配液用的水质好坏也是一个重要问题。一般来说,无离子水再经双蒸或三蒸用于配制各种液体是没有什么问题。
4.在进行杂交瘤试验之前,要调好培养箱温度、CO2浓度,使其稳定,并保持饱和湿度。
5.严格无菌操作对搞好杂交瘤技术是至关重要的。一切用于培养的液体均需十分可靠。各种培养液的包装尽量要小。同一包装的液体最好一次用完,不能多次重复使用。每次使用的剩余液体要放在37℃温箱菌检。
大多数杂交瘤实验室的问题的发生在污染和血清质量两个方面。只要这两个方面多加注意,一般都较顺利。
(十)单抗的鉴定
在杂交瘤细胞建株时,要对每种单抗的特异性、同质性和理化性质等进行鉴定,以便应用。
1.特异性 单抗具有抗原表位特异性。在免疫动物过程中,抗原在机体有多少个表位暴露出来,就应产生多少种单抗。一个复杂抗原往往有株、亚型、型和属特异性表位,有的还存在属间交叉表位。相应地,单抗也应有上述特异性之别。病毒表位有中和和非中和之分,相应地,单抗也有中和及非中和单抗。不同抗原表位属于不同抗原成分之上,决定免疫学反应性质。如针对新城疫病毒HN糖蛋白N端抗原表位的单抗具有较强的血凝抑制反应能力,而针对核衣壳蛋白抗原表位的单抗就没有血凝抑制能力。鉴定单抗特异性,应根据不同目的,采取不同方法。欲鉴定单抗是株间、型间和属间特异性,需收集不同型和同一型的不同毒(菌)株以及类属病毒(菌),通过血清学方法(如ELISA),观察与之反应的程度,确定特异性范围。一般通过中和反应鉴定单抗是否具有中和反应能力。要明确单抗的靶抗原是哪种成分,往往通过免疫印迹法或放射免疫沉淀法。
2.同质性 单抗的同质性(即单克隆性)主要指免疫球蛋白重链和轻链类型单一性、电泳均一性和杂交瘤细胞染色体数目等性质。
(1)重链和轻链类型:鉴定单抗重链和轻链类和亚类不仅可阐明单抗的同质性,而且确定单抗重链的类和亚类也有助于提纯方法的选择和了解其参与不同的免疫学性质的能力。单抗最常见的是IgG和IgM类,IgG又分为Gl、G2a、G2b和G3四种亚类。鉴定单抗类和亚类时,通常采用琼脂扩散法。先将杂交瘤细胞上清单抗浓缩20~30倍,与抗动物类和亚类血清反应,观察沉淀线。也可不浓缩上清液,用抗动物类和亚类抗体的酶结合物,通过ELISA鉴定。鉴定动物轻链是λ链还是k链的方法与上述鉴定重链的方法相同,也是通过免疫扩散试验或ELISA来确定。
(2)电泳均一性:通过聚丙烯酰胺凝胶电泳(PAGE)、SDS-PAGE、等电聚焦电泳及免疫电泳等均可鉴定单抗的均一性。
3.理化特性 明确单抗在温度、pH值变化的稳定性和与抗原的亲和力对应用十分重要。一般来说,纯化的单抗,在56℃加热5min,即失去活性。而未纯化的腹水和血清单抗以及纯化的多抗,56℃灭活后,活性没有明显变化。单抗经反复冻融,明显丧失活性。加等量甘油,置30℃,因不冻结,保存一年以上活性不变。纯化的单抗在pH6.0~8.0下稳定,pH9.0~10.0活性明显降低。但多抗活性在pH6.0~10.0不变。
不同单抗亲和力不尽相同。一般通过竞争ELSA测定亲和常数,以比较不同单抗相对亲和力的大小。其操作步骤如下。
(1)取适宜浓度的纯化抗原包被酶标板,100μl/孔,4℃过夜。
(2)洗涤后加封闭液(0.5% BSA-PBS,pH7.2),100μl/孔,37℃,1h。
(3)取一定浓度的纯化待检单抗与系列倍比稀释抗原混合,4℃过夜,使反应达到平衡(抗原浓度要过量)。
4.洗涤后将平衡后的抗原-抗体混合物加入酶板孔中,100μl/孔,37℃,1h。
5.洗涤后,加HRP标记的抗动物第二抗体,100μl/孔,37℃,1h。
6.洗涤后加底物(OPD)溶液,100μl/孔,37显色15min,2mol/L H2SO4终止反应,于495nm波长测定各孔吸收率(A)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














