任务二 植物脱毒的原理与方法
一、植物脱毒的原理
(1)植物病毒本身不具有主动转移的能力:在一个植物体内,病毒容易通过维管系统而移动,但在分生组织中不存在维管系统。病毒在细胞间移动只能通过胞间连丝,速度很慢,难赶上活跃生长的茎尖。
(2)在旺盛分裂的分生细胞中,代谢活性高,竞争抑制了病毒的复制。
(3)在植物体内,可能存在着病毒钝化系统,它在分生组织中比其他任何区域具有更高的活性。
(4)在茎尖存在高水平内源生长素,也可能抑制病毒的增殖。
二、植物脱毒方法
(一)茎尖培养脱毒
1.通过茎尖培养脱毒的原理
(1)病毒在植物体内的分布:植物体内部位不同,病毒浓度也不同,离尖端越远病毒浓度越高。茎尖、根尖顶端分生组织病毒浓度低,甚至不带病毒,并且茎尖、根尖无维管系统,病毒无法运动。
(2)茎尖大小与脱毒效果:茎尖外植体的大小与脱毒效果成反比关系,茎尖越大,脱毒效果越差。茎尖分生组织不能合成自身需要的生长素,但下部叶原基可以提供,因而带叶原基的茎尖生长快,成苗率高。顶端分生组织即生长点(最大直径0.1 mm),也可以是带1~3个幼叶原基的茎尖(0.3~0.5 mm),最适合作外植体,脱毒效果最好。
2.茎尖脱毒方法
(1)取样与消毒:可直接在选定的植株上采顶芽与侧芽进行消毒接种。消毒方法是剪取顶芽梢段或侧芽3~5 cm,剥去大叶片,用自来水冲洗干净,在75%的酒精中浸泡30 s左右,再用1%~3%的次氯酸钠或5%~7%的漂白粉溶液消毒10~20 min,最后用无菌水冲洗材料4~5次。
(2)茎尖剥离与接种:在双筒解剖镜下,用解剖刀尖剥去幼叶,露出生长点后,用刀尖切下带1~2个叶原基的生长点(0.3~0.5 mm),再用解剖针将切下的茎尖转接到培养基(一般通常采用半固体培养基,多选用MS、White和Morel培养基,培养基中加入IAA、NAA、KT或椰乳,适当配合GA可促进茎尖外植体的生长与分化,而应避免使用2,4-D)上,顶部向上,每个试管可接1~2个茎尖。茎尖培养最好采用液体培养中的纸桥培养方法,利于外植体的通气、生根,并能消除固体培养基琼脂中杂质对茎尖生长和脱毒效果的不利影响。为防止茎尖失水,需用无菌水润湿滤纸。操作时注意随时更换滤纸和接种工具,剥取茎尖时切勿损伤生长点。
(3)培养:温度控制在(25±2)°C;湿度控制在70%~80%;光照控制在10~16 h/d(光照度为1 500~5 000 lx);60 d左右,大茎尖再生出绿芽,0.1~0.2 mm的小茎尖则需90 d以上,期间应更换培养基,提高6-BA浓度,可形成大量丛生芽。
(4)生根诱导:将2~3 cm的无根苗转入生根培养基(1/2MS+IBA 0.1~0.2 mg/L)继续培养1~2个月即可生根。
3.影响脱毒效果的因素
(1)母体材料病毒侵染的程度:只被单一病毒侵染的植株脱毒较容易,而复合侵染的植株脱毒较难。
(2)起始培养的茎尖大小(见表6-2和6-3):一般取不带叶原基的生长点培养脱毒效果最好,带1~2个叶原基的茎尖培养大约可获得40%的脱毒苗,而带3个以上叶原基的茎尖培养一般获得脱毒苗的频率就大大降低。通过二次茎尖培养,脱毒率可达100%。
表6-2 茎尖大小对马铃薯脱毒效果的影响
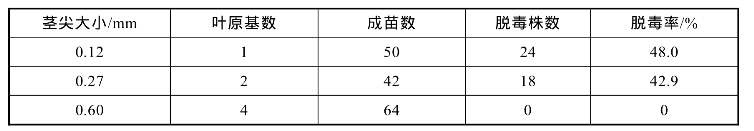
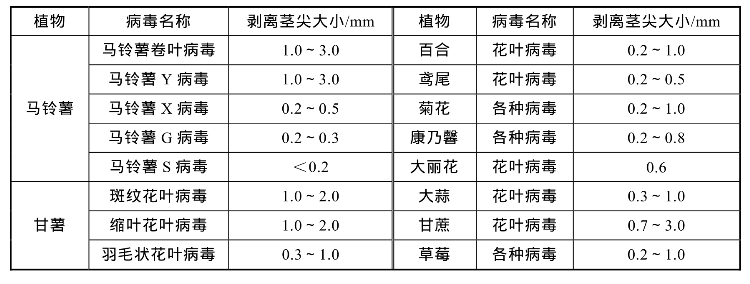
表6-3 用于脱毒的适宜茎尖大小
(3)外植体的生理状态:一般来讲,顶芽的脱毒效果比侧芽好,生长旺盛季节的芽比休眠或快进入休眠的芽的脱毒效果好。另外,还应防止脱毒苗再度感染病毒。
(二)热处理脱毒
1.热处理脱毒原理
热处理并不能杀死病毒,但一些病毒对热不稳定,在高于常温的温度下(35~40 °C)钝化失活,使病毒在植物体内增殖减缓或增殖停止,失去传染能力。热处理作为一种物理效应可以加速植物细胞的分裂,使植物细胞在与病毒繁殖的竞争中取胜。
(1)温汤浸渍处理脱毒法:材料置于50 °C左右热水中浸渍几十分钟到数小时。其特点是简单易行,成本低,但易使材料受伤,适用于甘蔗、木本植物和休眠器官的处理。
(2)热空气处理脱毒法:将植物用35~40 °C的热空气处理2~4 周或更长时间。其特点是损伤较小,操作简便,但需严格控制温度和时间,适用于大多数植物。
(3)热处理结合茎尖培养脱毒法:目前常采用将热处理和茎尖分生组织培养结合起来脱毒的方法。其特点是既可缩短热处理时间,提高植株成活率,又可剥离较大的茎尖,提高茎尖培养的成活率和脱毒率。适用于大多数植物,并可除去一般培养难以去除的纺锤块茎类病毒。
2.热处理脱毒的优缺点
(1)优点:方法简单,效果明显。
(2)缺点:① 具有局限性,不能去除所有病毒,只对圆形病毒(苹果花叶病毒)或线状病毒(马铃薯卷叶病毒)有效,而对杆状病毒(千日红病毒)无效;② 热处理后只有小部分植株能够存活,极易使植物材料受热枯死,造成损失;③ 延长热处理时间,病毒钝化效果好,同时也可能会钝化植物组织中的抗性因子而降低处理效果。
(三)愈伤组织培养脱毒
将感染病毒的组织离体培养获得愈伤组织,再诱导愈伤组织分化成苗,从而获得无病毒植株的方法,即愈伤组织培养脱毒法。经过多次继代的愈伤组织中病毒的浓度下降,甚至检测不出病毒。
部分愈伤组织细胞不带病毒可能有以下两方面的原因:一是愈伤组织细胞分裂增殖速度快,而病毒复制速度较慢,赶不上细胞的繁殖;二是愈伤组织发生了抗病毒突变。
(四)珠心胚培养脱毒
柑橘类种子为多胚种子,除具有合子胚外还有珠心胚,病毒一般不通过种子传播,故通过珠心胚培养获得的再生植株无病毒。珠心胚培养对柑橘鳞皮病、速衰病、裂皮病、脉突病等十分有效。
【知识拓展】
柑橘珠心胚培养:取花后约7周的幼果胚囊,接种在(25±2)°C黑暗条件下培养30 d,再转光培养,光照时间12 h/d,光照度为1 000 lx。3~4周发生球形胚和愈伤组织,9~10周分化子叶,苗高3 cm左右移植到营养钵蛭石基质中培养,7周左右移栽到土中。
(五)微尖嫁接脱毒
微尖嫁接脱毒是指在人工培养基上培养实生砧木,嫁接无病毒茎尖(0.14~1.0 mm,带3~4个叶原基),以培养脱毒苗的技术。微尖嫁接脱毒主要应用于茎尖脱毒培养生根困难、不能形成完整植株的柑橘、苹果、桃等。茎尖来源主要有成年无病毒植株的茎尖、热处理(应用最广)或温室培养植株的茎尖、脱毒试管苗茎尖等。
微茎尖脱毒的主要程序:无菌砧木培养→茎尖准备→嫁接→嫁接苗培养→移植。
(1)砧木培养:新鲜果实种子去种皮后接种于MS无激素的培养基上,在(25±2)°C黑暗条件下培养2周,再转光培养。
(2)茎尖准备:茎尖取热处理的植株茎尖,消毒和剥取同“茎尖培养脱毒”。
(3)嫁接:取砧木,切去过长的根,切顶留1.5 cm左右的茎。在砧木附近顶处一侧切一“U”形切口达形成层,用刀尖挑去切口部皮层。将茎尖移置砧木切口部,茎尖切面紧贴切口横切面。
(4)嫁接苗培养:一般采取液体纸桥培养。先在纸桥中开一小孔,将砧木的根通过小孔植入液体培养基,按常规光照培养管理。开始低光照(光照度为800~1 000 lx),长出新叶后提高光照度。
(5)移栽:培养3~6周,当有2~3叶时按一般试管苗移植的方法移入蛭石、河沙、椰壳等基质中培养。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















