课堂笔记
一、硝基化合物的结构、命名和物理性质★

硝基化合物的命名与卤烃相似,以烃为母体,硝基为取代基。
硝基化合物极性较大,沸点较高,大多数有毒。
二、硝基化合物的化学性质★★
1.α-H酸性及与羰基化合物的缩合反应
(1)成盐:
(2)互变异构:

假酸式的存在使硝基化合物有烯醇式特征(如能与FeCl3显色,与Br2/CCl4加成等)。
(3)类羟醛缩合:
(4)类酯缩合:

2.硝基对芳环的影响 硝基使邻对位卤原子的活性增强,硝基越多亲核取代反应越容易,示例如下。

硝基使邻对位甲基氢原子酸性增强,如在3个硝基影响下,能发生缩合反应。

硝基能增强酚和芳酸的酸性,减弱芳胺的碱性。由于硝基在间位时只考虑-I效应,在邻对位时既有-I效应又有-C效应,所以硝基对邻对位的影响比对间位的影响更大些。
3.硝基的还原 硝基易被还原,反应条件不同其还原产物可能就不同。

此外,SnCl2/HCl,H2/Ni,LiAlH4也可将硝基还原成氨基。
三、胺的分类、结构和物理性质★
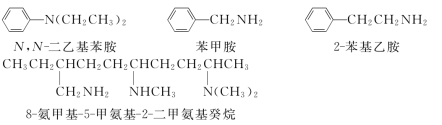
1.分类 根据氮原子所连烃基的种类不同,胺可分为脂肪胺和芳胺(氨基连在链烃基上是脂肪胺,直接连在芳环上才是芳胺)。根据氮原子所连烃基的数目不同,将胺分为伯胺(1°胺,RNH2)、仲胺(2°胺,R2NH)和叔胺(3°胺,R3N)。可见胺的伯、仲、叔意义与醇的伯、仲、叔意义不同,后者是按羟基所连碳原子的种类分为伯、仲、叔醇。
2.结构
3.物理性质 伯、仲胺因能形成分子间氢键,其沸点比分子量相近的烃类等要高,但比分子量相近的醇和羧酸要低(氮比氧电负性小,形成氢键能力差些);具有同分异构的伯、仲、叔胺,其沸点依次降低。伯、仲、叔胺都能与水形成氢键,因此低级胺易溶于水,随分子量增加,水溶解度减小。
四、胺的命名★★★
1.普通命名法 烃基名称+胺,烃基相同时合并,烃基不同时先简单后复杂。

2.系统命名法 脂肪胺选择最长碳链的烃基加氨基作母体称某胺,氮原子上的其他烃基作取代基,用N定位。芳香仲胺和叔胺则以芳胺为母体,脂肪烃基为取代基。复杂胺也可以烃为母体,氨基或取代氨基作取代基。

五、胺的化学性质

(2)碱性比较
①不同类含氮化合物:胍,季铵碱>脂肪胺>氨>芳香胺>酰胺>酰亚胺。
②脂肪胺:仲胺>伯胺、叔胺(水溶液中,主要受电子效应和溶剂化效应影响)。
叔胺>仲胺>伯胺(非水溶液中,主要受电子效应影响)
③芳香胺:C6H5NH2<C6H5NHCH3<C6H5N(CH3)2(N上连烷基越多碱性越强)。
C6H5NH2>(C6H5)2NH>(C6H5)3N(N上连芳基越多碱性越弱)
④取代芳胺:
A.邻位取代:无论是给电子基还是吸电子基,大多使碱性减弱(存在邻位效应)。

B.间位取代:给电子基使碱性增强,吸电子基使碱性减弱(只有诱导效应)。
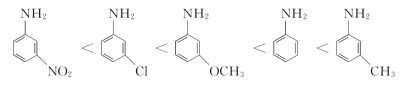
C.对位取代:给电子基使碱性增强,吸电子基使碱性减弱(诱导效应和共轭效应)。

2.烃基化反应★★

芳胺亲核性较弱,由芳伯胺可制备芳仲胺

。
3.氧化反应★ 胺易被氧化,胺的类型不同或氧化剂不同,氧化产物可能就不同。
4.酰化和磺酰化反应★★★
(1)酰化反应

酰化可降低某些药物毒性。
酰化可保护氨基防止氧化。

(2)磺酰化反应
该反应称为兴斯堡(Hinsberg)反应,可用于鉴别或分离提纯伯、仲、叔胺。
5.与亚硝酸反应
(1)脂肪胺与亚硝酸反应★

(2)芳胺与亚硝酸反应★★★

该反应可用来鉴别伯、仲、叔胺。其中,芳伯胺与亚硝酸的反应称为重氮化反应。

6.芳胺芳环上的取代反应★★★
(1)卤代反应:氨基是强活化基团,所以发生多卤代。

若要制备一卤代产物,需要先进行酰化降低氨基的活化能力,然后再卤代,示例如下。

(2)硝化反应:氨基极易被氧化,因此不能直接用强氧化剂硝酸硝化,应对氨基先保护,然后再硝化制备邻对位产物。制备间位产物则需先将氨基成盐转变成吸电基,然后再硝化。
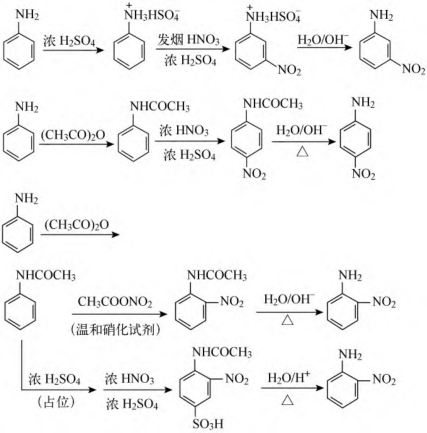
(3)磺化反应

7.烯胺及其在合成中的应用★

通过烯胺的烷基化或酰基化,可在原酮的α-碳上引入烷基或酰基,示例如下。

六、胺的制备★★
1.氨或胺的烃基化 适于制备芳胺
![]()
。
2.硝基化合物的还原 制备伯胺。

3.腈、酰胺及其他化合物的还原 可用于制备多种胺类。
4.霍夫曼降解 制备少1个碳的伯胺。
![]()
5.加布瑞尔合成法 制备纯净伯胺。

七、季铵盐和季铵碱
1.命名★★★ 按无机铵盐和无机铵碱的形式命名,称为某酸(化)某铵,氢氧化某铵。
![]()
2.季铵盐的性质与制备★ 季铵盐多为白色晶体,易溶于水,不溶于非极性有机溶剂,熔点较高。

3.季铵碱的制备与性质★★★ 季铵碱为无色结晶,溶于水,在空气中易吸收水分和二氧化碳。季铵碱是强碱,其碱性与氢氧化钾相当。季铵碱通常用季铵盐和氢氧化银来制备。
![]()
(1)季铵碱受热分解反应
①无β-H,发生亲核取代反应:
![]()
②有一种β-H,发生消除反应,生成烯烃和三甲胺。示例如下。
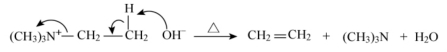
③有2种或以上不同的β-H,大多遵守霍夫曼消除规则,即优先消除含β-氢较多的碳上的氢或优先生成双键碳上烷基较少的烯烃。示例如下。

当β-碳上连有苯基、羰基、乙烯基等能形成共轭体系的基团时,可不遵守霍夫曼规则,以生成具有共轭体系的稳定产物为主。示例如下。

(2)霍夫曼消除反应的立体化学:霍夫曼消除反应主要按E2机制进行(即被消去基团处于反式共平面位置)。但也有例外情况,对于刚性桥环或有控制构象基团使得环无法翻转时,就只能顺式消除,但产率较低。
(3)霍夫曼消除反应在推测有机化合物结构中的应用
①将胺与足够量的碘甲烷作用,使氮原子上的氢均被甲基取代,生成季铵盐,这称为胺的霍夫曼彻底甲基化。伯、仲、叔胺需要碘甲烷的数量分别为3mol、2mol、1mol,示例如下。
![]()
由消耗碘甲烷的摩尔数可推测胺的类型。
②所得到的季铵盐用湿的氧化银处理转化为季铵碱,季铵碱再受热分解得到叔胺和烯烃。由烯烃结构可推测原胺分子中的烃基结构。
例如,某胺经历了两次彻底甲基化、成碱、霍夫曼消除的过程,最后得到1,4-戊二烯和三甲胺,已知在第一次彻底甲基化时消耗2mol CH3I,那么原胺的可能结构有以下两种。

推测理由是此胺经两次彻底甲基化最后得到二烯烃和三甲胺,说明是环胺;在第一次彻底甲基化时消耗了2mol CH3I,说明是仲胺。由此可推测出符合条件并稳定存在的胺有上述两种可能结构。
八、重氮化合物和偶氮化合物
官能团(—N2—)只有一端与烃基相连的称为重氮化合物;官能团(—N2—)两端均与烃基相连的称为偶氮化合物。
1.命名★★★

2.芳香重氮盐的反应及其在合成中的应用★★★

以上3个反应统称为桑德迈尔(Sandemeyer)反应。
用铜粉代替亚铜盐进行上述反应,则称为加特曼(Gatterman)反应。
![]()

重氮盐的取代反应在有机合成上有着重要的应用,利用这些反应可制备那些在芳环上无法直接进行取代的化合物,如由苯合成1,3,5-三溴苯。

(2)偶联反应(或称偶合反应):重氮盐是弱亲电试剂,需要与具有强供电基的酚或芳胺发生偶合。反应服从亲电取代反应的定位规律,主要在对位偶合,如对位被占据,则在邻位偶合。

以酚为例,不同酚的偶合位置如下。

(3)还原反应

重点难点提示
1.胺类化合物的碱性比较。
2.胺的酰化、磺酰化、与亚硝酸反应,伯、仲、叔胺的鉴别。
3.芳胺的亲电取代反应及氨基的保护和脱保护。
4.季铵碱的消除反应及霍夫曼消除规则。
5.芳香重氮盐的取代反应及其在合成中的应用。
6.芳香重氮盐的偶联反应。
测试及考研
1.单项选择题
(1)下列组合进行偶合反应速率最快的是( )

本题考点:偶合反应实质是亲电取代反应,重氮基对位连吸电基会增强其亲电活性,有利于反应;羟基比甲基供电性强得多,芳环上电子云密度越高越有利于和亲电试剂重氮盐的偶合。
(2)下列化合物哪个不与PhSO2Cl反应( )
A.2,4-二甲基苯胺 B.N,N-二甲基苯胺
C.N,4-二甲基苯胺 D.N,2-二甲基苯胺
本题考点:叔胺不与苯磺酰氯反应。
(3)由苯制备碘苯选择下列哪种方法( )
A.直接在三氯化铝催化下碘代
B.先溴代然后再用碘取代溴
C.依次硝化、还原、重氮化和碘取代
D.依次硝化、重氮化和碘取代
本题考点:碘是弱亲电试剂,碘苯不能用苯直接碘代,需利用重氮盐的碘取代反应得到。
2.比较题
(1)下列化合物碱性由强到弱的排序是
A.氯化四甲铵 B.氢氧化四甲铵
C.三甲胺D.二甲胺
本题考点:季铵碱是强碱,胺是弱碱且仲胺碱性强于伯胺,季铵盐无碱性。
(2)下列化合物碱性由强到弱的排序是( )
A.氨B.苯胺
C.乙胺D.二苯胺
本题考点:脂肪胺碱性强于氨,氨强于芳胺,氮连芳基越多碱性越弱。
(3)下列化合物碱性由强到弱的排序是( )

本题考点:仲胺强于伯胺,芳胺比脂肪胺弱,酰胺是中性化合物。
3.完成下列反应,写出反应的主要产物

本题考点:对重点反应掌握的熟练程度。①霍夫曼消除规则;②偶合反应及定位规律;③仲胺亚硝化;④胺的酰化;⑤重氮盐的形成和取代反应;⑥胺的彻底甲基化及霍夫曼消除。
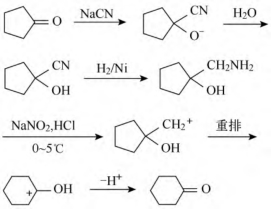
4.完成下列转化并写出反应机制(试剂任选)
本题考点:综合性考察。主要是熟悉通过酮与氰基的增碳反应、脂肪重氮盐的放氮反应、碳正离子重排等实现酮的扩环反应。
5.合成题(无机试剂任性)
由苯和不多于2个碳的有机物合成1,2,3-三溴苯。
本题考点:重氮盐的取代反应在有机合成中的应用。
6.推导结构题
化合物A(C7H7NO2),经Fe/HCl还原得B(C7H9N),B与苯磺酰氯反应生成C,C可溶于氢氧化钠溶液,B与溴水反应主要生成二溴代物D,D用亚硝酸钠的盐酸溶液处理得E,E在次磷酸中加热可生成3,5-二溴甲苯。试写出A、B、C、D和E的结构式。
本题考点:测试综合能力。A能被Fe/HCl还原说明A是硝基化合物,B与苯磺酰氯反应,产物能溶于碱说明B是伯胺。B与溴水反应生成二溴代物说明氨基的邻位或对位有甲基,由最后的产物3,5-二溴甲苯推测甲基在氨基对位,由此推测出A~E的结构。
答案:
1.(1)C;(2)B;(3)C
2.(1)B>D>C>A;(2)C>A>B>D;(3)B>A>C>D
3.

4.
5.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














