酸碱反应的实质是质子的转移。因此,可根据共轭酸碱对之间的质子转移的平衡关系式来计算溶液中的H+浓度。具体方法是:列出溶液中酸碱物质的质子条件式,代入有关酸碱平衡常数和浓度的数据,得出计算H+浓度的精确式,然后在运算过程中根据具体情况进行合理的近似处理,即可得到H+浓度的近似式及最简式。下面简要介绍各类酸、碱溶液的p H计算方法。
4.2.1 一元酸(碱)溶液的p H计算
1.强酸 (碱)溶液的p H计算
强酸、强碱在溶液中全部离解,在一般条件下,p H计算比较简单。
一元强酸HA(设浓度为camol/L)的质子条件式为:
强酸在溶液中完全离解,则 [A-]=ca,代入质子条件式得:
解此一元二次方程得:
上式是计算一元强酸溶液中H+浓度的精确式。
根据具体情况进行合理的近似处理。若ca≥20[OH-],水的离解可忽略,则有:
对于强碱也可采用同样方法处理,得:
2.弱酸 (碱)溶液的p H计算
一元弱酸HA(设浓度为camol/L)的质子条件式与一元强酸相同,即:
利用平衡常数式将上式中各项写成 [H+]的函数,则有:
由 [HA]的分布系数得:
代入式 (4-3)得一元三次方程,即得到计算一元弱酸溶液H+浓度的精确式。此式的数学处理十分麻烦,在实际工作中没有必要精确求解。
若caKa≥20Kw,可忽略式 (4-3)中的Kw。根据离解平衡原理,[HA]=ca-[H+],将其代入得:
这是计算一元弱酸溶液H+浓度的近似式。
若caKa<20Kw,但ca/Ka>500时,酸的离解可忽略,但Kw不能忽略,由式 (4-3)得:
这也是计算一元弱酸溶液H+浓度的近似式。
若caKa≥20Kw,且ca/Ka≥500时,弱酸离解对总浓度ca的影响也可略去,即[HA]=ca- [H+]≈ca。因此可得:
这是计算一元弱酸溶液H+浓度的最简式。实际上,它也是计算一元弱酸p H最常用的公式。
同理,一元弱碱可采用类似方法处理,得到计算OH-浓度的最简式:
【例4-1】计算0.10 mol/L HF溶液的p H。(Ka=6.3×10-4)
解:用条件式判断:caKa>20Kw,ca/Ka<500,用式 (4-4)近似式计算:
则p H=2.12。
【例4-2】计算0.10 mol/L NH4Cl溶液的p H。
解:此为一元弱酸 (NH4+)的水溶液,Ka=5.6×10-10。用条件式判断:caKa>20Kw,ca/Ka>500;可用最简式计算:
则p H=5.12。
4.2.2 多元酸(碱)溶液的p H计算
多元酸 (碱)在溶液中逐级离解,溶液是一个复杂的酸碱平衡体系。以二元弱酸(H2A)为例,设其浓度为camol/L,离解常数分别为Ka1和Ka2。质子条件式为:
[H+]= [HA-]+2[A2-]+ [OH-]
将有关平衡常数代入,可得:
整理后得计算 [H+]的精确式:
若caKa1>20Kw,上式中Kw项可忽略。
上式是计算二元弱酸溶液中H+浓度的近似式,实际上是忽略了二级离解,将二元弱酸按一元弱酸处理。一般对于多元弱酸,只要浓度不太小,各步离解常数差别不太小,均可按一元弱酸处理。
与一元弱酸相似,若ca/Ka≥500,则ca- [H+]≈ca,得到计算二元弱酸溶液中H+浓度的最简式:
【例4-3】计算0.10 mol/L Na2C2O4溶液的p H。
因cbKb1>20Kw, 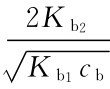 <0.05,cb/Kb1>500,所以用最简式计算:
<0.05,cb/Kb1>500,所以用最简式计算:
则p OH=5.58,p H=14.00-5.58=8.42。
4.2.3 两性物质溶液的p H计算
两性物质 (amphoteric substance)在溶液中有两种离解方式,既可得到质子又可失去质子。两性物质溶液中的酸碱平衡较复杂,计算时应根据具体情况进行近似处理。
1.两性物质溶液
两性物质溶液 (HB)的离解:
两性物质溶液质子条件式为:
[H+]+ [H2B+]= [B-]+ [OH-]
将有关平衡常数代入,整理得精确式:
两性物质的Ka1与Ka2均较小,此时可忽略HB的酸式离解和碱式离解,即 [HB]≈c,代入上式得计算H+浓度的近似式:
若c Ka2≥20Kw,忽略水的离解;若c≥20Ka1,Ka1+c≈c,得计算两性物质溶液的最简式:
两性物质的组成不同,涉及的离解平衡式不同,代入的常数也不同。
【例4-4】计算0.01 mol/L邻苯二甲酸氢钾溶液的p H。
解:邻苯二甲酸氢钾的Ka1=1.1×10-3,Ka2=3.7×10-6。由于c>20Ka1,c Ka2≥20Kw,可用最简式[H+]=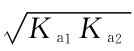 计算:
计算:
则p H=4.20。
【例4-5】计算0.1 mol/L氨基乙酸 (NH2CH2COOH)溶液的p H。
解:在水溶液中,氨基乙酸 (双极离子)的离解平衡为:
因浓度较大,即c Ka2>20Kw,c>20Ka1,可采用最简式计算:
则p H=6.06。
2.弱酸弱碱混合溶液
弱酸弱碱混合溶液中p H计算式类似于两性物质溶液。
若溶液中同时有弱酸 (NH4Cl)与弱碱 (Na Ac)的混合溶液时,在水中的质子条件式为:
[H+]+ [HAc]= [NH3]+ [OH-]
将NH4+的离解常数K′a,HAc的离解常数Ka代入式 (4-11),则近似式为:
若c NH+4K′a≫Kw,可忽略分子中的Kw;若c HAc/Ka≫l,可忽略分母中的1,这表明弱酸与弱碱的反应倾向很小,可用各自的分析浓度代替平衡浓度进行计算:
若c Ac-≈c NH+4,则弱酸弱碱混合溶液H+浓度的计算可简化为:
【例4-6】计算含0.1 mol/L NH4Cl与0.1 mol/L Na Ac的混合溶液的p H。
解:HAc的离解常数分别为:
因为c NH+4K′a≫Kw,c HAc/K′a≫1,c Ac-≈c NH+4,故用式 (4-15)计算:
则p H=7.01。
4.2.4 缓冲溶液的p H计算
缓冲溶液 (buffer solution)是一种能对溶液的酸度起稳定作用的溶液。在缓冲溶液中加入少量的酸或碱,或因溶液中发生化学反应产生少量的酸或碱,或将溶液稍加稀释而溶液的酸度不发生显著性变化。
常用的缓冲溶液 (表4-1)是弱酸及其共轭碱或弱碱及其共轭酸、高浓度的强酸或强碱、两性物质等组成的溶液。
表4-1 常用缓冲溶液
注:Tris——三 (羟甲基)氨基甲烷,一般不抑制酶活性,为生物和临床测量中常用的缓冲溶液。
标准缓冲溶液的p H是由精确的实验测定的。作为一般控制酸度用的缓冲溶液,因为缓冲剂本身的浓度较大,对计算结果也不要求十分准确,可以采用近似方法进行计算。
现讨论弱酸 (HA浓度为camol/L)与其共轭碱 (A-浓度为cbmol/L)组成的缓冲溶液。溶液中 [A-]来自两部分:一是弱酸 (HA)的离解,二是共轭碱 (A-)本身,由于溶液中的A-并未提供质子,因此质子条件式为:
[H+]= [OH-]+ ([A-]-cb)
整理得:[A-]=cb+ [H+]-[OH-]
由质量平衡式得: ca+cb= [HA]+ [A-]
合并两式得: [HA]=ca-[H+]+ [OH-]
由弱酸离解常数得到计算缓冲溶液H+浓度的精确式:
当溶液呈酸性 (p H<7)时可忽略 [OH-],上式简化为近似式:
若酸、碱分析浓度较大,即ca≥20[H+],cb≥20[H+]时,得Henderson缓冲公式:
同理,若溶液呈碱性 (p H>7)可忽略 [H+];若ca≥20[OH-],cb≥20 [OH-],也可得到上式。
【例4-7】0.30 mol/L吡啶溶液与0.10 mol/L HCl溶液等体积混合,计算此溶液的p H。
解:
等体积混合后,生成C5H5NH+的浓度为:
则剩余的吡啶浓度为:
吡啶的Kb=1.7×10-9,Ka=Kw/Kb,因此,吡啶与吡啶盐组成缓冲溶液,计算得:
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















