原子与元素
除了原子和空虚的空间,不存在任何东西,别的说法都只是意见而已。
——德谟克利特(Democritus,约公元前460一前370)
当道尔顿沿着曼彻斯特周围的小山坡进行每天的散步时,他戴的宽沿黑帽和穿的深色衣服,与北英格兰的灰暗天空形成强烈对比。随着工业化进程的推进,城市烟囱里冒出来的烟和荒野阴湿的雾相混合,道尔顿小心翼翼地测量了这一天气现象,并且注意到兰开夏郡气候发生的连续变化,他不仅对大气作研究,而且完成了许多实验。在他的邻居看来,他似乎是一个奇怪而孤独的人。但是对于科学来说,这位几乎没受过什么教育、离群索居、特立独行的贵格会信徒却是19世纪初伟大的人物之一,他提出了近代科学最基本的理论之一,这个理论将成为近代化学和近代物理学的基础。
道尔顿享有重建古代原子论的盛誉,他是在1803年一篇论文的结尾时首次提及这一理论,到1826年,他的名声已经广为传扬。这一年,在英国颇负声望的科学家学会——皇家学会——的会议上,化学家、物理学家戴维(我们将在本章后面提到他)声称:

道尔顿发展了原子理论,而首先提出原子论的是古希腊哲人德谟克利特。道尔顿对原子概念的重新审视为19世纪科学家打开了许多前行通道。
“道尔顿先生的不朽荣誉在于,他发现了普遍适用于化学事实的简单原理……从而奠定了未来工作的基础……他的功绩将与开普勒在天文学的功绩并辉。”
然而,道尔顿并非第一个提出这一思想的人。
自然界的基本单位
古人曾经猜测,所有物质都是由几种基本元素构成的。希腊人认为是四种基本物质,他们称之为元素:空气、火、水和土。信仰阿育吠陀哲学的印度人从希腊引进了四元素理论,古中国的道家则提出了相生相克的五行理论,五行者,金、木、水、火、土也。
但是,大多数古代哲学并没有包括原子思想。公元前5世纪有一位希腊思想家名叫留基伯,想知道如果把物质分成尽可能小的粒子会是怎样。例如,如果把一块石头一分为二,然后再一分为二,依次进行,很快(比你想象的要快)就分成了碎屑。你还能把碎屑一分为二吗?能,留基伯回答(尽管据我们所知,他并没有再分)。你究竟能分到什么程度?留基伯想,最终你也许会得到最小粒子,而这一假想的微小物体,小到无法看见,他称之为原子(atom),这是一个希腊字,表示“不能分的”。
他的学生德谟克利特,在留基伯的基础上继续发展原子论,坚持认为原子之间除了虚空没有任何东西,所有事物,包括人的意识 ,都是原子组成的,原子根据 自然定律机械地运动。这些想法今天听起来似曾相识,但是,留基伯和德谟克利特得出这一结论,不是靠实验,而是像希腊人经常做的那样,靠的是推理。后来的阿拉伯科学家拉泽斯也持类似于德谟克利特的原子理论,并且主张是原子构成了四种元素。到了11世纪,印度的科学家发展了一种独特的原子理论,可以两个原子结合成一组,也可以三个结合成一组。
17世纪,胡克认为,容器(如气球)的器壁受到的气体压力,也许是周围原子的随机碰撞引起的。他的同代人波义耳早就认识到,气体也许是理解原子的关键所在(他喜欢把原子叫做“微粒”)。他用一支J形管做的著名实验证明空气可以被压缩。他认为对此的恰当解释可以是这样:气体中的原子平常被虚空远远分开,然而在压力作用下却彼此靠近了。然而,它并没有证明原子的存在,因为其他各种解释对此也能成立。
后来18世纪的科学家发现,水是由氢和氧这两种元素组成(因此水不是元素)。他们还发现了我们现在称之为氧、氮和二氧化碳的气体,他们称之为不同类型的“空气”。当时还发现了其他一些元素,因此古代的元素观(包括元素的数目以及特性)似乎不再有效。但是所有物质都是由数目相对较少的元素组成这一基本观念仍然有效。
然而,原子论起初不被大多数科学家看好。因为两位有影响的希腊思想家柏拉图和亚里士多德并不同意留基伯和德谟克利特的思想。虽然存在少数持异议者,但他们并没有拿出令人信服的实验证据来证明原子的存在。
“新化学”
因此,早在道尔顿出场之前,原子论已经存在很长的时间,但从未有人找到一条途径来提供实验事实,证明这一不可见的基本单元确实存在。也从未有人找到一种方法来解释迄今已知不同物质所具有的不同化学特性。
然而,来自其他方面的途径为化学奠定了基础。拉瓦锡、普里斯特利和布莱克证明,化学也和物理学一样,测量方法至关重要。主要通过在实验前后的称重,他们得到了定量的实验结果,并且证明在定量分析的基础上可以建立完善的理论和结论。
拉瓦锡还发展了后来所谓的物质守恒定律——意思是物质不可能创生,也不可能消灭,仅仅可以转变。他还提出,化学元素就是用化学方法不能再细分的物质。18世纪末,化学家又发现了一大堆以前从不知道的新元素。
但是,只有道尔顿的原子理论才能为这些现象背后的结构提供解释。
道尔顿的原子
年轻时的道尔顿,似乎并未显示出他有震撼科学界的能力。他不是一位伟大的实验家,既无出众才华,也不善辞令,因而他没有机会上“最好”的学校。小学时上的是只有一间教室的学校,但令人惊讶的是,12岁时他接管了这所学校的整个教学。在空余时间,他自学过牛顿和波义耳的书。此后不久,道尔顿开办了自己的学校,但是他讲课欠佳,3年后就关闭了,因为所有的学生都离开了。
道尔顿和当时的许多科学家不一样,他在演讲方面很少取得成功。他带有粗俗的乡村口音,生硬的表达方式少有魅力,因此无法以演讲谋生,只能靠辅导和教学维持生活,同时把所有业余时间都放在科学兴趣上。(每当有人问他为什么不结婚时,他总是冷淡地回答:“我没有时间,我的头脑全是三角形、化学过程和电学实验,哪有时间去想其他事情。”)
他是贵格会教徒,严格遵守穿着简单的宗教习惯,这也许和他的色盲症有关,他只能选暗色服装。
认识道尔顿症
直至成年,道尔顿才意识到, 自己看不到其他人能够看到的颜色。例如,粉红色在他看来是蓝色的,他无法分辨淡粉红色。开始他还以为是别人搞错了。 当他对一些朋友和他的兄弟进行了非正式调查后,这才发现在所有人中,只有他和他的兄弟才会把粉红色、蓝紫色和紫红色看成是蓝色。
是什么原因造成这一差别呢?追求真理的人往往是无畏的,道尔顿要求他的助手朗桑姆(Joseph Ransome, 1841—1918)在他去世后解剖他的眼球,决心要让科学解决这一奥秘(这种症状后来就叫做“道尔顿症”,即色盲)。朗桑姆研究了眼睛里的流体和视网膜,希望能够找到线索,但一无所获。于是,道尔顿的眼球在曼彻斯特文学和哲学学会的照料下,保存在一个容器中。
大约150年后的1995年,一组来自剑桥大学的生理学家得到允许,对于视网膜上三种类型的视锥细胞(正是它们使人能够分辨颜色)进行DNA和基因测试。他们果真在中等波长的光学色素中发现了缺陷,于是道尔顿之谜得到了解决。
道尔顿毅力非凡,做事有条不紊,具有百折不挠的精神和强烈的好奇心。他从1787年起写气象日记,毕生坚持,他对气体的研究作出了好几项贡献,他第一次对原子理论作出了清晰的叙述,这一切都是为了坚持不懈地钻研自然奥秘。
到18世纪末,空气的本质和它的组成仍然有许多未解之谜,道尔顿对此极感兴趣。就在他一生的日常散步中,他就做了几乎200 000次气象观察,最后一次是在他78岁去世的那天。可以说,对气象的研究导致他涉及气体及其组成的研究。
空气大体上是由氧、氮和水蒸气组成的,这已经知道,但是为什么这一混合物有时很难分离呢?为什么更重的气体,氮,不沉在容器的底部,或同样,沉在大气更低的区域呢?道尔顿用一个简单的自制装置,称量了组成空气的不同元素,得出了重要结论。
道尔顿发现,气体混合物的重量等同于各个成分单独测量时重量之和。他这样解释:
“当分别标记为A和B 的两种弹性流体(气体)混合在一起时,它们的粒子相互间没有排斥力;A粒子之间互相排斥,但不排斥B粒子。 因此,作用于任一粒子上的压力或总重,完全来自与它相同的粒子。”
这就是所谓的道尔顿分压定律(1801年发表),这一说法基本上可以归结为如下的思想:混合物中的不同气体相互不受影响。或者:气体混合物的总压强是每种气体单独存在时的压强之和。道尔顿当然知道波义耳对气体的工作,这一新的信息显然更明确地指向这样的想法:气体是由看不见的微粒组成的。
但是他继续往下想这个问题。是不是所有的物质——不只是气体——都是由这样的粒子组成的呢?普鲁斯特(Joseph Louis Proust, 1754—1826)在1788年曾经指出,物质往往以整的单元组合。也就是说,化合物能够以4:3或者以8∶1的比例结合。但是,化学反应却不会按,比如,8.673克氧和1.17克氢的比例进行。一种方式可以解释这一所谓的定比定律,就是假设每种元素都是由微粒组成,为了尊重德谟克利特,道尔顿把这种微粒称为“原子”。(这个名称有点混淆,因为我们现在知道,道尔顿当然不会知道,原子并不真是“不可分的”。它们也是由看似不可分的更微小的粒子组成的。正因为这个原因,现在许多科学家宁可把道尔顿的原子称为“化学原子”。)道尔顿还建议,不同化学物质的原子是不一样的,某些早期原子论者也有这样的看法。但是并不像德谟克利特认为的那样,不同物质的原子只是形状上的差别。道尔顿注意到,它们的差别在于重量,他还确定了一个事实,即每种元素都有自己特定的重量。
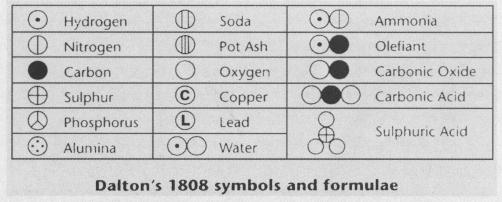
道尔顿给每一个元素设计了一个新符号,按原子量的上升次序排列,原子量是他自己根据以氢原子的原子量为 1的概念计算的。
1803年9月,道尔顿以氢的重量为1作为基础,其他所有元素都是这个重量的倍数,提出第一份原子量表。后来,他又对此表进行扩充,使之包括21个元素。
由于道尔顿的工作,化学家开始认识到存在不同类型的原子,任何一种元素的原子都是相似的,具有与其他元素的原子不同的特殊性质和相对重量。
阿伏伽德罗假说
1802年,盖-吕萨克(Joseph Louis Gay-Lussac, 1778—1850)确定,所有气体在给定的温度增加下,有相同的膨胀率。 [道尔顿也独立地得出了同样的结论,还有一个名叫查尔斯(Jacques Charles, 1746—1823)的人,早在他们两位之前, 已独立提出了上述定律。这一常压下气体具有恒定膨胀率的原理现在叫做查理定律[1], 因为查尔斯最先提出它。]
阿伏伽德罗(Am edeo Avogadro, 1776—1856)在1811年宣布,这条定律必定意味着,(同一温度下)同样体积的不同气体必定含有同样数量的粒子(注意他没有说“原子”)。这一概念就叫阿伏伽德罗假说,在19世纪上半叶掀起了相当激烈的争论。
如果真是这样,为什么一定体积的氧气或氢气的重量是这些气体原子量的两倍呢?(我们现在知道,氧和氢原子在自然界中总是成双地给合于一个分子里——但是在阿伏伽德罗的时代,人们并不知道这一点。)阿伏伽德罗设想,如果使一份体积的氢气和一份体积的氯气相化合,就会得到一份体积的氯化氢气体,而不是你想象中的两份。这是否意味着氢原子和氯原子分离后再相互结合呢?阿伏伽德罗说,不。他假设有些元素也许是原子的结合物, 实际上,他想的是有些气体——包括氧、氮和氢在分子中自然出现时就是由两个原子组成的(O 2,N2, H2) 。[阿伏伽德罗第一个运用分子这个词,意思是“小质量(little mass)” ,在这个意义上,他是第一个区分原子和分子的人。]然而,化学界许多重要人物——包括道尔顿和著名瑞典化学家贝采里乌斯(Jons Jacob Berzelius, 1779—1848) ——都根据相似原子相互排斥的假设反对这一思想。 因此阿伏伽德罗假说被埋没了许多年,直到1858年才最终被人们接受。
道尔顿进一步论证道,看来,两个元素可以化合成不止一种化合物。例如,碳和氧可以化合成今天我们所谓的一氧化碳,还可以化合成二氧化碳。但是,它们是以不同的比例化合,却仍然是整数(按重量,二氧化碳是3 ∶ 4)。道尔顿猜测,一氧化碳也许正好是一个碳粒子与一个氧粒子化合(四个碳粒子的重量等于三个氧粒子的重量)。他估计,二氧化碳则是一个碳粒子与两个氧粒子结合(这个假说后来得到了验证)。这就是所谓的倍比定律,道尔顿于1804年发表。一位名叫希金斯(William Higgins, 1763—1825)的科学家在1789年曾提出过这一思想,但是没有实验证据,直到道尔顿的出现。道尔顿的许多同事对这一定律感到兴奋,因为它使原子理论更容易被人们接受。
道尔顿敢于提出这一想法,是因为他注意到当元素组成化合物时,一种元素的一个或多个原子与来自另一元素的一个或多个原子结合形成一份化合物。例如,一份水总是由一份氧和两份氢组合而成。一份水的重量与两个氢原子加一个氧原子的重量相等。道尔顿测试了几十种化合物,总是得到同样的结果。
道尔顿的原子理论有可能解释各种元素是怎样形成化合物的。他说,原子集合在一起组成其他物质,在这一过程中,它们总是一个与一个,或者一个与两个或更多个,以整数的,而不是分离的方式化合——形成其他物质。
1808年,在《化学哲学新体系》(New System of Chemical Philosophy)一书中,道尔顿发表了这一思想。他声称,原子是化学元素的基本单元,每种化学原子都有自己的特定重量。
他写道:
“物体有三种不同的类型,或者三种状态,即所谓的弹性流体(即气体)、液体和固体,这已得到哲学化学家的注意。一个显著的例子就是水,水作为一种物体,在一定的条件下,就有这三种状态。我们认为,水蒸气是一种完全的弹性流体,水是完全的液体,而冰则是完全的固体。不言而喻,这些观察已经导致这一普遍被接受的结论,即:所有大小可感知的物体,不论是液体还是固体,都是由大量极小的粒子组成的,或者是被一种吸引力束缚在一起的原子所组成,吸引力的强弱视环境而定……”
他继续解释,化学分解和合成只不过是这些粒子的重新组合——把它们相互分开,或者把它们结合在一起。正如拉瓦锡所说,在这一过程中,物质从不会被创生,也不会被消灭。道尔顿宣称:“我们可以产生的所有变化,仅仅在于把处于凝聚或者结合状态的粒子分开,以及把以前分开的再结合在一起。”这些见解就是今天仍然有效。
道尔顿的原子论正是在别人失败之处取得了成功,这是因为他提供了一种能够作出明确预言的模型。当然,他的理论中有些内容后来被抛弃了,但是,其核心内容保存了下来,这就是:每个原子都有特定的质量,在化学反应中元素的原子保持不变。
沿着这条路,道尔顿还引出了其他一些发现。他第一个发表这一结论:当一种气体与另一种气体在同样的温度下被加热至同一温度时,它们的膨胀率相等。他在1794年发表的文章中首次描述了色盲。
1833年,道尔顿的仰慕者和朋友们共同出资为道尔顿建立一座雕像。雕像坐落在曼彻斯特皇家研究所的前面。一些享有盛誉的学会给他荣誉,包括伦敦的皇家学会和巴黎的科学院。1832年,当他获得牛津大学的博士学位时,有幸晋见了英国国王。当时仪式上唯一的问题是要求他必须穿上宫廷服装,还要佩带一把剑,而这就直接违背了他所信奉的宗教的和平主义原则。但是最终他和英国的显贵人士达成了妥协,他可以穿牛津的外套,至于佩剑问题则不必强求。他或许知道,或许不知道,牛津的外套是鲜红色的——仍然与贵格会的习俗相违背。但是在这位色盲科学家看来,外套是灰色的。
道尔顿1844年去世,由于在原子理论和气体行为方面的工作,他受到了人们高度尊重。出殡那天,四万多人排列在街道两旁为他送行,他们再也不能作为学生进入他的课堂了。在道尔顿的一生中,他所取得的成就为19世纪物理学和化学的伟大进展提供了准备。足够幸运的是,他看到了人们对他贡献的认可。
电的连接
我们还会回到化学中原子和元素的传奇故事,不过,现在先到意大利,在博洛尼亚大学生物学教授伽伐尼(Luigi Galvani, 1737—1798)的实验室作短暂停留。这是1771年的夏天,实验室里脏乱不堪,木桌上零乱地放着几十对青蛙腿(据某些记载,可能是用来做一盆汤)。
伽伐尼是解剖学家和医生,不是物理学家。不知什么原因,伽伐尼突然想试试用起电机的火花来刺激蛙腿的肌肉。他发现这时蛙腿会发生痉挛。
伽伐尼这样推理:如果是电火花引起肌肉颤搐,那么就可以用来验证美国科学家富兰克林根据风筝实验提出的假设:闪电也是电。伽伐尼把蛙腿挂在铁栏杆上的铜钩下,准备检验这一假定。当雷电来临时,蛙腿果然颤搐了。但是又发生了这一现象:没有雷电时,蛙腿也会颤搐。伽伐尼发现,只要两种不同的金属同时接触肌肉,颤搐就会发生。
伽伐尼不能断定这一现象的原因。是金属引起颤搐?或者是肌肉,即便是死肌肉,仍然保留某种固有的“动物电”?也许伽伐尼的生物学兴趣导致他倾 向于得出这一想法:蛙腿这样的动物组织也有电力。他在1791年发表了该结果。另一位意大利人伏打看到这一发现后,也开始做这方面的工作,从而导致 了另一场革命。
伏打读了伽伐尼的文章,重复他的实验,又在自己身上做了另外一种实验。他把一片锡箔和一枚银币含在口里——一个在舌尖,一个在舌根,这两块金属是用铜线串起来的。他发现这一装置在他嘴里产生了明显的酸味。他正确地作出判断,酸味表示电荷的存在。
他写道:“值得注意的是,在锡和银相互接触时,酸味就一直存在……这表明电从一处到另一处的流动在不受阻碍地进行。”

伽伐尼研究电如何影响动物神经和肌肉。
他认识到,金属不仅是导体——电实际上就是它们产生的!伽伐尼错了:蛙腿显示的不是动物电,而是金属电。然而,伽伐尼还是起了重要作用,他的实验把人们的注意力引向这个事实,由此戏剧性地打开了研究电的大门。从那时以后的150年中,电成为一种有价值的科学工具,电的工业和商业用途数不胜数。伽伐尼的名字成了人人皆知的用语,例如由于害怕而受到刺激(galvanized by fear);有些用词也与伽伐尼有关,例如镀锌铁(galvanized iron)和电流计(galvanometer,检测电流用的装置)。
1797年,伏打成功地得到了流动的电,它不是当时最容易得到的来自莱顿瓶的静态电。1800年,他给伦敦皇家学会写信,描述了他发明的第一个电池——电流可源源不断地从中产生。
戴维的电化学
在18世纪末,电对每个人都有着巨大的魔力,既包括科学界,也包括大众。人人都在谈论富兰克林用风筝丝线和闪电做的实验,社交名流也喜欢在野餐和聚会中做静电游戏。但是没有一个人清楚地知道自己做的是什么,或者为什么能这样做,部分原因就在于没有连续的电源。
由于伏打发明了所谓的伏打电池后,情况才不一样。伏打的工作不仅打开了探讨电的本性的道路(在理论物理学和工业两方面都产生了辉煌成果),而且为发现新的元素和探讨化学键的本质提供了突破性的工具。
现在我们的故事再回到化学。就在伏打向伦敦皇家学会报告他的发现之后不久,戴维开始思考如何把伏打电池用来解决某些化学问题。戴维,也许最有名的是他发现了两种元素,钠和钾,他还为矿工发明了安全灯。1800年,他(和杨一起,杨的工作将在本编第四章讨论)受雇于皇家研究所,这是一个新建立的研究实验室和教育机构。
戴维是家里5个孩子中年龄最大的,他出生于1778年,是英国康沃尔郡西海岸的判扎斯城一位木雕家的儿子。1794年,年轻的戴维只有16岁,父亲去世,家庭负担只好落在他这位长子身上。于是,戴维在本地一位外科医生那里当了一段时期的学徒工,但是在19岁时他对实验化学、物理学以及相关领域发生了浓厚兴趣。他开始检验拉瓦锡夫妇在《化学基础论》一书中的思想,并得出某些革命性的结论。通过观察冰块的摩擦实验,他断言:热,不像大多数化学家所设想的那样,是“不可称量的流体”,而是运动的一种形式。不幸,戴维太年轻,还有一点粗心大意,对自己的实验结果过于自信。结果,科学界对他的看法相当冷淡,普遍持怀疑态度。对此戴维相当失望。
但是1798年,戴维成了贝多斯(Thomas Beddoes,1760—1808)的助手,贝多斯是多才多艺的化学家和擅长于用气体进行治疗的医生。在贝多斯的布里斯托尔气体研究所,戴维把他自己当做实验对象,就像实验室中的豚鼠那样。他自己制备一氧化二氮(又称为笑气,后来被牙科医生广泛使用),有一天他总共吸入了16夸脱。他后来说,这一天他“完全陶醉了”。他研究了这一气体的生理学效应,于1799年写了一篇详尽的论文,因此而成功地获得作为化学家的名望[还在社会名流中享有盛誉,这些名流中有两位诗人柯勒律治(Samuel Taylor Coleridge,1772—1834)和华兹华斯(William Wordsworth, 1770— 1850),特意到他的实验室里访问,欣赏他发现的“陶醉效应”]。
伏打和电池的诞生
由于伏打电池的发明,开创了19世纪电学的时代。这是第一个能够连续不断提供电流的电源。以前从未有人做过此类研究,全世界的科学家(包括富兰克林在内)对静电已经研究了一个世纪。但是,只要一个火花或一阵电击,静电马上就放完了,而伏打电池却可以持续提供电流。尽管几年内没有发现它的实际用途,但化学家和物理学家很快就把它用作分析物质的工具。
伏打是比萨大学的物理学家,他的最初灵感来自伽伐尼对青蛙的工作,不过他又按自己的想法做了一些实验 由于对“动物电”的说法有怀疑,他对这一事实印象深刻: 只要存在两种不同的金属就会产生电。他还注意到某些金属搭配会产生更厉害的颤搐。 当他把锡箔和银币放在舌头上时,由于舌头主要是肌肉,颤搐不太厉害,但是他却尝到了酸味。这使他猜想,会不会电是经唾液从一种金属传到另一种金属的呢?伏打用许多溶液进行了实验,最后决定用浓盐水。他发现,如果把不同类型的金属片层层堆积,再把这样堆积起来的夹心板浸在浓盐水中,就能得到一个非常有效的电池组(每个夹心板就相当于一个电池)。这就是著名的伏打电池。
它的潜在价值立刻得到了各地科学家的赏识,甚至惊动了法国的拿破仑。拿破仑授予伏打伦巴第地区伯爵和参议员的荣誉(伦巴第是伏打的家乡,不久前被拿破仑征服)。伏打1800年在一封给伦敦皇家学会的信中,赞美了这一发明惊人的简单性。他写道:“是的!我说的这种装置,无疑会使您惊奇,它只不过是一叠按一定方式连接起来的不同种类的导体。”
伏打令人称奇的装置往往被人们称为“伏打电堆”,早在它用于改变家庭和街道的照明方式之前,就已经成为与望远镜及显微镜一样重要的科学仪器。
伏打电池——一叠“三明治”, 由浸润在浓盐水中的两种不同类型的金属片组成。
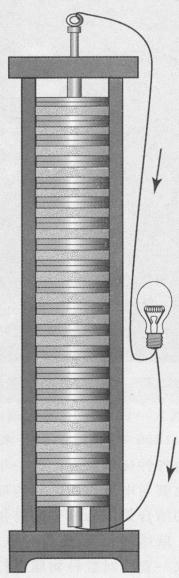
伏打的电池,人称“伏打电池”,是提供连续电流的第一种电源。由于它对人们生活具有深远影响,这一发明无疑是19世纪最重大和最有影响的突破之一。
戴维关于一氧化二氮的科学论文引起了伦福德伯爵的注意,他是美国出生的一位传奇般人物,由于把热看成是一种运动形式,从而在18世纪末激起相当大的争论,因为当时大多数化学家和物理学家认为热是一种叫做热质的不可称量(也就是没有重量)的流体。尽管伦福德(原来的名字叫做汤普森)当时是在巴伐利亚政府任职,但他却打算在英国创建皇家研究所,普及科学,并把科学发现的成果运用到日常生活、艺术和生产之中。伦福德聘请戴维担任第一届实验室主任,这对于年轻有为的化学家来说,是一个极好的机会。
1800年,戴维在离开布里斯托尔去伦敦前,就已有了这一令他感到满意的想法,伏打电池是通过化学反应而产生电,很快他就猜测到,逆效应可能也是正确的,即反过来把电作用于化合物和混合物上,也会产生化学反应。
然而,在接下来的几年里,他在伦敦皇家研究所的职责使他离开了这个课题。为了赚一点钱,研究所开设了一系列高级科普讲座,戴维的魅力和激情使他成为当时最受欢迎的演讲者之一。(奇特的电学表演和一氧化二氮产生的“高潮”也许吸引了更多听众的注意力。)一方面是为了推行科学普及的工作,另一方面也是为了保证有固定的收入,但与此同时,研究所还集中关注农业科学、制革和矿物学,戴维关于这些课题的几篇出色论文,不但给研究所增添了光彩,也给自己提高了知名度。

被公认为电化学奠基人的戴维英俊、文雅、富有魅力。
1806年,戴维的机会来了。在短短5个星期里,他完成了108个电解实验,使电用于产生各种化学反应。这一年他在向皇家学会作的《论电的化学媒介作用》的报告中,提出了电解与电流作用之间的理论联系,对化学反应的电特性首次给出解释。他说,化学上物质的结合是因为原子间有相互吸引的电。
戴维还想到,也许可以用电来分解化合物从而分离出尚未发现的元素。许多年来科学家一直在对数种物质进行研究——石灰、氧化镁、碳酸钾,等等,它们似乎都是金属的氧化物。但是用加热或者其他能够想到的办法,都无法把氧分离出去。戴维在他的报告结尾作出预言,希望“新的分解方法可以引导我们发现物质的真正元素”。
为了试验这一想法,戴维建造了庞大的电池组,用250多块金属片组成,比伏打电池要强大得多。第二年,他用一小块稍稍浸湿的碳酸钾(由植物燃烬后的灰末浸水而得到)做实验,他从电池的负极引出绝缘的电极连在碳酸钾块的一个表面,正极连接另一个表面。这时他注意到,碳酸钾块“处于剧烈的活性状态”。碳酸钾块的两个接触点开始溶化,与正极相接表面释放出一种气体。另一个接触点,不释放气体,却开始生成“具有高度金属光泽的滴状物质”,看上去有点像汞滴,其中的某些在燃烧时会发出明亮的火焰,并且爆炸。戴维马上明白,他发现了一种新元素,他称之为钾。正如他的兄弟约翰在信中描述这个实验时写道,戴维“看到通过碳酸钾冒出了许多钾滴,当它进入大气时起火,他无法克制喜悦的心情,兴奋得在房间里欢呼跳跃,但很快他又使自己镇定下来继续做实验”。
几天后,戴维用同样的方法对碳酸水(现在知道它是氢氧化钠)做实验,结果发现了钠。他的想法得到了证实。与此同时,在斯德哥尔摩,贝采里乌斯和他的同事正在进行类似的实验,双方互有通信往来。贝采里乌斯发现,当他在加入石灰或重土的汞化合物中通入电流时,得到了一种“汞齐”或者某种合金,是其他金属与汞的合成物。这给戴维又一个启示,不出几个月,戴维对贝采里乌斯描述的汞齐(以及其他物质)猛烈加热,结果从中分离出了镁和钙;从一种矿物中分离出了锶 ( strontium,该矿物质产于苏格兰的一个城镇,其名即由此而来);从重土(baryta)中分离出了钡(barium)。戴维以发现众多元素而声名远扬。1810年,戴维在测试一种名叫次氯酸的绿色气体时,发现一种元素,他称之为氯(因为它呈绿色)。
1812年对于戴维来说是重要的一年,这一年他出版了《化学哲学原理》 (Elements of Chemical Philosophy)。很快他又出版了应用性更强的《农业化学原理》(Elements of Agriculture Chemistry)。由于他的成就,1812年4月他被封为爵士,不久娶了富有的苏格兰寡妇阿普勒斯。1813年,他被任命为皇家研究所教授,随即去欧洲旅行,随同的有新婚夫人和不久前选用的年轻助手法拉第。法拉第的故事将在19世纪后半叶详细展开。尽管当时英国与法国正在交战,但正如戴维所说:“科学家之间永远没有战争。”拿破仑欢迎戴维的访问。在这期间,戴维和法拉第访问了欧洲大陆的许多著名科学家。对于法拉第来说,这次旅行使他有幸领略科学前沿的风貌。
1820年,戴维成为皇家学会会长,开始研究船底铜罩的防腐蚀方法,但是他开始健康不佳,1823年后长期在瑞士居住,一直到51岁去世。在那里他受到高度尊敬,获得国葬的礼遇。
这一年是1829年,对于化学来说,新的世纪刚刚开始。新的挑战正在前头:为大量出现的新元素理出个头绪,继续寻找更多的新元素,以及弄清与碳元素相结合的一大族分子。所有这些领域的进展不久就会到来。
【注释】
[1]此处作者把查理定律和盖-吕萨克定律混为一谈。一般把盖-吕萨克定律定义为:一定质量的气体,当压强保持不变时,它的体积V与热力学温度 T成正比。即V/T=恒量,而把查理定律定义为一定质量的气体,当体积保持不变时,它的压强p与热力学温度T成正比,即p/T=恒量。——译者注
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















