有关水化学知识读书笔记
一、天然水的化学成分
1.天然水中最主要的成分:Cl+,SO4++,HCO3+,CO3++;Na+,K+,Ca++,Mg++,H+O2,CO2,H2S.
2.形成条件:
①决定于与水接触的物质和溶解度,同时决定于作用进行的条件。
②有化学作用,化学物理作用,生物化学作用,纯物理作用等。
③在间接作用因素中,气候起着最主要的作用。
3.溶解气体:①O2富集条件:空气,光合作用;减少条件:逸出,呼吸。天然水中O2的含量:变动于0~14mg/L。
②CO2;
a.99%以溶解分子形式存在
b.当H+浓度很小时(pH>8.5),CO2含量非常之小,可以忽略不计
c.CO2减少的因素:逸出,溶解碳酸盐,光合作用。
d.天然水中CO2含量由几十分之一至几百mg/L,低含量在海水中,高含量在地下水中。
e、河湖中CO2含量小于20~30mg/L
4、氢离子浓度
①若[H+]=10-7克离子/升PH=-Lg[H+]=7为中性反应
PH>7为碱性PH<7为酸性。[H+]为氢离子浓度
②[H+]决定CO2与HCO3′及CO3″之对比
与CO3″成正比,PH小;与HCO3′成反比,PH大.
③天然水PH值6.5—8.5
④Mg++与HCO3′的近似关系
HCO3′(毫克当量/升)Mg‥
1 (61mg/L) 0.2
2 0.6
3 1.05
4 1.60
5 2.25
6 3.00
5.天然水中的主要离子
①氯离子:氯离子与其他离子比较起来应当放在第一位,变化很大,沼泽水最小,海水最多,最高含量可达170g/L。
一般水中[Cl′]与[Na+]应该大体相等,高矿化水中[Cl′]>[Na+]
②硫酸根离子:
低矿化水中SO4″>Cl′
高矿化水中Cl′>SO4″
干旱地区SO4″可高达数千mg/L
天然水中由于Ca++的存在,而受到限制,一般最高达1.4g/L
一般情况[SO4″]<[Ca++]
③碱金属离子
Na+最多K+很少Na+在阳离子中占第一位,它是表征高矿化水的,反之,含量较少。
K+一般为Na+的4%~10%。
④钙镁离子
Ca‥和Mg++在天然水中仅次于Na+
低矿化水中以Ca++为主,高矿水中以Mg++为主。
天然水中Ca++很少超过1g/L,在高矿化水中Mg++可达数g/L
当矿化度小于500mg/L,Ca++:Mg++→4:1~2:1
当矿化度为1000mg/LCa++:Mg++→2:1~1:1
再大时,Mg++>>Ca++
⑤重碳酸根及碳酸根离子
HCO3′,CO3″是弱矿化水中的主要离子,当溶液呈碱性时,
H2CO3<HCO3′;反之则H2CO3>HCO3′
H2CO3——包含CO2及CO3″二成分
HCO3′含量与H+成反比,当PH值小于4时,HCO3′非常小,甚至可以略而不计。
以Ca++为主的天然水中,HCO3′不多,一般小于250mg/L
Ca++与HCO3′含量成正比。
以Ca++为主的水中,CO3″不会超过几mg/L,PH小于8.3时,CO3″含量可以忽略不计。
H2CO3,CO3″,HCO3′与PH关系。
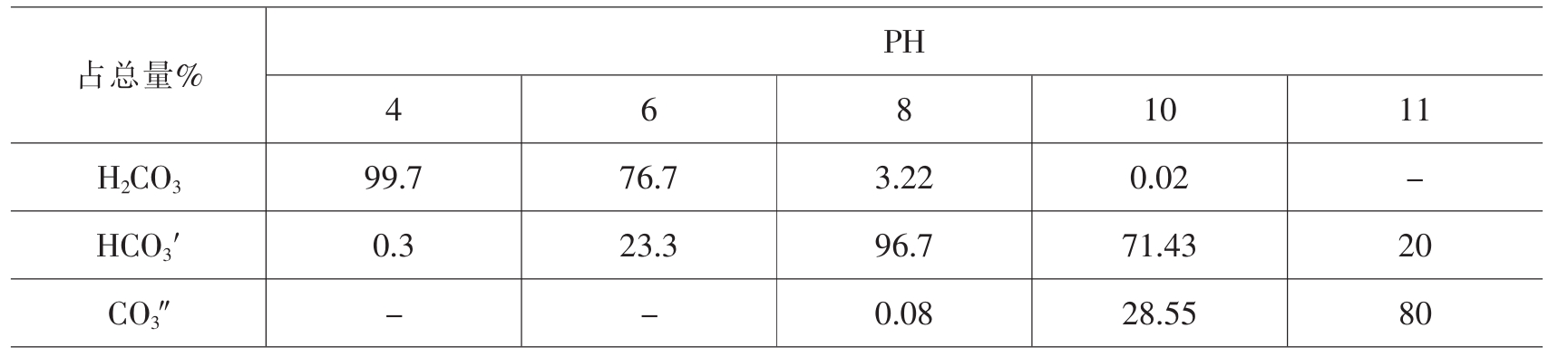
在天然水中,HCO3′可高达180mg/L~240mg/L
⑥硫氰酸化合物
水中有几mg/L,即可有味。
6.生物生成物质
①氮的化合物
NH4′NO2′NO3′
其含量NH4′一般为百分之几mg/L
NO2′百分之几——千分之几mg/L
NO3′含量十分之几~百分之几mg/L
②磷的化合物
HPO4″,H2PO4′,PO4′′′
含量在十分之几——百分之几mg/L
③铁的化合物:Fe++,Fe+++
Fe+++含量十分之几—百分之几mg/L
Fe++一般小于1mg/L
④硅的化合物:H2SiO2,HsiO2′,前者在一般水中含量较后者为多。一般含量十分之几——10mg/L,在弱矿化水中硅占比重较大,不容忽视。
.天然水中的有机物,用干涸残余物与灼热损失法求之。
二、矿化度
指水样加热180℃,蒸烘干后称得之可溶性固体的重量,用S‰表示(g/L),即含盐度。通常用实测离子总量代之。
海水含盐度一般34.5‰,
含氯度——1000g水中所含氯离子的总克数,用Cl′‰表示。一般海水含氯度19.1‰
三、水的分类法
1.按矿化度分类
淡水<1000mg/L 盐化水1—25g/L
海水25—50g/L 盐水>50g/L
2.舒卡列夫分类法;按6种离子的组合来分类,
6种离子为:Na+,Ca++,Mg++;Cl′,SO4″,HCO3′
共分49类
3.O﹒A﹒阿列金分类法:
按阴离子分三类:HO3′+CO3″,SO4″,Cl′
按阳离子分三组:Ca++,Mg++,Na+
按毫克当量对比分三型:第一型:HCO3′>Ca+++Mg++,多为低矿化水。
第二型:HCO3′<Ca+++Mg++<HCO3′+SO4″,属低中矿化水.
第三型:HCO3′+SO4″<Ca+++Mg++或CI′>Na+,强矿化水,地下水属之。
第四型:HCO3′=O为酸性水,在碳酸类水中无此型水。
四、水化学成分在自然界的动态。
1、大气降水
正常平均状况:Cl′;5.46mg/L,SO4″:9.17,HCO3′:18.2,
NO3′:1.70Na.+5.12,Ca++:4.82,Mg++:1.74,NH4′:0.21
计46.4mg/L
偏湿偏冷地区:Cl′:3.62,SO4″:4.66,HCO3′:12.45.Na+:2.30,
Ca++:3.21,Mg++:1.33计27.57mg/L
雪水含量较雨水为小。
2.河水矿化度
①由离子总量划分为四级;
弱矿化水 <200mg/L
中等矿化水 200~500mg/L
强矿化水 500~1000mg/L
高矿化水 >1000mg/L
雪水补给河流矿化度小
②矿化度年变化;主要由地下水补给的枯水期矿化度高;洪不期河水矿化度小。
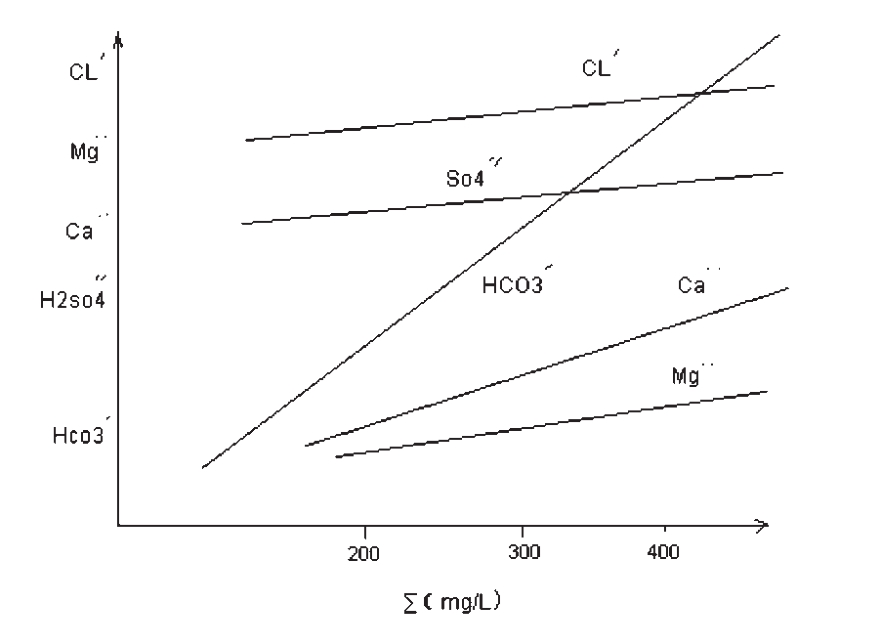
③各种离子之间的关系(比例)
低矿化度时,各离子与离子总量呈直线关系如图,大于500mg/L以上时呈曲线关系。高矿化水中Ca‥含量次于Na.
3.生物生成物动态
①NO3′含量0.1~0.5mg/L(未污染河流)
污染的河水,城市污水,含量5mg/L~10mg/L
②NO2一般含量少得多,0.01mg/L,污染河中增高到0.05mg/L,再高就很少见了。
③NH4′ <0.1mg/L,最高至1mg/L(污染水)
④P <0.05~0.1mg/L
⑤Fe一般<1.0~10.0mg/L
⑥Si2~6mg/L
4.有机物质动态
耗氧量2mg/L~30mg/L,2是极低的,30是极高的。
溶解气体O2:5~10mg/L夏低冬高
CO220mg/L~30mg/L冬高夏低
5.溶质径流
①离子径流:苏联河流的离子径流:计算公式
P=A.m.C M—径流模数 C矿化度
A—换算系数 P离子径流(t/km2)
向大西洋流域平均21t/km2,向北冰洋流域13.4t/km2
向太平洋流域12.1t/km2,里海25t/km2,咸海53.4t/km2.
②河水的平均化学成分在某流域,既定时期内具有一定的恒定性。
③结冰的矿化度,河冰的矿化度一般为河水的1/5,所以苦水河流地区,冬季打河冰,可以解决饮水困难问题。
五、研究水化学成分在实际中的应用
1.饮用水的标准
矿化度:300mg/L~400mg/L 最好的饮用水
500mg/L~1000mg/L 良好的饮用水
1000mg/L~2000mg/L 尚可饮用
2000mg/L~2500mg/L 极限
2.硬度:用Ca++、Mg++的和表示
H=Ca+++Mg++(硬度),1mg当量=2.8德国度。
极软水<1.5mg当量,软水1.5~3.0mg当量
中硬水3~6mg当量,硬水6~9mg当量
极硬水>9mg当量
3.工业用水——主要为锅炉用水、冷却水及其他
暂硬度为HCO3′的毫克当量数
一般锅炉用水要求硬度<2~6mg当量
4.灌溉用水
①正常允许含量<1g/L
②极限允许1.5~3.0g/L(排水良好)
③HCO3′>Ca+++Mg++,为有害水,具弱碱性,使土壤结碱。
④灌溉系数(或碱性系数)
按以下三类公式计算:
第一类Ka=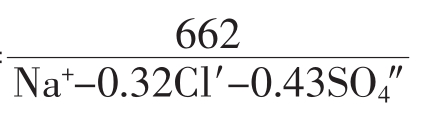
第二类Ka=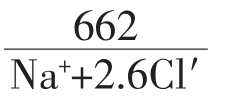
第三类Ka=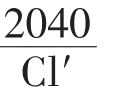
评定标准:Ka>18 水质良好
Ka:6~18 水质适宜
Ka:5.9~1.2 水质不宜
Ka:<1.2 水质坏
5.天然水中的生物作用
①鱼类能生存的最高含盐度60‰
②含O2量 一般6~12mg/L
<3mg/L 不适宜
<1mg/L 死亡
6.耗氧量
生物耗氧量(BOD),代表可为微生物分解之有机物含量。化学耗氧量(COD),代表水中有机物含量,反映水体耗氧量物质的综合指标。
一、二级标准均<5mg/L
河水溶解氧的含量是反映水体污染状态的一个重要指标,溶解氧的浓度变化过程反映了河流自净过程。如果水中有机物含量太多,溶解氧消耗太快,大气氧来不及供应,则消耗殆尽,河流出现无氧状态,有机物分解就从有氧分解转为无氧分解,水质就恶化,甚至黑臭。
河道曝气工程是治理河流黑臭非常有效的办法。
7.水的富营养化
自然水体由贫营养到富营养(主要指氮、磷含量的多少)是一个很长的过程。人类活动造成富营养,使水体过分肥沃,致使藻类过量繁殖,水面会出现大量的藻类植物,形成“水华”,海面上为“赤潮”。
藻类死亡,在腐败、被分解过程中要消耗大量的溶解氧,使水体恶臭。
营养元素氮、磷中起主要作用的是磷,只有限制水体中的磷含量,才能防止水体的富营养化。
富营养化是一种严重的水环境污染,洗涤剂是磷的主要来源。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















