在自然界,某些沉积矿物是在沉积和成岩环境中,由无机化学作用形成的。要理解其成因机理,呈溶液状态搬运的化学物质,以及促使其发生沉淀的各种环境地球化学因素和其形成的沉积物,都是我们关心的重点。
母岩化学分解的产物,可以根据它们难溶和易溶的性质分成胶体溶液(colloidal solution)和真溶液(true solution)两种(图3-13)。Al、Fe、Mn、Si的氧化物难溶于水,在搬运过程中常以胶体形式出现;Ca、Na、Mg等元素所组成的盐类,由于其溶解度大,而呈真溶液搬运。这些溶液借河水或地下水向湖泊或者海洋中迁移,一直到合适的部位沉淀成各种氧化物和盐类化学沉积物,形成各种自生氧化物和盐类矿物。在形成自生氧化物和盐类矿物过程中,环境地球化学条件对其具有重要影响。
所以,本节在简要介绍环境地球化学条件因素基础上,重点分析胶体溶液的搬运和沉积作用、真溶液的搬运与沉积作用、化学沉积分异作用以及常见的化学沉积岩和自生矿物。
图3-13 在自然界中胶体溶液与真溶液的分布情况
一、主要的环境化学参数
Berner(1981)提出了地球化学环境的分类方案(表3-3),被认为应用于沉积物的研究是可行的。
表3-3 Berner的地球化学实用分类方案(据Berner,1981)
Lewis(1984)对影响环境化学条件的一般因素进行了系统总结。
(1)盐度:是指溶液中阳离子和阴离子的浓度。它最常用千分之几(×10-3)或百万分之几(×10-6)表示。正常海水中的盐度是35×10-3左右;超盐水为200×10-3左右;半咸水为10×10-3左右。淡水中盐类平均总量约为100×10-6。
不同离子的溶解度不同,在天然水中它们的实际浓度变化很大。在海水中,Na+>>Mg2+>Ca2+和Cl->>SO42->CO32-,还有许多别的离子存在于海水中。淡水中的离子含量和浓度反映水系受源岩和气候因素影响,因此比海水中离子含量的变化要大很多。一般地说,Ca2+>> Na+>Mg2+和HCO3->>SO42->Cl-。孔隙水的盐度随成岩化学反应粘土和胶体对离子的选择性吸附,以及在溶液迁移时混合程度的不同而不同。
(2)p H值(介质的酸碱度):是溶液中H+(或H3O+)浓度的负对数值。20℃时,纯水离解出典型浓度为10-7的H+和OH-离子,因此p H=7作为中性的标准。H+浓度大于10-7,为酸性水,p H<7;H+浓度较低时则为碱性水,p H>7。注意p H与温度有关,纯水在100℃时,其正常的p H值为6,当沉积物沉降经过地热梯度时,这种与温度的依赖关系在成岩作用中具特殊意义。自然界地表水的p H值从0(如火山地区的热泉)至10或更大(一些碱性高的海水或湖水),大多数天然水的p H值为4~9。正常开阔海海水的p H值为7.5~8.5。
p H值在化学沉积作用中的重要性在于,它是溶液中有无H+和OH-来置换矿物中其他阳离子和阴离子或与溶液中的阳离子或阴离子相互作用的量度。因此,矿物的溶解、蚀变和沉积作用都强烈地依赖于p H值(图3-14)。矿物之间的化学反应对液体的化学成分又有反馈效应,并可升高或降低p H值(例如,在原来的中性水中腐蚀辉闪石类时,其p H值可升至9~11,当腐蚀石英时,p H值可降至5~7,在长石与水接触的界面上水解反应可使局部p H值达到11以上)。
(3)Eh值:是溶液中氧化-还原电位(伏特,V)的量度。E0为标准条件下单位活度的反应物发生反应的电动势;Eh是与这一理想条件有差别(如自然界中)的电动势。Eh随温度、反应物的浓度、压力和p H值的变化而变化。例如25℃时的某反应,当p H值每增加一个单位时,其Eh将降低0.06V。
图3-14 根据Eh和p H关系归纳的常见矿物生成的大致范围
(据Krumbein和Garrels,1952)
在自然界,Eh通常反映自由氧的丰度,当Eh为正时,通常发生氧化反应(图3-14);但Eh为负时,却并不一定导致还原反应,因为还有一个还原能力问题。在沉积物中,还原能力通常决定于有机物。如果缺乏有机物,Eh值并不能导致赤铁矿之类的物质发生还原作用(氧化铁使沉积物染成红色)。
气态O2既可能是大量的,也可能是稀少的或是缺乏的(如它可结合成各种化合物,像CO2、H2O和铁、锰氧化物)。这样,有机炭化物首先被氧化,如果还有剩余氧,则金属阳离子也可被氧化。在沉积体系中,Eh为0的边界是变化的,可以在沉积物与水的界面之上、之中或之下。在后期的成岩作用或风化作用中,O2可被补充在溶液中。
(4)水:水分子为一个偶极子,即在一个较大的O2-离子的两侧有两个H+离子。水分子一侧为正,一侧为负,它们分别吸引阴离子和阳离子。这种引力削弱了矿物中的键合作用,引起水化作用、水解作用从而有利于矿物的溶解。
(5)水循环:由于向溶液中提供新的电解质和从溶液中移去了反应产物,水循环极大地促进了许多反应的进行,反应产物趋于积蓄,又延缓进一步的反应。循环作用由于种种原因而出现在沉积物发展历史的各个阶段,其中最广泛和最普遍的原因是细粒沉积物的压实作用,它将水压向两侧并穿过相邻岩相挤出。土壤中的水在干旱季节可向上运动至表面附近而蒸发,致使溶解物在那里发生沉淀。
(6)水中CO2的含量:CO2与水结合成HCO3-(重碳酸根离子)和H+(它影响p H值),所以它在碳酸盐地球化学中有极其重要的意义。
(7)硫化物阴离子含量:S2-易与金属阳离子结合(特别是铁),大多数S2-主要是由硫酸盐化合物通过厌氧细菌的活动分解形成的。
(8)有机物质:有机质分解时消耗O2,生成CO2,释放出H+(从而影响p H值),提供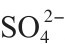 ,贮集有机质复合体(这些复合体对矿物中金属阳离子的析出和搬运具很大影响)。通常,沉积物中的有机质含量随颗粒变小而增高。在某些情况下,有机质的分解在沉积物中是罕见的,但在微环境中(如粪球粒中)仍是很重要的。
,贮集有机质复合体(这些复合体对矿物中金属阳离子的析出和搬运具很大影响)。通常,沉积物中的有机质含量随颗粒变小而增高。在某些情况下,有机质的分解在沉积物中是罕见的,但在微环境中(如粪球粒中)仍是很重要的。
(9)活的生物:通过生物的肠道系统会造成腐蚀的化学反应,例如粘土粒级沉积物经肠道系统后不论是物理性质还是化学性质,都会受到强烈的影响。细菌活动可直接影响矿物的性质(如对硫酸盐化合物的分解)或间接地影响化学反应(如由于厌氧型细菌形成H2S和CO2的作用)。喜氧细菌在深40~60cm的含氧盐沉积物中达到最大值,在此深度之下很快地为厌氧细菌所取代;在许多泥岩和钙质泥岩中,喜氧细菌只能生活在很薄的表层内,因而在通气不良的条件下它们根本不能生存。细菌的含量与有机质分解的数量直接有关。
(10)温度:在化学反应中,温度的最大、最小和平均值以及它们的变化速率极为重要。较高的温度能加速许多化学和生物化学反应的进行。温度的控制因素是气候、季节、地热梯度和各种内部的放热和吸热反应。
二、胶体物质的搬运和沉积作用
低溶解度的金属氧化物和氢氧化物常常可以呈胶体溶液的形式搬运(图3-13)。胶体溶液是介于悬浮液和真溶液之间的一种溶液。胶体粒子的直径很小,一般介于1~100μm之间。在沉积岩中,常见的胶体化合物有Al2O3、P2O3、Mn O2、Si O2粘土矿物和磷酸盐矿物(表3-4)。这些胶体具有共同的特点:①由于胶体质点很小,在搬运和沉积过程中,重力的影响是很微弱的。②由于表面的离子化作用,胶体质点常带电荷。胶体质点的这种带电性质,是影响它搬运和沉积的一个很重要的因素。③胶体粒子的大小比真溶液中离子要大得多,故扩散能力很弱,往往不能通过致密的岩石。④天然胶体有普遍的吸附现象。例如,二氧化硅水溶胶体能积极吸收放射性元素;铁的水溶胶体能吸收As、V、P等;锰的胶体可强烈吸收Ni、Ca、Co、Zn、Hg、Ba、K、W、Ag等。
表3-4 自然界中常见的正负胶体
因此,在搬运过程中,当胶体溶液因两种带不同电荷的胶体相遇,或因电解质作用,或因浓度增大以及p H值的影响失去稳定时,胶体就发生凝聚(絮凝作用),胶体物质即在溶液中集结成为絮状、团块状。这时的胶体就可以克服原来胶体质点的布朗作用,在重力作用下,于合适的沉积环境里逐渐沉积下来。
由胶体凝聚沉积而成的沉积物或沉积岩石,一般具有以下特点:①未脱水硬化的凝胶(即沉积物),呈胶状或糊状、冻状,其固结而成的岩石,常具贝壳状断口;②胶体沉积的岩石,由于颗粒细小,吸收性强,故有粘舌现象;③一般具有微晶、放射状、鮞状、球粒状、扇状集合晶等结构;④常呈透镜状、结核状,有时呈层状产出;⑤具有较强的离子交换能力及吸收不定量水分的能力,故其化学成分常不稳定。
三、真溶液物质的搬运与沉积作用
母岩化学风化以及其他来源提供的化学物质中,Cl、S、Ca、Na、Mg、K等成分呈离子状态溶解于水中,即可呈真溶液状态搬运。有时Fe、Mn、Si、Al也可呈离子状态在水中被搬运。这些可溶物质能否溶解而搬运或沉淀,与本身溶解度有关。即溶解度愈大,愈易搬运,愈难沉积;反之,溶解度愈小,则愈难搬运,愈易沉积。
Fe、Mn、Si、Al等溶解物质的溶解度较小,易于沉淀。在它们的搬运和沉积作用中,水介质的各种物理化学条件的影响十分重要。
Fe3+只有在强酸性(p H< 2~3)的水介质中才稳定,才能作长距离的搬运;当p H>3时, Fe3+就开始沉淀。Fe2+则不同,它在p H值为5.5~7时才开始沉淀。因此,Fe2+远较Fe3+易于搬运。另外,Fe3+和Fe2+沉淀时所要求的Eh值也是不同的。Mn的情况与Fe类似。
Si O2的沉淀需要弱酸性条件,而Ca CO3的沉淀则相反,它需要弱碱性条件。
Al2O3的沉淀条件更为特殊,它只有在p H值为4~7时才沉淀。
Ca CO3的沉淀,除了一定的p H和Eh条件外,对水介质的温度、CO2含量等也有一定的要求。水介质温度升高时,CO2在水中的溶解度就减小,水中的CO2就向大气中逸出,这就促使溶解的Ca(HCO3)2转变为Ca CO3而沉淀。相反,如果温度降低,反应就会向相反的方向进行。因此,碳酸钙沉积多见于热带亚热带地区。
由此可见,在研究Fe、Mn、Si、Al、Ca等溶解物质的搬运及沉积作用时,应充分重视水介质的影响。
但对于溶解度大的物质,如Cl、S、Na、K、Mg等的搬运和沉积作用,水介质条件的影响则不大,它们只有在干热的气候条件下,在封闭或半封闭的盆地中,或者在水循环受限制的潮上地带,即在蒸发的条件下,才能沉积下来。石膏、硬石膏、钠盐、钾盐、镁盐就是这样形成的。
因此,各种溶解载荷从真溶液中沉淀(积)出来都有一定的p H和Eh值。表3-5中所列的是常见的金属氢氧化物沉淀时所需的p H值。表3-6所列的则是各种矿物发生沉淀时的p H值。Krumbein和Garrels(1952)总结了沉积岩中常见自生矿物依据p H值和Eh值所划分的稳定范围和一般的生成条件(图3-14)。
表3-5 常见氢氧化物沉淀时所需的p H值
表3-6 各种矿物悬浮体的p H值
四、化学沉积分异作用
母岩风化产物中的溶解载荷,在沉积过程中,由于各种元素和化合物彼此在化学性质上的差异,它们会发生分异,而这种分异作用是受化学原理所支配的,称为化学沉积分异作用(chemical sedimentary differentiation)。
影响化学沉积分异作用的主要物质因素是物质(化合物)的溶解度,即按溶解度从小到大,依次沉积。这样,原来共存于溶液中的各种成分,在其搬运和沉积作用的过程之中,就逐渐地发生了分异现象并分离开来。化学沉积分异作用还要受到介质的p H值和Eh值变化的影响。
普斯托瓦洛夫(Пуствалов,1940)所提出的化学沉积分异作用的一般模式自沉积盆地岸边向海盆方向的沉积次序是:铝土矿→鲕状赤铁矿→鲕状氧化锰矿→二氧化硅→磷酸钙→海绿石→鲕绿泥石→菱铁矿→方解石→白云石,最后是石膏、硬石膏以及氯化钠、钾盐、镁盐(这些只在盐盆地出现)。普氏于1954年又对化学沉积分异作用序列进行了修订,如果简化一下这个序列,则是:氧化物→磷酸盐→硅酸盐→碳酸盐→硫酸盐→卤化物(图3-15)。
图3-15 化学沉积分异作用图解(据Пуствалов,1954)
普氏的化学沉积分异理论提出以后,受到沉积岩石学界的极大重视,但同时也出现了不少的疑问和分歧。争论的主要问题有二:第一,是关于化学沉积分异作用受外部种种因素的控制或影响问题,如水介质的各种物理化学条件、气候条件、构造条件、生物作用等的控制或影响细节;第二,是个别成分沉淀的先后顺序以及图解的表现形式问题。这两方面的问题随着科学技术的发展,逐步得到了补充和完善。也就是说,任何自然界的规律,都是在一定的条件下存在的,化学沉积分异作用亦然。作为一种沉积作用原理,化学沉积分异作用有其重要理论意义和科学价值。
五、常见的化学沉积物(岩)和自生矿物
自生矿物是溶液中的化学物质在一系列物理化学作用下形成的。其形成方式有以下几种:①以化学或生物化学方式在溶液中沉淀,以后又进一步重结晶;②呈悬浮状态被带到沉积物中的细分散物质(如粘土),经过化学和矿物方面的改造而成;③在地下环境或表生成岩带,溶液中沉淀的矿物置换交代原有的矿物。它们通常形成于原地,包括同时沉积的、沉积后在孔隙中沉淀和交代的,以及地下深处环境中形成的。就是说,在沉积、同生、成岩和后生及表生阶段形成的矿物统称自生矿物,是沉积岩特有和新生的组分。
各种自生矿物都是与其形成阶段所处的物理化学条件相平衡的产物,分布也极不相同。最多的是方解石、白云石及硅质矿物,并可构成巨厚或厚层的沉积岩层;另一些分布虽广,但主要富集在单个岩层、透镜体或团块结核之中,如磷灰石、菱铁矿、黄铁矿和海绿石;还有一类在沉积岩中少见,一般呈胶结物、团块或微小浸染状,如萤石、重晶石、沸石、闪锌矿、方铅矿等。
(1)方解石和白云石:是沉积岩中常见的碳酸盐矿物。方解石(即低镁方解石)主要化学成分为Ca CO3,白云石分子式为Ca Mg(CO3)2。它们既可构成很厚的碳酸盐岩石,又可以在碎屑为主的岩石中以胶结物或者结核的形式出现。有较粗的结晶颗粒,也有极细的泥状晶粒(图3-16);白云石的生成除了符合一般物理化学规则以外(即溶度积、p H等),更多的是交代方解石而成。
(2)黄铁矿和白铁矿(Fe S2):是同质异象的硫化物矿物,以结核形式出现在碎屑岩和碳酸盐岩中。它们在细粒暗色泥岩中最为常见,通常与有机质的保存有关(图3-17)。
这两种矿物都反映了沉积期后沉积物中,甚至在所谓的“闭塞”环境中的沉积物表面处所出现的强还原条件。在沉积物中,孔隙水与上覆充氧水的有限混合以及厌氧细菌的活动消耗了游离氧。这时还原硫的细菌出现,生成游离硫离子,它与铁结合,形成细粒的浸染状黄铁矿或白铁矿。这就使得在现代潮坪较细粒部分,距表面仅几厘米之下的沉积物呈黑色。较大的黄铁矿结核通常显示内部放射状的晶体生长方式。
(3)菱铁矿(Fe CO3):是含铁的碳酸盐矿物,在沉积岩中也较为常见。菱铁矿晶体常具晶面圆滑的菱面体外形,其集合体具放射状或似鲕状,也常呈结核状产出。菱铁矿一般形成于弱还原环境,其中硫酸离子浓度低,有Fe2+以及CO2存在(Sellwood,1971)。关于它的生成,有人认为可能是原生的。但目前绝大多数地质学家认为菱铁矿是典型的成岩期自生矿物,这从它们往往交代原生矿物可得到证实。经常与之共生的自生矿物有鲕绿泥石和黄铁矿。菱铁矿在海洋、湖泊环境中都可以形成,在一些含煤岩系的沼泽粘土中更为常见,有时可以达到一定的厚度而被视作低品位的铁矿石。但在河流中,因河水是弱氧化和中性—弱酸性条件,故很少见。
图3-16 方解石沉积物
a.溶洞中的碳酸盐岩沉积物,鄂尔多斯盆地北部昭君坟(焦养泉摄,2012);b.鲕粒,单偏光,重庆开县飞仙关组(焦养泉摄,2006);c.生物介壳和鲕粒,单偏光,渤海湾盆地歧口凹陷古近系(焦养泉摄,2007)
图3-17 渤海湾盆地歧口凹陷古近系砂岩碎屑沉积物粒间的草莓状黄铁矿(焦养泉摄,2007)
a.单偏光;b. 正交偏光鲕粒;c和d.反射光
(4)赤铁矿和褐铁矿:赤铁矿(Fe2O3)以结核形式以及更为常见的状态——色素出现在红层中。在各种情况下它都要求氧化条件(图2-3、图2-4),不过,在弱还原的碱性条件下能继续存在(图3-14)。结核状赤铁矿一般出现在红色的或局部还原的层序中,而且结核通常出现在古代土壤层剖面中。
尽管许多铁质矿物可风化成褐铁矿(2Fe2O3·3H2O),但如果氧化的地下水条件占优势,褐铁矿似乎也能自主地形成结核(图3-14)。它经常以砂和砂岩中的结核方式出现,往往对未固结松散砂刚刚开始石化的部分起胶结作用。
(5)海绿石:沉积岩中的分布虽量少和分散,但其意义较大,一直是人们关注的研究课题。海绿石是现代海洋底部和地质历史时期海相地层中分布较广的绿色自生矿物,是一种富铁、富钾的含水层状铝硅酸盐矿物。海绿石的颜色比较有特点,呈鲜绿色、黄绿色或浅黄绿色,其绿色的鲜艳程度与Fe3+/ Fe2+比值和氧化程度有关。海绿石常是细鳞片晶体或极细粒的集合体。集合体的形态多种多样。
海绿石是Fe3+和Fe2+共存的富铁矿物,所以形成海绿石要求弱氧化至弱还原条件。费尔布里奇等人指出,形成2mm大小的海绿石团粒可能要100~1 000年时间。在此期间要求沉积速度缓慢,水流有弱扰动。这些特定条件在浅海环境中最为适宜。据研究,大部分海绿石是在同生和早期成岩阶段形成的,后生阶段中海绿石极少。在表生带中海绿石易氧化成褐铁矿,所以他生海绿石极为罕见。
(6)石膏(Ca SO4·2H2O)和硬石膏(Ca SO4):都以早期成岩结核形式出现在现代强碱性条件下,如在炎热、干旱环境中的间歇性湖泊与潮上坪表面以下不远处(图3-18)。类似构造在古代沉积物中是普遍的。宿主沉积物通常为碳酸盐岩,但蒸发盐结核也出现在碎屑岩,尤其是泥质粉砂岩中。石膏可呈嵌晶状环绕宿主沉积物的颗粒产出,而硬石膏常作为结核和薄层以置换方式发育。
(7)重晶石(Ba SO4):作为局部胶结物是十分常见的,尤其是在红色砂岩中,在这里发育完好的晶体呈镶嵌状包围着砂粒。在现代沙漠中,通常以沙漠玫瑰(sand rose)的形式形成于近沉积物表面处。氧化条件和呈溶解状态的钡的补给,对于以这种方式形成的重晶石来说是必需的条件。
(8)石盐或岩盐(Na Cl):是一种块状的、粗粒的、没有节理的结晶物质。可以与其他某些沉积物构成纹层状。盐的结晶可以是轮廓完好的立方体,也可以是漏斗状的。按Dellwig (1955)的解释,漏斗状晶体是在卤水表面形成的,而立方体的常态是在盐的堆积物和它上面浮着的卤水之间的沉积界面上生长的一种产物(图3-19)。
(9)自生硅质矿物(蛋白石+玉髓+自生石英):自生硅质矿物也是沉积岩中分布比较广的造岩矿物,包括蛋白石、玉髓和自生石英。蛋白石是非晶质含水的Si O2矿物,呈胶状集合体。蛋白石凝胶一般直接由溶液中析出,可富集而形成某类岩石,也可作为碎屑孔隙中的充填物。蛋白石的形成又与生物作用有关,常构成各种硅质生物的矿物质骨骼。玉髓是纤维状结晶质的Si O2矿物,它是由蛋白石重结晶而成的,常呈纤维状集合体和微晶状,往往与蛋白石同时出现。Глнзбург和Рукавищникова(1951)及其他研究者指出,方解石的存在,会促进蛋白石转变为玉髓及结晶质Si O2的其他亚种。因此,在石灰岩中,结晶形式的Si O2、玉髓占绝对优势。福克(1981)的研究认为,正延性玉髓(水玉髓)是在地质历史中曾存在过,而现在已消失了的蒸发盐岩的典型标志,它是通过交代蒸发岩而形成的一种矿物,它的结晶C轴与晶体纤维方向呈30°夹角。自生石英可以由玉髓进一步结晶而成,也可以在成岩后生期直接形成碎屑石英的增生或加大(图3-20)。这些自生石英常充填碎屑岩石的孔隙空间(包括加大石英),有的呈较粗的镶嵌状集合体,也有的呈分散状较自形的晶粒。在现代砂中没有见到自生石英充填孔隙,而在古代碎屑岩(特别是砂岩)中经常出现。说明自生石英的形成除了需要一定的离子浓度,也需要一定的成岩温度。二氧化硅的沉淀似乎需要弱碱性条件。
图3-18 蒸发岩类——石膏
a、b.内蒙古四子王旗江岸乌兰胡秀古近系石膏晶体(焦养泉摄,2012);c.新疆乌鲁木齐芦草沟组油页岩表面的石膏晶体(焦养泉摄,2006);d.内蒙古四子王旗脑木根古近系石膏晶体(焦养泉摄,2009)
图3-19 蒸发岩类——石盐
a.形成于死海沿岸的盐晶(据Stefano Brambilla,2009);b.新疆吐鲁番艾丁湖的石盐(焦养泉摄,2000)
图3-20 鄂尔多斯盆地北部白垩系的自生石英晶簇(焦养泉摄,2012)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















