实验十四 蛋白质印迹
一、实验目的
理解和掌握蛋白质印迹的原理和实验操作技术。
二、实验原理
蛋白质印迹(Protein Blotting or Western Blotting)指将电泳或层析分离的蛋白质转移到纸或膜类固定基质上。常用的蛋白质印迹是从聚丙烯酰胺凝胶转移到尼龙膜或者硝酸纤维素膜上。这样可以使分离的蛋白质原样转印到固体支持表面,而不是在立体的凝胶孔中间,便于探针的相互作用和标记。同时在膜上不易扩散,可以保持蛋白带的分辨率。在膜上反应需要的时间短,试剂量少,固定化膜易操作和保存。
完整的蛋白质印迹过程包括四个步骤:(1)蛋白质在膜上的固定化。(2)用非特异性非反应活性分子封阻固定基质上未吸附蛋白质的区域(block)。(3)用探针与固定基质上感兴趣的蛋白质特异结合。(4)用标记在探针上的报告基团检测出感兴趣分子的位置(见图14-1)。
三、实验仪器、材料和试剂
1.仪器:电泳仪、转移电泳槽,微量注射器。
2.材料:实验十三提取的蛋白质。
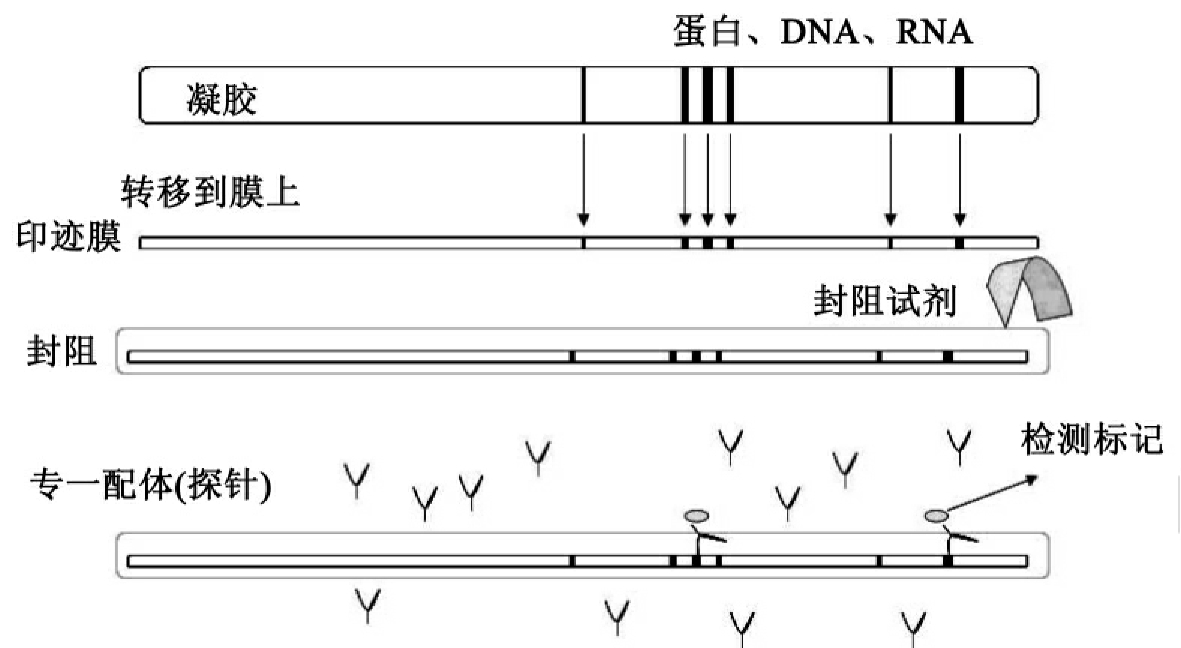
图14-1 蛋白质印迹的四个步骤
3.试剂:转移缓冲液:25mmol/L Tris,192mmol/L Glycinine,20%Methenol,pH8.350mL TBS[10mM Tris-Cl,0.9%(w/v)NaCl,pH7.2],100mL1%脱脂奶粉溶液[1%(w/v),脱脂奶粉0.02%(w/v)叠氮化纳的PBS],600mL含0.5%BSA,0.1%Triton,0.02%叠氮化纳的TBS,50mL TBS,原初抗体溶液:在25mL含0.5%BSA,0.02%叠氮化纳的TBS中加25μL抗体。
碱性磷酸酶连接的二级抗体溶液:在25mL含0.5%BSA,0.02%叠氮化纳的TBS中加5μL抗体。
碱性磷酸酶反应显色试剂。
四、实验步骤
(一)SDS聚丙烯酰胺凝胶电泳分离蛋白质(见附录2)
(二)将SDS聚丙烯酰胺凝胶上的蛋白质电转移到硝酸纤维素膜上
1.将含有分离好的蛋白质的SDS聚丙烯酰胺凝胶、剪好的与凝胶大小、形状相同硝酸纤维素膜和剪好的比凝胶和膜略大的四块滤纸、两块海绵浸泡在电泳转移缓冲液中15~20min(膜先在甲醇中浸1~3s,然后在水中浸1~2min,再在电泳转移缓冲液中平衡)。
2.将浸泡好的海绵、滤纸、凝胶、膜、滤纸、海绵按顺序从黑板一层一层无气泡地贴紧到白板,将两板夹紧。
3.将夹好的转移复合体放入加好电泳液的转移槽中,盖上盖子,黑板方向接负极,白板方向接正极。使电流从凝胶流向膜。接通电源,使电流达300mA,同时通冷却水,印迹2h后,切断电源。
4.(对照)蛋白质转移效果的检测:取出硝酸纤维素膜,用一般的蛋白质染色剂丽春红染色5min,用水轻轻漂洗数次至背景红色消失。
(三)特异蛋白的免疫检测
1.将转移好的膜在TBS中冲洗。
2.将膜在1%脱脂奶粉溶液中37℃震荡3h或4℃震荡过夜。
3.用含0.5%BSA,0.1%Triton,0.02%叠氮化纳的TBS摇动洗膜三次,TBS洗膜一次,每次5min。
4.将膜在原初抗体溶液中室温下轻摇2h。
5.重复步骤3。
6.将膜在1%脱脂奶粉溶液中室温下轻摇30min。
7.重复步骤3。
8.将膜在连有碱性磷酸酶的二级抗体溶液中室温下轻摇2h。
9.用含0.5%BSA,0.1%Triton,0.02%叠氮化纳的TBS摇动洗膜六次,共计500mL,30min,最后用TBS迅速洗膜。
10.将膜在含有BCIP,NBT的显色缓冲液中显色20min。将膜在20mmol/L EDTA(pH8.0)或水中停止反应。
五、结果与分析
1.如果不进行杂交,只进行蛋白质转膜,用丽春红染色观察蛋白质的转膜效果。
2.特异蛋白的杂交结果如图14-2所示。
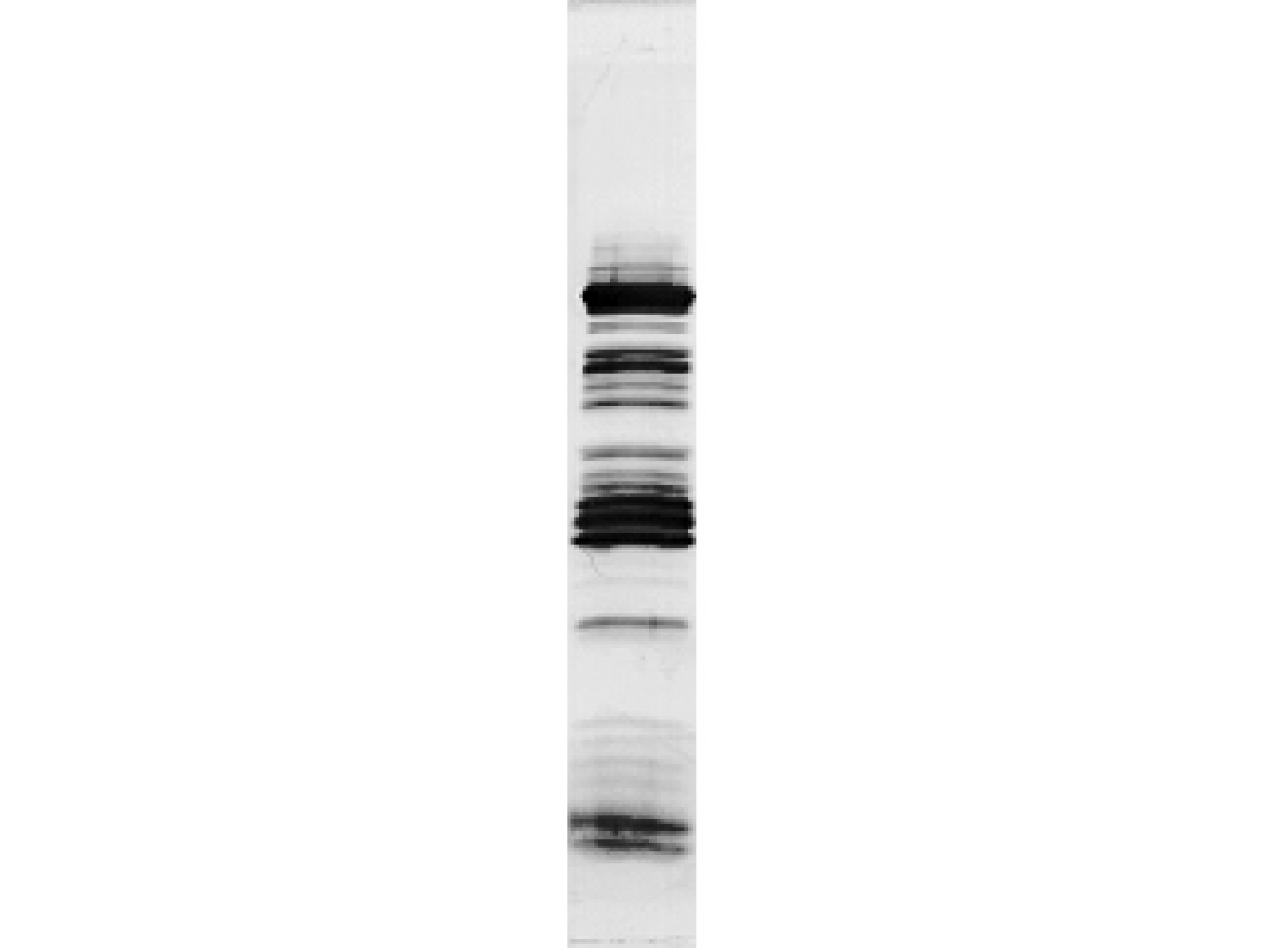
图14-2 用食松种子GBSSI1(Granule bound starch synthase)抗体对豌豆淀粉粒结合的蛋白质进行的Western杂交图
六、注意事项
1.转膜用的海绵、滤纸、SDS聚丙烯酰胺凝胶、硝酸纤维素膜预先转膜缓冲液中平衡10min。
2.各层之间不能有气泡,冷却水不要忘记开。转膜缓冲液中甲醇不能超过20%(40%甲醇不能转移)。实验需要约8h。
七、思考题
1.特异性蛋白谱带的检出方法有哪些?
2.为什么转移的各层之间不能有气泡?
3.为什么转移缓冲液中甲醇不能用40%?
4.为什么要在转移槽的黑板方向接负极,白板方向(膜一侧)接正极?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。












