第五节 转基因动物与基因打靶
基因打靶(gene targeting)包括基因敲除(gene knockout)和基因敲入(gene knockin),基本原理是利用外源DNA分子与染色体DNA间的同源重组精确,而定点地将细胞内染色体上的某一特定基因的功能破坏(沉默)——敲除,或通过同源重组向细胞内染色体上引入一个有功能的新基因——敲入(图17-4)。基因打靶是在胚胎干细胞技术和同源重组技术上发展起来的,具有专一性强、打靶后的基因片段可以与染色体DNA一起共同稳定遗传的特点,已经成为一种较为理想的改造生物遗传物质的实验方法。
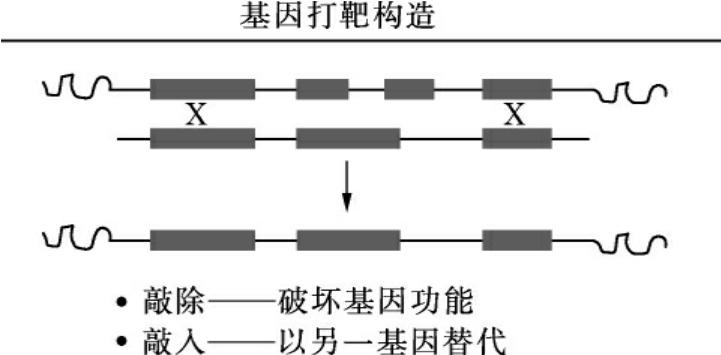
图17-4 基因打靶载体作用示意图
基因敲除技术早在20世纪70年代就在酿酒酵母中应用,胚胎干细胞技术的出现为基因敲除提供了更为合适的操作对象,1985年Smithies第一次将一段质粒插入到人染色体的β-珠蛋白位点,并于2年后获得基因敲除小鼠,2000年获得基因打靶绵羊,2002年获得了基因打靶猪。
基因打靶的必备条件是打靶胚胎干细胞(保留细胞全能性、可以在体外培养和遗传操作)和构建打靶载体(新霉素阳性筛选标志和单纯疱疹病毒胸腺嘧啶核苷激酶HSV-tk阴性筛选标志)。打靶载体通常都包含有两段与打靶目标位点两端同源的区域,中间一段不同且为目的序列,并带有某种药物筛选标记。打靶载体构建的基本策略见表17-3。
表17-3 打靶载体构建的基本策略

基因打靶的基本程序为:构建打靶载体、打靶载体导入ES细胞进行重组置换、将基因打靶的ES细胞注射到打靶动物胚胎的胚泡、将注射过基因打靶ES细胞的胚泡移植到假孕的打靶动物子宫、嵌合体打靶动物杂交育种获得基因打靶的转基因动物。
1993年顾华等提出利用Cre-LoxP系统进行组织特异性基因敲除,系统包括Cre重组酶和LoxP位点两部分,前者由大肠杆菌噬菌体P1的Cre基因编码,后者是13bp的反向重复顺序和8bp的间隔区构成,Cre重组酶可介导34bp的重复单元,切除同向重复的2个LoxP位点间的DNA片段和1个LoxP位点,保留1个LoxP位点。Cre-LoxP组织特异性基因敲除基本过程见图17-5。
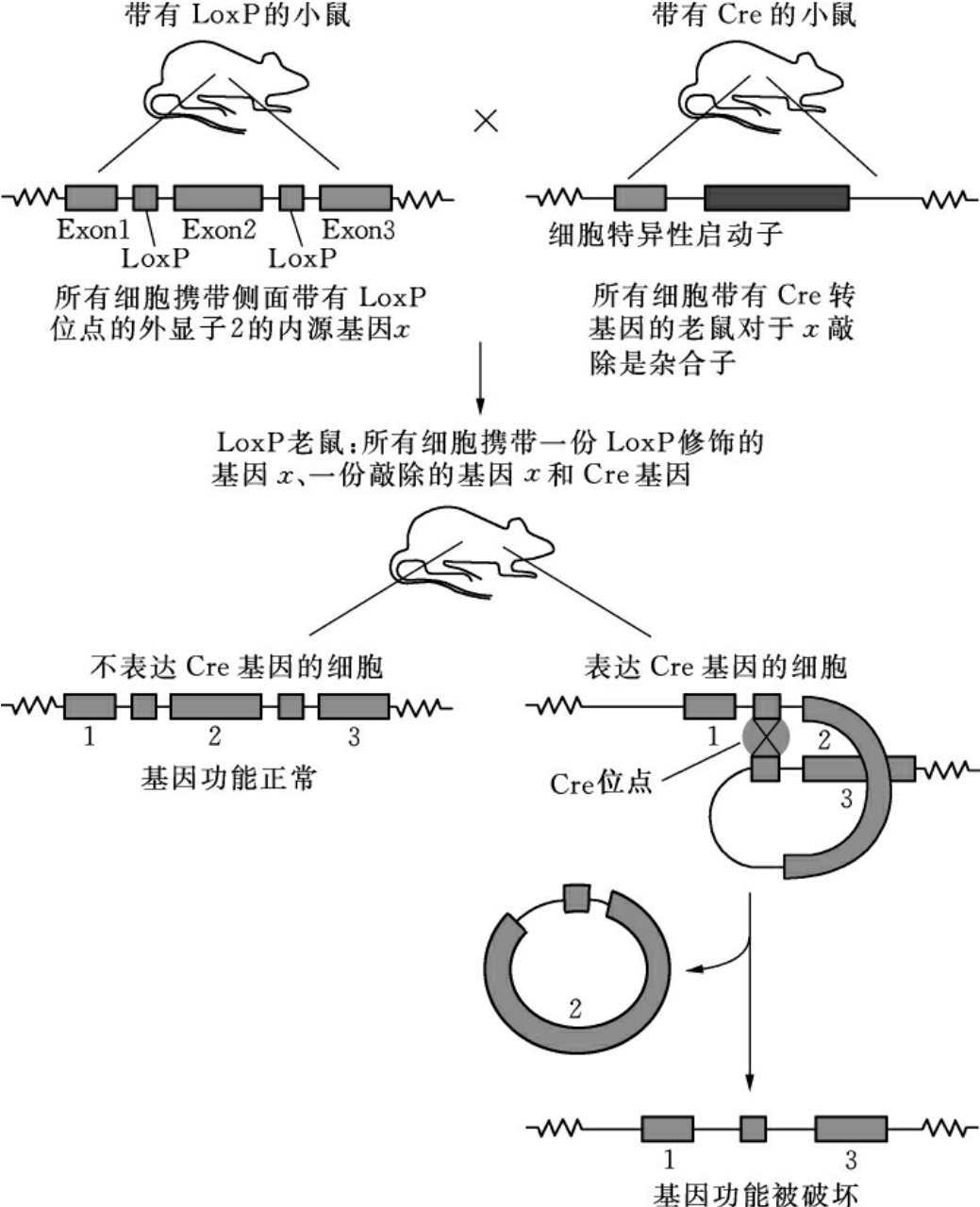
图17-5 利用Cre-LoxP系统进行细胞类型特异性基因敲除
有2种操作方法使用Cre-LoxP系统,一是构建打靶载体时将标记基因放在靶基因内部,标记基因两侧放上相同方向排列的LoxP序列,可以在细胞水平用Cre重组酶表达质粒转染被打靶的细胞,通过识别LoxP位点将抗性基因切除;二是在个体水平将打靶杂合子小鼠与Cre转基因小鼠杂交,筛选子代小鼠就可以得到删除外源标记基因的条件性敲除小鼠。
通过基因打靶技术,已经建立了许多针对不同靶基因的基因敲除的转基因动物模型,就基因敲除小鼠,目前已达数千种,每年还以数百种的速度在增加。基因打靶将是功能基因组研究最直接有效的手段之一,基因打靶在疾病与临床研究、异种器官移植、动物育种和转基因动物研究等领域得到了广泛应用。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















