第一节 免疫球蛋白的结构
一、基本结构
免疫球蛋白分子的基本结构是一“Y”字形的四肽链结构,由两条完全相同的重链(heavy chain,H)和两条完全相同的轻链(light chain,L)以二硫键连接而成,如图4-2所示。
(一)重链和轻链
免疫球蛋白重链由450~550个氨基酸残基组成,分子量约50~75 kD。重链可分为μ、δ、γ、α和ε链,据此可将免疫球蛋白分为5类(class)或5个同种型(isotype),即IgM、IgD、IgG、IgA和IgE。每类Ig根据其绞链区氨基酸残基的组成和二硫键数目、位置的不同,又可分为不同亚类(subclass)。
免疫球蛋白轻链含约210个氨基酸残基,分子量约25 kD。轻链分为κ和λ链两种,据此可将Ig分为κ和λ两型(type)。一个天然Ig分子两条轻链的型别总是相同的,但同一个体内可存在分别带有κ或λ链的抗体分子。正常人血清中κ型和λ型免疫球蛋白浓度之比约为2∶1。根据l链恒定区个别氨基酸残基的差异,又可将λ分为λ1、λ2、λ3和λ4四个亚型。
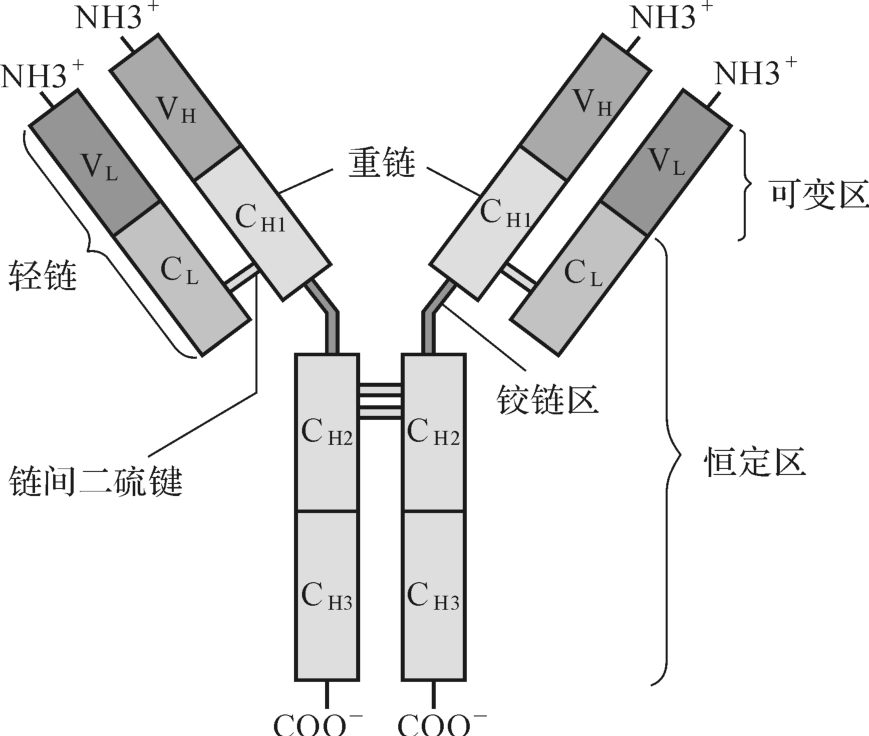
图4-2 免疫球蛋白结构示意图
(二)可变区和恒定区
比较不同Ig重链和轻链的氨基酸序列时发现,重链和轻链近N端约110个氨基酸序列的变化很大,其他部分氨基酸序列则相对恒定。免疫球蛋白轻链和重链中氨基酸序列变化较大的区域称为可变区(varia-ble region,V),分别占重链和轻链的1/4和1/2。免疫球蛋白轻链和重链中氨基酸序列较保守的区域称为恒定区(constant
region,C),其位于肽段的羧基端,分别占重链和轻链的3/4和1/2。重链和轻链V区(分别称为VH和VL)各有3个区域的氨基酸组成和排列顺序高度可变,称为高变区(hypervari-able region,HVR)或互补决定区(complementarity determining region,CDR),分别为CDR1、CDR2和CDR3(图4-3)。CDR以外区域的氨基酸组成和排列顺序相对不易变化,称为骨架区(framework region,FR)。VH和VL各有FR1、FR2、FR3和FR4四个骨架区。VH和VL的3个CDR共同组成Ig的抗原结合部位,负责识别及结合抗原,从而发挥免疫效应。
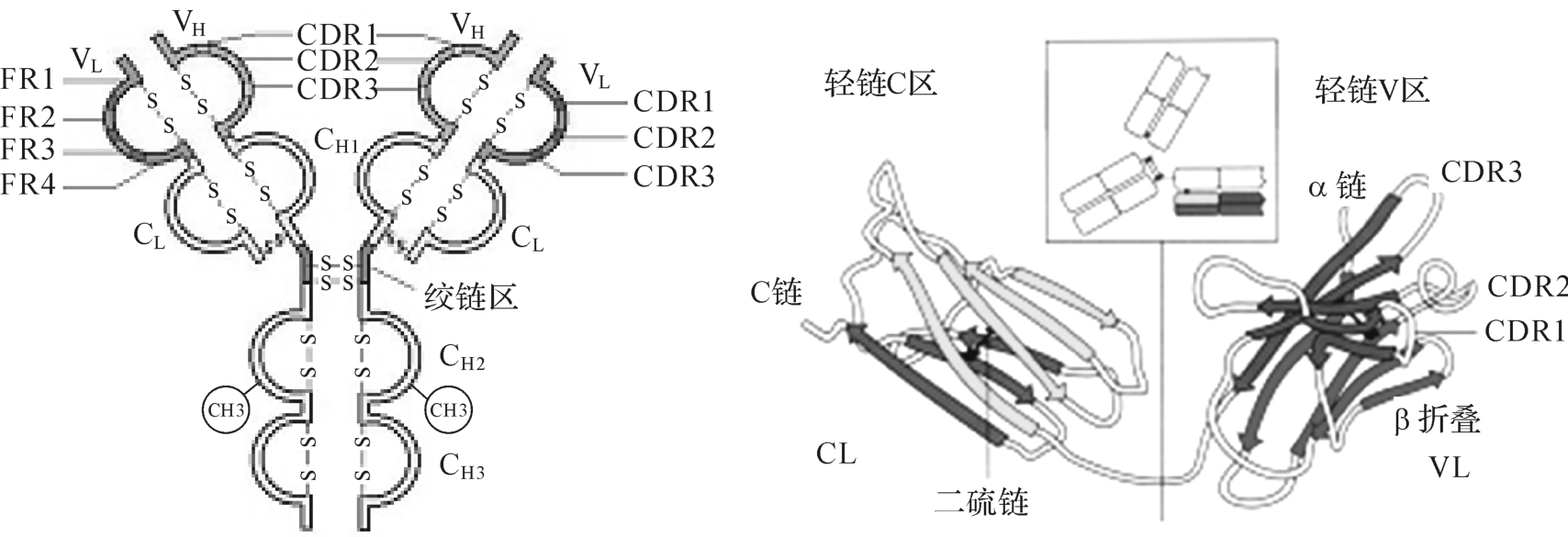
图4-3 免疫球蛋白功能区
重链和轻链的C区分别称为CH和CL,不同型(κ或λ)Ig其CL的长度基本一致,但不同类Ig其CH的长度不一,可包括CH 1~CH 3或CH 1~CH 4。同一种属的个体,所产生针对不同抗原的同一类别Ig,其C区氨基酸组成和排列顺序比较恒定,即免疫原性相同,但V区各异。Ig C区与抗体的生物学效应相关,如激活补体;穿过胎盘和黏膜屏障;结合细胞表面Fc受体从而介导调理作用;介导ADCC作用和I型超敏反应等。
(三)绞链区
绞链区位于CH 1与CH 2之间。该区富含脯氨酸而易伸展弯曲,能改变两个Y形臂之间的距离,有利于两臂同时结合两个不同的抗原表位。IgD、IgG、IgA有绞链区,IgM和IgE则无。
(四)功能区或结构域
免疫球蛋白分子的两条重链和两条轻链都可折叠为数个环形结构域。每个结构域一般具有其独特的功能,因此又称为功能区(domain)。每个功能区约含110个氨基酸残基,其二级结构是由几股多肽链折叠而成的两个反向平行的β片层(anti-parallel b sheet),两个β片层中心的两个半胱氨酸残基由一个链内二硫键垂直连接,形成一“β桶状(βbarrel)”结构,或称β三明治(βsandw ich)结构。不仅免疫球蛋白,已发现许多膜型和分泌型分子含有这种独特的桶状结构,这类分子被称为免疫球蛋白超家族(immunoglobulin superfamily,IgSF)。
二、其他成分
除轻链和重链外,某些类别Ig还含有其他辅助成分,分别是J链(joining chain)和分泌片(secretory piece,SP)。J链是一富含半胱氨酸的多肽链,由浆细胞合成,主要功能是将单体Ig分子连接为多聚体。IgA二聚体和IgM五聚体均含J链;IgG、IgD和IgE常为单体,无J链。SP又称分泌成分(secretory component,SC),为一含糖肽链,由黏膜上皮细胞合成和分泌,以非共价形式结合于IgA二聚体上,使其成为分泌型IgA(SIgA)。SP的作用是:使IgA分泌到黏膜表面,发挥黏膜免疫作用;可保护SIgA绞链区,使其免遭蛋白水解酶降解。
三、Ig水解片段
在一定条件下,免疫球蛋白分子肽链的某些部分易被蛋白酶水解为各种片段(图4-4)。
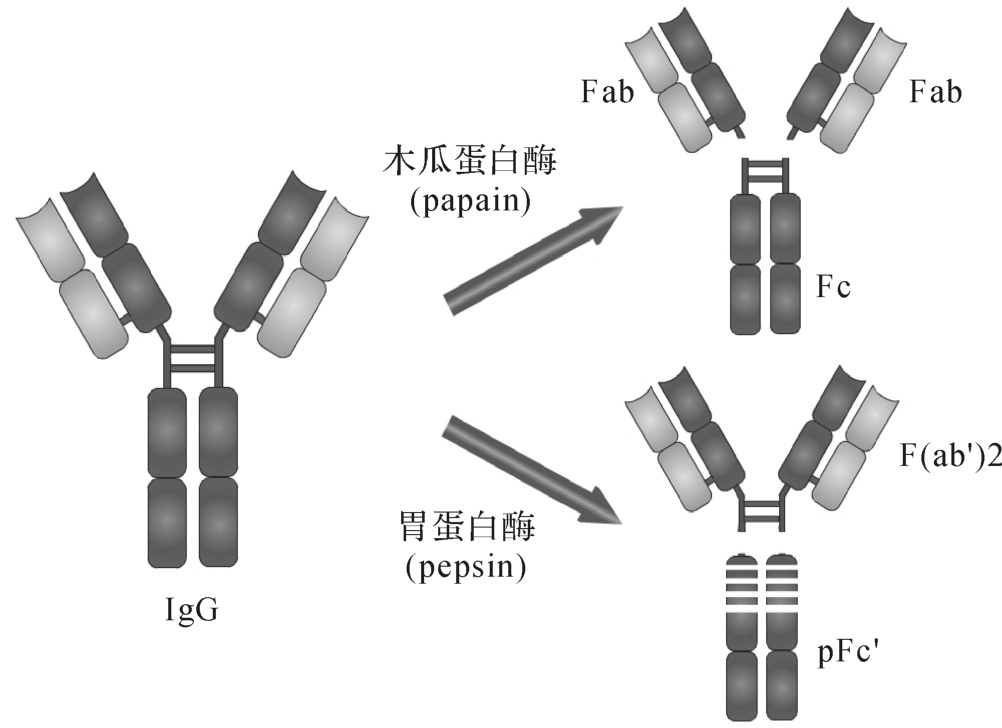
图4-4 免疫球蛋白水解示意图
1.木瓜蛋白酶(papain)作用于绞链区二硫键所连接的两条重链的近N端,将Ig裂解为两个完全相同的Fab段和一个Fc段。
(1)Fab即抗原结合片段(fragmentof antigen binding),由一条完整的轻链和部分重链(VH和CH 1)组成。一个Fab片段为单价,可与抗原结合但不形成凝集反应或沉淀反应;因V区的Aa种类、排列顺序、其空间结构具有高度可变性和复杂性,能充分适应Ag决定簇的多样性,也为Ab的多样性和特异性作出了圆满的解释(图4-5)。
(2)Fc片段即可结晶片段(fragment crystallizable),相当于IgG的CH 2和CH 3功能区,无抗原结合活性,是Ig与效应分子或细胞相互作用的部位,与Ig的生物学活性有关。如:激活补体,增强巨噬细胞的吞噬效果,激活K细胞的杀伤作用。
2.胃蛋白酶(pepsin)作用于绞链区二硫键所连接的两条重链的近C端,将Ig水解为一个大片段F(ab’)2和一些小片段pFc’。F(ab’)2是由两个Fab及绞链区组成,为双价,
可同时结合两个抗原表位,故能形成凝集反应或沉淀反应。pFc’最终被降解,无生物学作用。
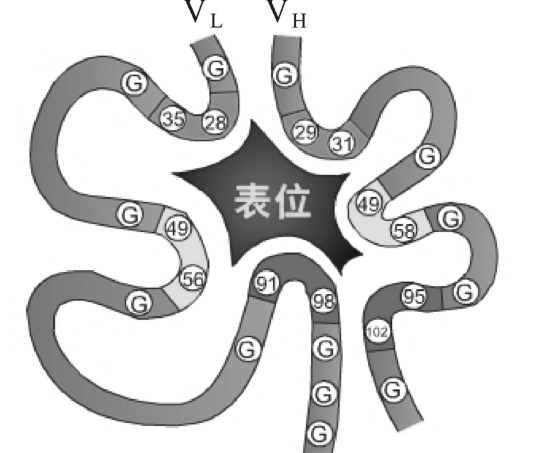
图4-5 抗原结合片段
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














