葡聚糖和腐植酸:对免疫系统的协同作用
Vaclav Vetvicka1 Roberto Baigorri2 Angel M.Zamarreno2 Jose M.Garcia-Mina2,3 Jean-Claude Yvin4 著
周霞萍5 樊兴明5 译
(1 路易斯维尔大学病理学系 肯塔基州 美国 2 钛美农业国际鲁利耶集团研发部 奥尔科延 3 纳瓦拉大学化学和土壤化学系 潘普洛纳 西班牙 4 钛美农业国际研发部 迪纳尔 法国 5 华东理工大学科学技术发展研究院 上海 200237)
摘要:腐植酸是由有机物质分解产生的化合物。尽管它们普遍存在,但我们对它们的生物学效应了解有限,且目前的研究结果存在争议。我们决定评估来源不同且具有不同的生化特性的两种类型的腐植酸的免疫效果。单独使用这两种腐植酸或与已知发酵衍生的免疫调节剂葡聚糖结合使用,并测其在细胞(吞噬作用和肿瘤抑制)和体液(抗体的产生和细胞因子的分泌)的免疫反应。研究结果表明,腐植酸是具有生物活性的免疫调节剂,影响体液免疫和细胞免疫反应。此外,本文研究的两种腐植酸在免疫反应的刺激下具有协同效应,为这些天然免疫调节剂的进一步研究提供了支持。
关键词:葡聚糖 腐植酸 免疫力 吞噬作用
Glucan and Humic Acid: Synergistic Effects on the Immune SystemVaclav Vetvicka1, Roberto Baigorri2, Angel M.Zamarreño2, Jose M.Garcia-Mina2,3, Jean-Claude Yvin4 write Zhou Xiaping5, Fan Xingming5 translate
(1 Department of Pathology, University of Louisville, Louisville, Kentucky, USA 2 R&D Department, Timac Agro International-Roullier Group, Orcoyen 3 Department of Chemistry and Soil Chemistry, University of Navarra, Pamplona, Spain 4 R&D Department, Timac Agro International, Dinard, France 5 Institute of Science and Technology Development, East China University of Science and Technology, Shanghai, 200237 )
Abstract: Humic acids are compounds resulting from decomposition of organic matter.Despite their common presence,our knowledge of their biological effects is limited, and current findings are controversial.We decided to evaluate the immunological effects of two different types of humic acids, differing in source and biochemical characteristics.Using both components either alone or in combination with the well-established yeast-derived immunomodulator glucan, we measured their effects on both the cellular (phagocytosis and tumor suppression)and humoral (antibody production and cytokine secretion)branches of immune reactions.In summary, our results suggest that humic acids are biologically active im-munodulators affecting both the humoral and cellular branches of immune reactions.In addition, the two humic acids studied here are working in synergy in stimulation of the immune reaction, supporting further studies of these natural immuno-modulators.
Key words: glucan; humic acids; immunity; phagocytosis
有据可查,使用β1,3-葡聚糖作为免疫调节剂已经超过50年。实验表明粗制的酵母细胞制备物通过补体系统的激活来刺激巨噬细胞,使得对多糖免疫调节特性的研究兴趣第一次被提起来。实验进一步研究确定的免疫调节活性成分为β1,3-葡聚糖。随后大量研究表明β1,3-葡聚糖,无论是颗粒或是溶液,均表现出免疫刺激特性,包括抗细菌和抗肿瘤活性。2500多个出版物报道说,β1,3-葡聚糖的溶液或颗粒,表现出显著的免疫调节性能。目前,葡聚糖被认为是最有效的生物反应调节剂之一。
一些研究表明,与葡聚糖相结合的生物活性分子具有协同效应。大量报告显示当葡聚糖与维生素C结合会产生出一些有益的影响。与维生素C表现出协同效应的主要原因是:该维生素显示出与葡聚糖刺激完全相同的免疫反应,即巨噬细胞活性,自然杀伤细胞的活性,以及特定抗体的形成。一项研究显示,在小鼠被感染科氏中殖孔绦虫的治疗过程中,葡聚糖-维生素C的组合具有显著的治愈能力;治疗带来对肝纤维化和病理生理的积极改变。同组研究人员还发现,发酵衍生的葡聚糖对几种蠕虫的寄生虫是一种前景广阔的药剂。相对于肝病,裂葡聚糖被证明有助于抵抗肝脏的缺血再灌注损伤,具有这些效果的机理可能是由于早期基因损伤后的肝脏直接表现为引起葡聚糖的减少。
腐植酸物质主要存于深度降解的泥炭。腐植酸(HAs)是一组由复杂的芳香族聚合物结构组成的高分子量的大分子物质。而黄腐酸是腐植酸物质中特定的部分,一些人认为是惰性的,而另一些人认为它们是生物毒素。更详细的研究显示出不同的结果:高剂量的腐植酸在肠细胞中会诱导染色体异常,造成DNA氧化损伤,抑制核因子κB的活性,刺激胸腺和中性粒细胞。另一方面,最近一些有趣的和重要的潜在临床生物活性物质与各种类型HA有关,包括抗病毒的特性和淋巴细胞的增殖。研究也将HA添加到饲料中,促进了养殖动物的生长和健康。
最近的研究表明白藜芦醇能够显著改善葡聚糖的生物活性,所以我们预计葡聚糖与HAs对免疫反应可能有协同作用。
1 材料和方法
1.1 动物
6-10周龄的BALB/c雌性小鼠购自从杰克逊实验室(美国缅因州巴尔港)。
所有动物实验是根据美国肯塔基州路易斯维尔,路易斯维尔大学的动物保护和利用委员会的规范进行。动物用CO2窒息处死。
1.2 材料
RPMI1640培养基,柠檬酸钠,卵白蛋白,抗生素,瑞氏色素,鲎溶解物试验E-TOXATE,弗氏佐剂和从Sigma公司(美国密苏里州圣路易斯)得到的刀豆蛋白A(ConA)。胎牛血清购自Hyclone实验室(美国犹他州洛根)。
1.3 β1,3-葡聚糖
本研究使用的葡聚糖从以下公司购得:300单位的酵母型不溶性葡聚糖来自转运站(美国,南卡罗来纳州,哥伦比亚),水溶性葡聚糖海带多糖来自Sigma公司。
1.4 提取方法
实验中使用的两种腐植酸:一个提取自捷克共和国的风化褐煤(HZ);另一个提取自中国的褐煤(HC)。对不同的腐植酸进行分离,依据国际腐殖质学会的程序进行纯化,并冷冻干燥。
1.5 固态13C-核磁共振(NMR)光谱
固态13C-核磁共振(NMR)光谱,用Bruker(美国马萨诸塞州比尔里卡)的Avance AV-400WB(9.4-T)型光谱仪测定,共振频率为100.47 MHz,采用错位极化磁性自旋技术,自旋频率为12 KHz,脉冲宽度为908,采样时间为30 ms,循环延迟时间为4.0 s。
1.6 元素分析
冻干样品中的碳,氢,氮含量,一式两份,采用LECO(美国密歇根州圣若瑟)CHN900型分析仪进行分析。氧含量通过差减法确定(无灰分)。
1.7 体外吞噬作用测定
在腹腔注射葡聚糖和/或如前面所述HA之后,使用合成的微球(2-羟基乙基甲基丙烯酸酯[HEMA]颗粒),供体外测定噬作用。即,采用0.05 mL的HEMA粒子(5×108/mL)孵育血液或分离的腹膜细胞。试管于37 ℃孵育60分钟,并间歇振荡。涂片采用瑞氏色素进行染色。细胞有三个或更多的HEMA粒子则认为呈阳性。同样的涂片再被用于评价细胞的类型。
1.8 白细胞介素(IL)-2的产生测试
纯化的脾细胞(2×106/mL和5%的胎牛血清在RPMI1640培养基中)加入到24孔培养板中。在加入1 mg ConA至阳性对照孔后,将细胞在恒湿培养箱中(37 ℃,5%CO2)培养72小时。在培养结束后,收集上清液,过滤(孔径0.45 mm),并测试IL-2的存在。IL-2水平使用Quantikine小鼠IL-2试剂盒(美国明尼苏达州明尼阿波利斯R&D Systems)测定。
1.9 细胞因子阵列测试
单个细胞因子通过Allied Biotech(美国马里兰州Ijamsville)在小鼠血清中进行测定。小鼠注射试验组合物24小时后,将小鼠处死,并收集血清储存在-80 ℃冰箱中。对于细胞因子的分析,我们采用Allied Biotech所提供的蛋白质微阵列服务。简言之,该服务使用夹层的基于抗体的蛋白被用于多重测定。该方法在每个芯片的阳性和阴性对照中进行,一式四份测定。该测定法检测下列细胞因子:IL-2,干扰素-γ,肿瘤坏死因子(TNF)-α,IL-8,IL-12 p70,IL-12 p40,IL-4,IL-6,IL-10,IL-5,干扰素诱导蛋白-10,巨噬细胞炎性蛋白-1β,IL-13,IL-1β和单核细胞趋化蛋白(MCP)。
1.10 体内肿瘤抑制实验
每只小鼠在皮下脂肪垫中注射磷酸缓冲盐水(PBS)配置的1×106 Ptas64细胞。在明显发现肿瘤(一般在细胞注射14天后)后,将小鼠随机分为实验组,治疗实验开始。实验采用腹膜注射PBS稀过的测试样品,之后将小鼠处死,取出肿瘤并称重。
1.11 抗体的形成
小鼠用100 mg卵清蛋白注射两次(间隔2周),在最后一次注射7天后,收集血清。特异性抗体对抗卵清蛋白的水平通过酶联免疫吸附测定法进行检测。采用弗氏佐剂作为阳性对照。
1.12 统计
采用统计学分析数据。
2 结果
在元素分析,特别是在13C-核磁共振(NMR)13C-NMR分析中能够观察到,在芳香族和脂族结构部分,HZ呈现出比HC更多的功能性基团,主要体现在酚、羰基碳、O-烷基碳的含量较高。但是,HC呈现出显著的芳香性,而HZ呈现出芳香性和显著的脂肪族排列。因此得到了两个结构完全不同的HAs:HZ具有O型功能性基团,并与芳香族和脂肪族基团结合,HC具有较少功能性基团,但具有高芳香性(表1和表2)。
表1 腐植酸样品的元素分析
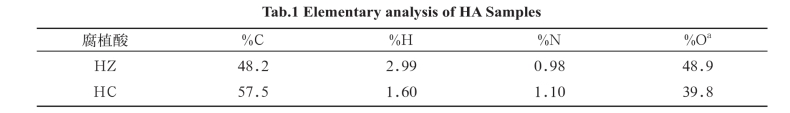
注:a采用差减法测定。
表2 腐植酸样品的13C-核磁共振(NMR)光谱分析

首先,我们测试HA和HA-葡聚糖对腹腔内一些细胞的影响。在随后的所有实验中,使用相同的组合方式,观察到无论是腹腔内注射或口服(数据未出示)后,细胞结构(相对于二者的总数和分类计数)没有变化。在所有情况下,葡聚糖,HA,或葡聚糖-HA溶解能在PBS中,它也被用作阴性对照。
各种葡聚糖对巨噬细胞的影响是公认的。然而,为了证明免疫调节剂的新组合确实表现出免疫调节性,必须对吞噬作用进行评价。首先,我们测量了葡聚糖和/或HA对存在于末梢血中合成的HEMA微球体外吞噬作用的影响(图1)。葡聚糖和HA均刺激合成颗粒的内部转化,但该组合制剂,特别是在比例为1∶1时,对噬血中性粒细胞展现出显著的协同效应。
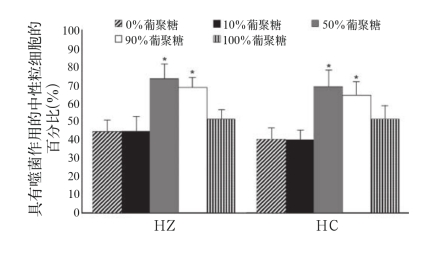
图1 腹腔内注射葡聚糖和/或腐植酸合成噬菌微球(HEMA粒子)的增强作用
Fig.1 Potentiation of in vitro phagocytosis of synthetic microspheres (HEMA particles)by intraperitoneally injected glucans andor HAs
注:注射100 mg不同比例的样品,对照组(仅用PBS)值为33.4%。外周血中性粒细胞中含有3个或更多HEMA粒子被认为具有阳性效果。3个独立的实验中实验数据采用平均值±标准偏差的形式(5支小鼠为一个实验组)。* P≤0.05显著性差异水平。
当我们测试腹腔巨噬细胞的体外吞噬作用,得到了相同的结果(图2)。在这两种情况下,将细胞与注射了葡聚糖和/或HA的小鼠身体分离。
免疫调节活性也能通过对由脾细胞产生的IL-2的影响得到证明(图3)。从对照组和治疗组小鼠分离出来的的脾细胞在体外培养72小时候测定IL-2的产生。再一次,葡聚糖和HA结合治疗小鼠对IL-2的产生有显著的刺激效果。对HZ,当HZ与葡聚糖为9∶1时表现出最高的刺激效果;而对HC,HZ与葡聚糖为1∶9时IL-2获得最高的产生量。与单独使用葡聚糖或HA相比,所有这些组合都表现出更高的刺激效果。由于无刺激的脾细胞(PBS组)IL-2的分泌量为零,所以即使是最低量的刺激在统计学上产生的影响也是显著的。

图2 腹腔内注射葡聚糖和/或腐植酸合成噬菌微球(HEMA粒子)的增强作用
Fig.2 Potentiation of in vitro phagocytosis of synthetic microspheres (HEMA particles)by intraperitoneally injected glucans andor HA
注:注射100mg不同比例的样品,对照组(仅用PBS)值为36.5%。腹腔巨噬细胞中含有3个或更多HEMA粒子被认为具有阳性效果。3个独立的实验中实验数据采用平均值±标准偏差的形式(5支小鼠为一个实验组)。* P≤0.05显著性差异水平。

图3 葡聚糖-HA结合物对Con A刺激脾细胞分泌IL-2的影响
Fig.3 Effects of glucan–HA combinations on Con A-stimulated secretion of IL-2 by spleen cells
注:3个独立的实验中实验数据采用平均值±标准偏差的形式(5支小鼠为一个实验组)。
在最初的实验之后,我们测量试样取自24小时前腹腔内注射的小鼠的细胞因子分泌物。由表3所示的结果可清楚地观察到几个重要的结论:在测试的14种细胞因子中,HA和葡聚糖只刺激其中六种的分泌(IL-2,IL-4,IL-5,IL-6,TNF-a和MPC-1);HC是个例外,它不刺激MCP-1的产生。相对于HZ,相对于单独使用HZ或葡聚糖,与葡聚糖结合对IL-5, IL-6和TNF-a具有更高的刺激。稍微有点不同的是,HC-葡聚糖结合物仅仅在1∶9时才能提高IL-5, IL-6和TNF-a的分泌。在这两种情况下,可以发现对MCP-1分泌的刺激都是微小的。
表3 HA样品和葡聚糖对细胞因子分泌的影响

注:3个独立的实验中实验数据采用平均值±标准偏差的形式(5支小鼠为一个实验组)。阴性对照组(仅PBS)通常为零。*代表P≤0.05葡聚糖-HA和仅葡聚糖或仅HA治疗组的显著性差异水平。
然后,我们专注利用辅助的组合物实验模型,采用免疫卵清蛋白,葡聚糖,HA及将它们与两腹膜剂量的抗原一起使用;用弗氏佐剂作为一个额外的阳性对照。结果表明(图4),组合物在所有情况下对抗原都表现出显著的佐剂活性(光密度,0.311±0.026)。对于HZ,在9∶1时表现出最高的刺激性,而HC,在1∶1和1∶9时表现出最高的刺激性。但必须指出,没有一个葡聚糖增效的体液免疫值达到了弗氏佐剂的水平(光密度,1.67±0.22)。
最后,接种了Ptas64乳腺肿瘤的小鼠,每日在腹膜内注射待测试物质以测试其治疗响应(如图5)。实验重复3次(每组实验用3只小鼠),获得了相似的结果。对照组(仅PBS)肿瘤的平均重量为699.7±38.5 mg。数据表明,对于HZ,对肿瘤生长起强烈抑制作用的分子很明显是葡聚糖,因为单独用葡聚糖的抑制性与HZ-葡聚糖的抑制性是相同的。而对HC-葡聚糖组合物,测试样品在1:1的比例表现出对癌症生长的强烈抑制性。这两种情况下,单独使用HA都没表现出显著的抑制活性。

图4 两腹腔注射HA-葡聚糖组合对抗体形成对抗卵清蛋白的影响。
Fig.4 Effects of two intraperitoneal injections of tested HA glucan combinations on formation of antibodies against ovalbumin
注:小鼠注射2次(间隔2周),7天后收集血清,通过酶联免疫吸附测定法检测针对卵清蛋白特定的抗体的水平。弗氏佐剂中使用作为阳性对照。3个独立的实验中实验数据采用平均值±标准偏差的形式(5支小鼠为一个实验组)。*代表P≤0.05对照组(卵清蛋白)和样品的显著性差异水平。OD为光密度。
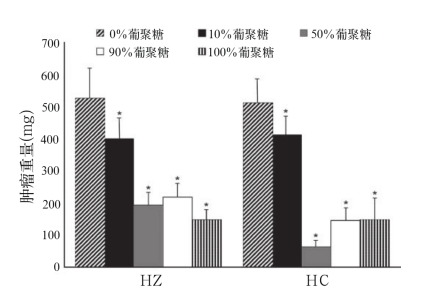
图5 HA-葡聚糖对接种Ptas64乳腺癌的BALB/c小鼠的治疗
效果
Fig.5 HA–glucan therapy of BALB/c mice with Ptas64 mammary carcinoma
注:数据从三组独立的实验中获得(每组实验用3只小鼠)。对每个实验组,治疗2周后测试每组小鼠的肿瘤的重量以此表示治疗响应。每组实验中,每个小鼠个体每天都腹膜注射100 μg的HA,葡聚糖或两者的结合物。对照组的小鼠仅每天腹膜注射PBS,它们的肿瘤重量为699.7±38.5 mg。实验数据采用平均值±标准偏差的形式。*代表P≤0.05治疗组和对照组的显著性差异水平。
3 讨论
腐植酸物质是腐殖质在土壤中的主要成分。它们是动植物遗骸中有机物经化学和微生物降解的产物。它们的溶解度随pH值而不同。这三个主要的腐植酸有机组分可以分为:HA,在碱性pH下可溶,酸性pH下不可溶; 黄腐酸,任何pH值下均可溶; 棕腐酸在任何pH值下不可溶。这些腐植酸物质的结构是不明确的。从定性的角度看,它们呈现相同类型的官能团和空间结构。然而,由于产地的多分散性,难于表明其确切的结构。在一般情况下,它们是具有不同分子量和分子大小的酸聚合电解质,并具有不同的芳香族特性。这些物质的特点是它们能影响不同生物的代谢和生长。因此,腐植酸物质能影响植物代谢,微生物活动和动物生长,这在许多其他的研究中已进行过描述。然而,对结构特征和生物活性的相关研究却很少。不同的研究表明,表征腐植酸物质的实效方法是13C-核磁共振和元素分析法互补使用。我们将这些技术应用于本实验使用的两种腐植酸,在元素分析,特别是在13C-核磁共振(NMR)中能够观察到,在芳族和脂族结构部分,HZ呈现出比HC更多的功能性基团。这种功能性基团主要体现在酚、羰基碳、O-烷基碳的含量较高。但是,HC呈现出显著的芳香性,而HZ呈现出占主导的芳香性和显著的脂肪族排列。表1、表2数据显示了这两个结构完全不同的HAs:HZ具有与芳香族和脂肪族基团结合O型功能基团, HC具有较少功能基团,但具有高芳香性(表1和表2)。
各种类型的免疫调节剂,尤其是葡聚糖,刺激吞噬的作用是公知的。因此,通过评估这类免疫反应,来判定有生物活性的免疫调节剂效力是重要的。我们测试了外周血白细胞和巨噬细胞在吞噬作用中使用HEMA合成微球后的变化。这些微粒具有轻微的负电荷,且也没有特别的附着到细胞表面,这保证了只有活性吞噬细胞内部转化这些惰性粒子。该现象通过相差显微镜,电子显微镜,以及猝灭法已经验证。我们发现,测试的这两种物质引起体外吞噬作用的显著增加,且这两种物质的组合物显示出对巨噬细胞和中性粒细胞的协同效应显著。所示数据不但反映了单次注射试验物质的效果,类似的效果在口服给药后(数据未示出)也可以观察到。将这些实验中观察到的刺激结果于直接的细胞活化,其血液或腹膜腔中各细胞总数和比例都没有变化。
首先,我们通过体外脾细胞刺激关注产生的IL-2数值,发现β-葡聚糖对免疫系统中各种细胞有直接作用,葡聚糖和其他免疫调节剂的免疫刺激作用是增强合成作用和释放若干细胞因子来起作用的。并且发现,HA-葡聚糖的组合物刺激比单独测试时释放更高的IL-2,而90%的HZ在与葡聚糖组合的情况下,释放的IL-2比HZ与ConA组合时更高。
我们评估了对血清中14种不同细胞因子的影响。HC-葡聚糖刺激效果依赖于其比例,所以HZ比HC的刺激效果更明显,而且在所有情况下都比单独使用HA刺激产生细胞因子的效果高。刺激效果最高的细胞因子是IL-5,IL-6和TNF-α,而14个细胞因子中的8个没有检测到刺激效果。
细胞因子是细胞间信息交流的重要载体,它们在免疫系统不同部分中传递信息中起着极其关键的作用。报告中显示癌症中的ILs可以表现出对肿瘤生长的抑制功能及对癌症生长的促进性。肿瘤恶化过程的性质是复杂的,由恶性细胞产生的细胞因子可作为自分泌生长因子和免疫调节剂28。
最近一些研究证实,葡聚糖也可以作为一种佐剂辅助体液免疫反应。我们比较测试了葡聚糖-HA组合物和弗氏佐剂的佐剂活性,结果表明,尽管活性总是低于弗氏佐剂,但确实很显著的,其中葡聚糖-HC两个组合的活性是最高的。
最后,我们决定测试HA-葡聚糖的组合对小鼠体内乳腺肿瘤细胞系Ptas64生长的影响。我们之前的研究工作表明,小鼠和人类CR3对葡聚糖响应有极高的相似性,这使得小鼠肿瘤模型适合于葡聚糖的研究。我们采用了与之前发表的文章相同的实验设计,即采用发酵衍生的葡聚糖。类似于抗体应答,发现1∶1的HC-葡聚糖具有最高的抑制效果,我们观察到有92%以上的抑制率。该结果表明,腐植酸的芳香性在抗肿瘤作用中发挥重要作用,因为HZ比HC的芳香性显著的低,而它没有表现出高的抑制活性。
内毒素污染可能掩盖任一免疫调节剂的实际效果。因此,我们检测了研究方案中的脂多糖污染,测定的结果都小于10EU。另外,我们用10μg/mL多粘菌素B处理葡聚糖和HA,降低脂多糖的功能,两种情况下得到了相同的结果。从常规的和无脂的多糖材料中取得的结果也是相似的,表明微量脂多糖的存在对提高免疫活性和抗肿瘤反应是无影响的。
概括我们的数据,表明腐植酸具有生物免疫调节活性,影响体液和细胞免疫反应。另外,HZ和HC在免疫反应的刺激中协同作用,这一发现为这些天然免疫调节剂的进一步研究提供支持。
参考文献(略)
译自:J Med Food,2010,13 (4):863~869。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















