一、目的及要求
1.测定甲基红的酸离解平衡常数。
2.掌握TU1810型分光光度计和pHS-2C型pH计的使用方法。
二、实验原理
甲基红(对-二甲氨基-邻-氨基偶氯苯)的分子式为 ,是一种弱酸型的染料指示剂,具有酸(HMR)和碱(MR-)两种形式。它在溶液中部分电离,在碱性溶液中呈黄色,酸性溶液中呈红色。在酸性溶液中,它以两种离子形式存在
,是一种弱酸型的染料指示剂,具有酸(HMR)和碱(MR-)两种形式。它在溶液中部分电离,在碱性溶液中呈黄色,酸性溶液中呈红色。在酸性溶液中,它以两种离子形式存在

其离解平衡常数:

由于HMR和MR-两者在可见光谱范围内具有强的吸收峰,溶液离子强度的变化对它的酸离解平衡常数没有显著的影响,而且在简单CH3COOH-CH3COONa缓冲体系中就很容易使颜色在pH=4~6内改变,因此比值[MR-]/[HMR]可用分光光度法测定而求得。
对一化学反应平衡体系,分光光度计测得的光密度包括各物质的贡献,由朗伯-比尔定律
![]()
当c的单位为mol·L-1,l的单位为cm时,ε为摩尔吸光系数。由此可推知甲基红溶液中总的光密度为

DA、DB分别为在HMR和MR-的最大吸收波长处所测得的总的吸光度。 、
、 和
和 、
、 分别为在波长λA和λB下的摩尔吸光系数。各物质的摩尔吸光系数值可由作图法求得。例如首先配制出pH≈2的具有各种浓度的甲基红酸性溶液,在波长λA下分别测定各溶液的光密度D,作D-c图,得到一条通过原点的直线。由直线斜率可求得
分别为在波长λA和λB下的摩尔吸光系数。各物质的摩尔吸光系数值可由作图法求得。例如首先配制出pH≈2的具有各种浓度的甲基红酸性溶液,在波长λA下分别测定各溶液的光密度D,作D-c图,得到一条通过原点的直线。由直线斜率可求得 值,其余摩尔吸光系数求法类同,从而可求出[MR-]与[HMR]的相对量。再测定溶液的pH,最后按式(5-5)求p K值。
值,其余摩尔吸光系数求法类同,从而可求出[MR-]与[HMR]的相对量。再测定溶液的pH,最后按式(5-5)求p K值。
三、仪器与试剂
1.仪器
TU-1810型分光光度计
722型分光光度计
pHS-2C型pH计
2.试剂
甲基红贮备液:0.5 g晶体甲基红溶于300 mL 95%的乙醇中,用蒸馏水稀释至500 mL
标准甲基红溶液:取8 mL贮备液加50 mL的乙醇稀释至100 mL
pH为6.84的标准缓冲溶液:CH3COONa(0.04 mol·L-1)、CH3COONa(0.01 mol·L-1)、CH3COOH(0.02 mol·L-1)、HCl(0.1 mol·L-1)、HCl(0.01 mol·L-1)
四、实验步骤
1.测定甲基红酸式(HMR)和碱式(MR-)的最大吸收波长。
测定下述两种甲基红总浓度相等的溶液的光密度随波长的变化,即可找出最大吸收波长。
第一份溶液(A):取10 mL标准甲基红溶液,加10 mL 0.1 mol/L的HCl,稀释至100 mL。此溶液的pH大约为2,因此此时的甲基红以HMR存在。
第二份溶液(B):取10 mL标准甲基红溶液和25 mL 0.04 mol/L CH3COONa溶液稀释至100 mL,此溶液的pH大约为8,因此甲基红完全以MR-存在。
取部分A液和B液分别放在1 cm的比色皿内,在350~600 nm之间每隔10 nm测定它们相对于水的光密度,找出最大吸收波长。
2.检验HMR和MR-是否符合比尔定律,并测定它们在λA、λB下的摩尔吸光系数。
取部分A液和B液,分别各用0.01 mol·L-1的HCl和CH3COONa稀释至原溶液的0.75倍、0.5倍、0.25倍及原溶液,为一系列待测液,在λA、λB下测定这些溶液相对于水的光密度。由光密度对溶液浓度作图,并计算两波长下甲基红HMR和MR-的εA,HMR、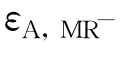 、
、 、
、 。
。
3.求不同pH下HMR和MR-的相对量。
在4只100 mL容量瓶中分别加入10 mL标准甲基红溶液和25 mL 0.04 mol/L的CH3COONa溶液,并分别加入50 mL、25 mL、10 mL、5 mL的0.02 mol/L的CH3COOH,然后用蒸馏水定容。测定两波长下各溶液的光密度DA、DB,用pH计测定溶液的pH。
由于光密度是HMR和MR-之和,所以溶液中HMR和MR-的相对量用式(5-6)和式(5-7)求得。再代入式(5-5),可计算甲基红的酸离解平衡常数p K。
五、数据处理
温度:______
实验数据记录及处理表

六、思考题
1.在本实验中,温度对实验有何影响?采取什么措施可以减少这种影响?
2.甲基红酸式吸收曲线与碱式吸收曲线的交点称为“等色点”,讨论此点处光密度与甲基红浓度的关系。
3.为什么要用相对浓度?为什么可以用相对浓度?
4.在光密度测定中,应该怎样选择比色皿?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















