一、目的及要求
1.巩固电导滴定的理论知识。
2.学会电导滴定的分析操作。
3.学会绘制电导滴定曲线及滴定终点的确定方法。
4.测定HCl和HAc混合溶液中HCl和HAc的含量。
二、实验原理
电导滴定是容量分析法的一种,其终点是根据滴定过程中电导的变化来确定的。
用NaOH溶液滴定HCl和HAc混合溶液时,HCl首先被中和,溶液中迁移速度较大的氢离子被加入的OH-中和而生成难以电离的水及迁移速度较小的Na+所代替。反应如下:
H++Cl-+Na++OH→Na++Cl-+H2O
已知Na+的摩尔电导小于H+的摩尔电导,因此,在化学计量点前随滴定的进行,溶液的电导不断下降。化学计量点后,随着过量NaOH的加入,溶液中的Na+和OH-浓度增加,则溶液的电导也随之增大。当HCl被中和完后,HAc开始被中和,生成难电离的H2O和易离解的NaAc,其反应如下:
![]()
所以电导略有增加,当NaOH过量时,由于OH-溶液中迁移速度很大,使电导迅速上升。以溶液的电导为纵坐标,NaOH标准溶液的体积为横坐标绘图,如图12-3所示。
根据图12-3可得出具有两个拐点的滴定曲线,第一个拐点A所对应的体积为滴定HCl所消耗的NaOH量,滴定HAc所需的NaOH量应为两个拐点A、B所对应的体积之差。根据当量定律即可求出HCl和HAc的含量。
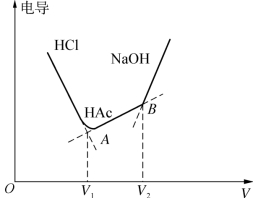
图12-3 NaOH标准溶液的体积-电导曲线图
三、仪器与试剂
1.仪器
电导率仪
铂黑电极
微型磁力搅拌器
2.试剂
邻苯二甲酸氢钾(分析纯)
1%酚酞指示剂
1.00 mol/L NaOH标准溶液
0.100 0 mol/L NaOH标准溶液
NaOH标液的标定:在分析天平上准确称取三份已在105~110℃烘干1 h的分析纯邻苯二甲酸氢钾,每份约为1~1.5 g放于250 mL锥形瓶中,用50 mL煮沸后冷却的蒸馏水使之溶解(若没有完全溶解,可稍加热),冷却后加入两滴酚酞指示剂,用NaOH标液滴定至呈微红色30 s内不褪,即为终点,准确计算NaOH的浓度
HCl未知溶液(0.1 mol/L)
HAc未知溶液(0.1 mol/L)
四、实验步骤
1.准备仪器,清洗好电极。
2.分别吸取未知HCl和HAc溶液各20 mL,置于小烧杯中(三份),并用水清洗杯壁,将烧杯置于磁力搅拌器上,使溶液充分搅拌。
3.用已知的标准NaOH溶液进行滴定,测量相应的电导率。
4.根据消耗NaOH的体积和所测得的电导值绘制G-V滴定曲线,并分别确定两个滴定终点。
5.分别计算未知液的HCl和HAc的浓度和测定的平均值差。
6.测定完毕,整理好仪器和电极。
五、数据处理
1.原始数据
实验数据记录于表12-2。
表12-2 实验原始数据记录表

2.数据处理
(1)作出电导滴定曲线G-V,查出V1、V2。
(2)HCl浓度计算:![]()
HAc浓度计算:![]()
式中,M为物质的量浓度,mol/L;V1为滴定盐酸时消耗氢氧化钠标准溶液的体积,mL;V2为滴定盐酸和醋酸混合溶液时消耗氢氧化钠标准溶液的体积,mL。
六、思考题
1.什么是电导滴定曲线?电导曲线是根据什么来判断滴定终点的?
2.影响电导测定的因素有哪些?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














