一、目的及要求
1.巩固电导滴定的理论知识。
2.学会电导滴定的分析操作。
3.学会绘制电导滴定曲线及滴定终点的确定方法。
4.测定水质中溶解氧的含量。
二、实验原理
溶解氧(DO)是评价地面水质的重要指标,它的测定是环境监测中常见的检测项目,在工业、农业、医疗和科研等各个领域也有广泛的应用。水中溶解氧与金属铊作用,将Tl氧化为TlOH,然后用HCl溶液滴定体系中的OH-,反应式为
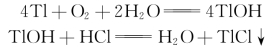
TlOH是一种强电解质,在滴定开始前,溶液具有一定的电导率,随着HCl溶液的加入,反应产物TlCl是一种沉淀,H2O是弱电解质,电导率非常小,因而溶液电导率迅速下降。到化学计量点后,TlOH反应完全,溶液的电导率随着HCl溶液的加入而缓慢增长。这样在化学计量点前后,由于溶液电导率的变化导致出现两条不同斜率的直线,其交点即为化学计量点,如图12-4所示。因此,我们可以通过测定化学计量点前后若干点的电导率,再通过作图法求出到达化学计量点时消耗HCl溶液的体积,从而计算水中溶解氧的含量。
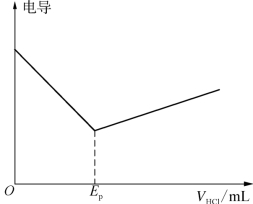
图12-4 电导滴定曲线
三、仪器与试剂
1.仪器
电导率仪
铂黑电极
微型磁力搅拌器
2.试剂
HCl标准溶液(分析纯):0.010 00 mol/L
金属铊(分析纯)
混合床离子交换树脂
充氧蒸馏水:用空压机向蒸馏水中充氧约5 min,保存于20℃的生化培养箱中备用
四、实验步骤
1.将混合床离子交换树脂浸泡后装入滴定管中,将水样倒入滴定管通过树脂进行离子交换。
2.将交换水装满溶解氧瓶,加入0.2 g金属铊粒,密封,放置暗处30 min后取出,混匀。
3.取100 mL溶液倒入烧杯中,放入搅拌器,开动搅拌机,用0.010 00 mol/L的HCl溶液滴定,每加入1 mL HCl溶液,读取一次电导率,直至加到15 mL为止。
4.根据消耗HCl的体积和所测得的电导值绘制G-V滴定曲线,并确定滴定终点。
5.计算水中溶解氧的值。
6.测定完毕,整理好仪器和电极。
五、数据处理
1.原始数据
实验数据记录于表12-3。
表12-3 实验原始数据记录表

2.数据处理
(1)作出电导滴定曲线:G-V,查出V1。
(2)溶解氧的计算:
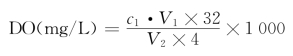
式中,c1为HCl溶液物质的量浓度,mol/L;V1为滴定至计量点时消耗HCl溶液的体积,mL;V2为水样的体积,mL。
六、思考题
1.离子交换树脂的作用是什么?
2.电导滴定和传统的溶解氧测定方法(如碘量法、传感器法等)相比有何特点?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















