绝大多数的神经元树突和胞体与其他神经元形成突触结构,接受其他神经元传来的信息,而自身的信息又通过轴突与其他神经元构成的突触结构传递到其他神经元。那么信息(即动作电位)在神经元自身是如何传递的,而信息又是如何在两个相连的神经元之间进行传递呢?接下来,我们来看看动作电位和突触传递。
一、动作电位
动作电位(action potential,AP)是指细胞在静息电位基础上接受有效刺激后产生的一个迅速的可向远处传播的膜电位波动。在这里笔者要特别说明,我们机体的每一个细胞都具有生物电,所谓的静息电位,就是细胞未受任何刺激时(或许我们按字面意思可理解为就是细胞静止时)的膜内外的电位差。一般细胞在静息时膜内带的负电荷多,膜外带的正电荷多,所以膜内为负膜外为正。两者之间的电位差,不同的组织细胞是不同的,神经细胞大约为-70mv。细胞膜的内负外正的这种电位情况,叫极化,如果在某种情况下(一般都是细胞受到刺激),细胞内负外正的差值缩小,就叫去极化,去极化后又恢复到极化状态的过程就叫复极化,如果复极后的差值比细胞静息时还大,这种状态就叫超极化。
我们以神经细胞为例来看看动作电位,当神经细胞受到一个有效刺激时,其膜电位就从-70mv逐渐去极化到达阈电位水平(约为-55mv),此后迅速上升至+30mv,形成动作电位的升支(去极相,整个升支就是细胞去极化的过程);随后又迅速下降至接近静息电位水平,形成动作电位的降支(复极相,整个下降支就是细胞复极化的过程)。两者共同形成尖峰状的电位变化(阈电位以上的电位曲线),称为锋电位(spike potential)。锋电位是动作电位的主要部分,被视为动作电位的标志(意思就是出现锋电位,就证明该细胞产生了动作电位)。锋电位之后膜电位的低幅、缓慢波动,称为后电位(after potential)。后电位包括前后两个部分,前一部分的膜电位仍小于静息电位,称为后去极化电位(ADP);后一部分大于静息电位,称为后超极化电位(AHP)(这个时间细胞处于超极化状态)。如果沿用电生理学发展早期使用细胞外记录的方法对后电位命名,后去极化电位可称为负后电位,后超极化电位可称为正后电位。后电位的持续时间较长,哺乳动物A类神经纤维的后电位可持续将近100ms。后电位结束后膜电位才又恢复到稳定的静息电位水平(图2-10)。

图2-10 神经细胞动作电位模式图
动作电位具有以下特点:①“全或无”现象要使细胞产生动作电位,所给的刺激必须达到一定的强度。若刺激未达到一定强度,细胞不会产生动作电位(这种状态就是“无”);当刺激达到一定的强度时,细胞就产生动作电位,其幅度达到该细胞动作电位的最大值,并不会随刺激强度的继续增强而增大(也就是说,只要刺激超过一定的强度,该细胞产生的动作电位就是一样的,并不因为刺激强度的变化而变化,这就叫“全”),这就是动作电位的“全或无”(all or none)现象。②不衰减传播。细胞的动作电位一旦产生,并不停留在受刺激处的局部细胞膜,而是沿细胞膜迅速向四周传播,直至传遍整个细胞膜,而且它的幅度和波形在传播过程中始终保持不变。③脉冲式发放。连续刺激所产生的多个动作电位总有一定间隔而不会融合起来,而是呈现一个个分离的脉冲式发放,不会像机械波一样出现叠加和融合现象。
二、动作电位的触发
1.阈刺激
在前面我们提到了动作电位的产生需要有效刺激,那刺激是什。?刺激(stimulus)就是指细胞所处环境的变化,包括物理、化学和生物等性质的环境变化(请记住,是这些环境因素的变化叫刺激;如若环境因素不变化,就不能成为刺激)如果要使细胞对刺激能够发生反应,特别是使某些细胞产生动作电位,刺激就必须要达到一定的量。刺激的量通常包括三个参数,即刺激的强度、刺激的持续时间和刺激强度—时间变化率。由于电刺激的这三个参数很容易控制,且重复性好,对组织的损伤性小,故生理学实验中常常选用电脉冲作为人工刺激,而在实际测试中为了方便起见,常将刺激的持续时间和强度—时间变化率固定,观察刺激强度与细胞反应的关系。能使细胞产生动作电位的最小刺激强度(也就是刚刚能够使细胞产生动作电位的刺激强度),称为阈强度(threshold intensity)或阈值(threshold value)。相当于阈强度的刺激称为阈刺激(threshold stimulus)。大于或小于阈强度的刺激分别称为阈上刺激和阈下刺激。所谓有效刺激,指的就是能使细胞产生动作电位的阈上刺激或阈刺激哟。
2.阈电位
上面提到了当刺激使细胞的膜去极化到阈电位水平,就会使细胞产生动作电位,那什么是阈电位呢?所谓阈电位,就是当某些刺激引起膜内的正电荷增加,当然负电位就减小(去极化)并减小到一个临界值时,细胞膜中的钠通道这时就大量开放致使大量的Na+内流(细胞外的Na+浓度是细胞内Na+浓度的12倍,所以钠通道一开放,Na+就从细胞外向细胞内流动)到细胞内而触发动作电位,这个刚能触发动作电位的膜电位临界值称为阈电位(threshold potential,TP)。阈下刺激通常不能触发动作电位,在某些情况下,刺激即使达到阈值,但是若此时细胞膜处于超极化,也不能触发动作电位,如一些神经递质作用于细胞后引起Cl-内流(Cl-细胞外的浓度是细胞内的29倍),此时细胞内负电荷增加,处于超极化状态,也就是说细胞此时处于抑制状态。一般来说,细胞的阈电位比静息电位小10~20mv,如神经细胞的静息电位约-70mv,其阈电位为-55mv左右。所以,至此,大家就能理解阈刺激了,阈刺激就是其强度刚好能使细胞的静息电位发生去极化达到阈电位水平的刺激。这时大家一定要注意,就是一定强度的阈下刺激虽然也能使部分钠通道开放,引起Na+内流而产生轻微的去极化,但由于达不到阈电位水平,其去极化很快被增强的K+外流(细胞内K+的浓度远远高于细胞外,所以K+从细胞内向细胞外流动)所抵消而出现复极化。当刺激引起的去极化达到阈电位水平时,则K+外流不足以对抗Na+内流,于是在净内向电流的作用下,膜发生的去极化与Na+电导之间形成正反馈,使膜电位出现爆发性去极化,形成动作电位陡峭的升支。所以,对那些以钠通道大量开放而触发的动作电位而言,阈电位也可定义为刚好能触发膜去极化与Na+电导之间形成正反馈的膜电位水平。动作电位之所以具有“全或无”特点,是因为刺激强度只决定是否能使膜去极化达到阈电位水平,一旦到达阈电位即可爆发动作电位,而动作电位的幅度和速度则取决于钠通道的性状和离子所受到的电——化学驱动力大小,不再与刺激强度变化相关。
三、动作电位在神经纤维上的传导
1.动作电位在同一细胞上的传播
细胞膜的某一部分产生的动作电位可沿细胞膜不衰减地传遍整个细胞,这一过程也称为传导。动作电位传导的原理可用局部电流学说解释。如图2-11所示,在动作电位的发生部位即兴奋区,膜两侧电位呈外负内正的反极化状态,而与它相邻的未兴奋区则仍处于外正内负的极化状态(图2-11B)。因此,兴奋区与邻旁未兴奋区之间将出现电位差,并产生由正电位区流向负电位区的电流。这种在兴奋区与邻旁未兴奋区之间的电˙为局部电流,局部电流的方向在膜内侧是由兴奋区经细胞内液流向邻旁未兴奋区,向外穿过质膜后,又经细胞外液返回兴奋区,构成电流回路。局部电流的结果是使邻旁未兴奋区的膜电位减小,即发生去极化,当此处膜去极化达到阈电位时即可触发该区爆发动作电位,使它成为新的兴奋区(图2-19C),而原来的兴奋区则进入复极化状态。新的兴奋区又与其前方的安静区再形成新的局部电流,恰如多米诺骨牌倾倒一样,一处发生的兴奋将成为下一处兴奋的诱因,从而使动作电位由近及远地传播开来。因此,动作电位在同一细胞上的传导实质上是细胞膜依次再生动作电位的过程。如果细胞各部位的质膜对Na+的通透性以及Na+的电——化学驱动力维持不变,动作电位就能不衰减地传导下去。此外,由于兴奋区和邻旁安静区之间的电位差高达100mv(即动作电位的幅值),是邻旁安静区去极化到阈电位所需幅值(10~20mv)的数倍,故局部电流的刺激强度远大于细胞兴奋所需的阈值,因而动作电位在生理情况下的传导是十分“安全”的。
在无髓神经纤维或肌纤维,兴奋传导过程中局部电流在细胞膜上的传递是顺序发生的,即整个细胞膜都依次发生Na+内流和K+外流介导的动作电位;而在有髓神经纤维,动作电位的传导则有所不同。有髓纤维的轴突具有胶质细胞反复包绕形成的髓鞘。髓鞘不是连续的,每隔一段(约1mm)便有一个轴突裸露区(1~2μm),即郎飞结。在有髓鞘包裹的区域,膜中几乎没有钠通道,且轴浆与细胞外液之间的膜电阻因胶质细胞膜的多层包裹而加大,轴突因而跨膜电流大大减小,膜电位的波动达不到阈电位。在郎飞结处,轴突膜中的钠通道非常密集(可达104~105个),且轴突膜是裸露的,故跨膜电流较大,膜电位的波动容易达到阈电位。所以,在有髓神经纤维上,只有郎飞结处才能发生动作电位,局部电流也仅在兴奋区的郎飞结与邻旁安静区的郎飞结之间发生(图2-11下)。当一个郎飞结的兴奋通过局部电流影响到邻旁郎飞结并使之去极化达到阈电位时,即可触发新的动作电位(图2-11下)。这种动作电位从一个郎飞结跨越结间区“跳跃”到下一个郎飞结的传导方式称为跳跃式传导。

图2-11 神经纤维动作电位传导模式图
上图表示动作电位在无髓神经纤维上的传导,下图表示有髓鞘神经纤维的动作电位传导过程,箭头示最先产生动作电位的部位。
有髓神经纤维及其跳跃式传导是生物进化的产物。首先,有髓纤维的传导速度比无髓纤维快得多。在无脊椎动物,提高动作电位传导速度的方式是增加轴突直径,因而在枪乌贼出现直径达1mm的巨轴突;而高等动物则以轴突的髓鞘化来提高传导速度,这使得直径仅4μm的有髓纤维和直径600μm的无髓纤维具有相同的传导速度(25m/s)。有髓神经纤维最高的传导速度可达100m/s以上,而许多无髓神经纤维的传导速度尚不足1m/s。其次,神经纤维髓鞘化不仅能提高动作电位的传导速度,还能减少能量消耗。因为动作电位只发生在郎飞结,因而传导过程中跨膜流入和流出的离子将大大减少,它们经主动转运返回时所消耗的能量也显著减少。多发性硬化症属于一种自身免疫性疾病,其病理改变为有髓神经纤维髓鞘进行性丢失。因此,神经纤维传导速度减慢,甚至完全中断,患者可出现瘫痪或感觉丧失等症状。
2.动作电位在细胞之间的传播
一般而言,细胞之间的电阻很大,无法形成有效的局部电流,因此动作电位不能由一个细胞直接传播到另一个细胞。但是在某些组织,如脑内某些核团、心肌以及某些种类的平滑肌,细胞间存在缝隙┆(gap junction)(图2-8),缝隙┆是一种特殊的细胞间┆方式,可使动作电位在细胞之间直接传播。在缝隙连接处,相耦联的两个细胞的质膜靠得很近(2~3nm),每侧细胞膜中都规则地排列着一些蛋白颗粒,它们是由6个┆ī(connexin)单体形成的同六聚体,称为┆子(connexon)。每个┆子中央有一个亲水性孔道。两侧膜中的┆子端端相连,亲水性孔道对接,由此形成连通两个细胞胞质的缝隙连接通道(gap junction channel)。这些缝隙连接通道属于非门控通道,常处于开放状态,孔径为1.2~2nm,允许小分子(分子量小于1.0kD)的水溶性物质和离子通过。在以缝隙连接相连的细胞群中,其中一个细胞产生动作电位后,局部电流可通过缝隙连接直接传播到另一个细胞。缝隙┆的生理意义在于使某些同类细胞发生同步化活动,如心肌细胞的同步收缩有利于射血、子宫平滑肌的同步收缩有利于胎儿分娩。神经细胞之间的缝隙┆也称电突触(electrical synapse),与化学性突触相比,电突触具有兴奋传播速度快和双向传播等特点,可使某些功能相同的神经元发生同步化活动。当细胞内Ca2+浓度增高和(或)p H值降低时,缝隙连接通道可关闭。
四、突触传递
神经元之间,除了上面描述的电突触连结(动作电位可以直接通过电突触传给下一个神经元)外,绝大多数的连结方式是化学性突触连结,所以,我们更应该了解化学性突触的信息传递方式。
在前面对化学性突触的结构进行了叙述,接下来我们了解一下信息在突触的传递情况。
当一个突触前神经元兴奋,动作电位就沿着轴突一直传递到轴突末梢,这时轴突末梢部位的细胞膜也产生了动作电位,触发位于此处细胞膜上Ca2+通道迅速开放,大量的Ca2+流入轴突末梢的胞浆内,然后开启一系列的突触传递程序。
1.经典突触的传递
当突触前神经元的兴奋传到末梢时,突触前膜去极化,当去极化达一定水平时,突触前膜中的电压门控通道开放,Ca2+从细胞外进入突触前末梢轴浆内,导致轴浆内Ca2+浓度的瞬时升高(细胞外Ca2+浓度是细胞内Ca2+浓度的104倍左右),由此触发突触囊泡的出胞,即引起末梢递质的量子式释放(即递质释放量的多少与进入的Ca2+的多少有关系,Ca2+进入越多,递质的释放量就越大,反之亦然)。随后,轴浆内Ca2+主要由Na+-Ca2+交换迅速外流而恢复轴浆内Ca2+浓度(Na+-Ca2+是一种离子交换泵,及Na+进入细胞内交换出Ca2+,Ca2+就从胞内流出到胞外,这个过程是需要消耗能量才能完成的)。递质的释放量与进入轴浆内的Ca2+量呈正相关。
由轴浆内Ca2+浓度突然升高触发递质释放的机制十分复杂,须经历突触囊泡的动员、摆渡、着位、融合和出胞等步骤(图2-12)。就目前所知,平时(指轴突末梢静息时)突触囊泡由突触ī(synapsin)固定于细胞骨架丝上,一般不能自由移
动。当轴浆内Ca2+浓度升高时,Ca2+与轴浆中的钙调ī(CaM)结合为Ca2+-CaM复合物。于是依赖Ca2+-CaM的蛋白激酶Ⅱ被激活,促使突触ī磷酸化,使之与细胞骨架丝的结合力减弱,突触囊泡便从骨架丝上脱离出来,这一步骤称为动员。此后,游离的突触囊泡在轴浆中一类小分子GīRab3的帮助下向活化区移动,这一步骤称为摆渡。被摆渡到活化区的突触囊泡在与突触前膜发生融合之前须固定于前膜上,这一步骤称为着位,参与着位的蛋白包括突触囊泡膜中的突触囊泡ī
(v-SNARE)和突触前膜中的靶ī(t-SNARE),目前已鉴定脑内的t-SNARE有突触融合蛋白(syntaxin)和SNAP-25两种,当突触囊泡ī和两种靶ī结合后,着位即告完成。随即,突触囊泡膜上的另一种蛋白,即突触结合蛋白(synaptotagmin,或称p65)在轴浆内高Ca2+条件下发生变构,消除它对融合的钳制作用,于是突触囊泡膜和突触前膜发生融合(fusion)。出胞(exocytosis)是通过突触囊泡膜和突触前膜上暂时形成的融合孔(fusion pore)进行的。出胞时,融合孔的孔径迅速由1 nm左右扩大到50 nm左右,递质从突触囊泡释出。在中枢神经系统,自Ca2+进入突触前末梢至递质释放仅需0.2~0.5ms即可完成。所以,在这里我们应该看到,虽然看上去步骤很多,其实就是一瞬间,递质就释放到突触间隙内了。
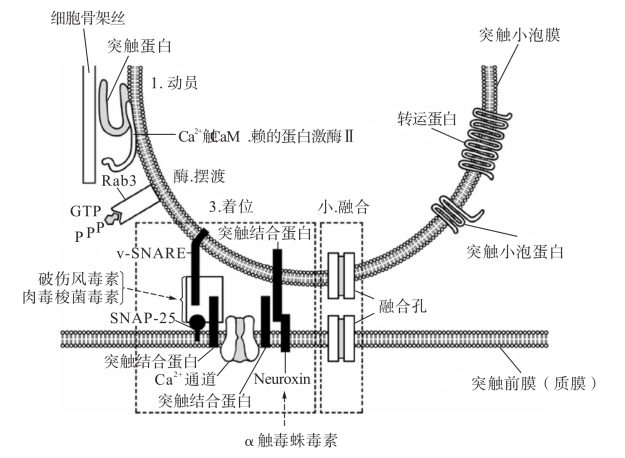
图2-12 突触传递过程突触囊泡释放递质的示意图
图示突触囊泡在Ca2+的触发下所经历的动员、摆渡、着位和融合等一系列步骤。图中的突触囊泡附着在细胞骨架丝上,在激活的Ca2+-CaM依赖的蛋白激酶Ⅱ(Ca2+-CaMKⅡ)的作用下被动员,然后在小G蛋白Rab3的帮助下完成摆渡,着位和融合分别用两个虚线框分开。虚线箭头表示多种神经毒素的作用靶点(引自朱大年《生理学》第8版,2013年版)
递质进入突触间隙后,经扩散抵达突触后膜,作用于后膜中的特异性受体或递质门控通道,引起突触后膜对某些离子通透性的改变,使某些带电离子进出后膜,突触后膜即发生一定程度的去极化或超极化。突触后膜的这种电位变化称为突触后电位(postsynaptic potential)。
从这里,大家应该看到的是,动作电位从突触前神经元传来,引起突触后神经元局部胞膜的电位发生变化,这种变化后的电位叫突触后电位。如果这个后电位有比静息电位大,那就是我们前面所说的突触后膜发生超极化,突触后神经元就比静息时更难以兴奋,我们认为,此突触对突触后神经元的作用是抑制作用;而反过来,如果这个产生的突触后电位比静息电位小,我们就说突触后膜发生了去极化,此时突触后神经元就比静息时更容易兴奋,所以我们就认为,此突触对突触后神经元的作用是兴奋作用。但是,大家一定要弄明白的是,不是一个突触就能够使突触后神经元发生动作电位,一个神经元在树突、胞体部位有上万的突触结构,这些突触产生的突触后电位要进行总和,如果总和后达到阈电位,此时突触后神经元就产生动作电位(即发生兴奋),如果没有达到阈电位,甚至大于静息电位,突触后神经元就处于抑制状态,当然也无法兴奋。

图2-13 非定向突触传递的结构模式右上部分示放大的曲张体和平滑肌
2.非定向突触传递
非定向突触(non-directed synapse)是指突触前、后两部分之间无紧密解剖学关系的突触,即突触前末梢释放的递质可扩散至距离较远和范围较广的突触后结构,此类传递也称非突触性化学传递(non-synaptic chemical transmission),其典型例子是自主神经(多见于交感神经)节后纤维与效应细胞之间的接头,如交感神经末梢到达血管平滑肌或心肌处的神经-肌接头。肾上腺素能神经元的轴突末梢有许多分支,分支上约每隔5μm出现一个膨大结构,称为曲张体(varicosity)。一个神经元上的曲张体可多达3×104个。曲张体外无施万细胞包裹,曲张体内含大量小而具有致密中心的突触囊泡,内含高浓度的去甲肾上腺素;但曲张体并不与突触后效应细胞形成经典的突触联系,而是沿分支抵达效应细胞的近旁(图2-13),当神经冲动传到曲张体时,递质从曲张体释出,经扩散与效应细胞上的相应受体结合,产生与突触后电位相似的接头电位(junction potential)。
非定向突触传递也可见于中枢神经系统,主要发生在单胺类纤维末梢部位。如大脑皮层内一些无髓鞘的去甲肾上腺素能纤维、黑质的多巴胺能纤维以及脑干5-羟色胺能纤维均以这种模式进行传递。此外,在轴突末梢以外的部位也能进行非定向突触传递,如有的轴突膜能释放乙酰胆碱,有的树突膜能释放多巴胺等。
与定向突触传递相比,非定向突触传递的特点有:①突触前、后结构并不一一对应,即无特化的突触后膜结构,一个曲张体释放的递质可作用于突触后结构的许多靶点,即相应的受体,但其分布较为分散;②递质扩散的距离较远,且远近不等,曲张体与效应细胞之间的距离一般大于20nm,有的甚至超过400nm,故突触传递的时间较长,且长短不一,递质弥散的距离大,因此传递花费的时间可大于1s;③释放的递质能否产生效应,取决于突触后结构上有无相应受体。
由上面我们可以看到,信息在神经元之间的传递,主要是靠神经递质来完成的,所以递质作用于后神经元使其兴奋或抑制,是决定后神经元是否参与作用的关键。如果,递质作用产生的后电位使后神经元兴奋,那么后神经元就在神经回路上发挥该神经元的作用,并继续将产生的动作电位下传,使其轴突末梢释放递质来影响与该神经元连结的后神经元的兴奋状态;而递质作用产生的后电位使后神经元抑制,那么后神经元就处于抑制状态,失去其应用的功能。
神经纤维的传递很有可能一部分是机械波或者电脉冲
丹麦哥本哈根大学的托马斯·海姆博格(Thomas Heimburg)和他的同事通过实验发现,本该在神经纤维上碰撞湮灭的两个神经信号却擦肩而过(图2-14)。
所谓的“相撞湮灭”上一次实验证据还是在1949年,之后再也没有得到重复。他们选取了蚯蚓和龙虾的腹神经索的神经元,用电极在两端同时刺激它们,然后记录信号相撞之后的电位差。结果发现,不管是蚯蚓的有髓鞘神经纤维,还是龙虾的无髓鞘神经纤维,信号在相撞后不管是速度还是形状都没有变化。
所以,神经元里的脉冲信号传播很可能不是相撞湮灭的骨牌模型(多米诺骨牌),而是某种电磁-机械脉冲。事实上还有很多证据表明,在脉冲传递过程中,神经元的粗细发生了改变,而且也没有像经典模型预言的那样因为骨牌摔倒(电位改变)而散发出热量。因此,它们认为,神经信号的传递大概更像电脉冲或者声波脉冲,是一个物理现象,或者至少有很大的物理成分,而非过去以为的那样是个离子浓度变化导致的电位差。

图2-14 两种不同信号传递模式的示意图
在左边的“穿透”模式里,两个信号相撞之后互不干扰、正常通过;右边的“ī”模式里,相撞导致消失。(图片来源:Thomas Heimburg)
3.突触后电位
前面已经谈到,当递质与突触后膜受体接触,引起突触后膜是否发生去极化或超极化,可将突触后电位(包括接头电位)分为兴奋性和抑制性突触后电位两种。此外,根据电位时程的长短又可分为快、慢突触后电位两种。
(1)兴奋性突触后电位:突触后膜在某种神经递质作用下局部发生去极化电位变化称为兴奋性突触后电位(excitatory postsynaptic potential,EPSP)。例如,脊髓前角运动神经元接受肌梭的传入纤维投射而形成突触联系,当电刺激相应肌梭的传入纤维后约0.5ms,运动神经元胞体的突触后膜即发生去极化(图2-15A、图2-15B)。这是一种快EPSP,它和骨骼肌终板电位一样,具有局部兴奋的性质。EPSP的形成是兴奋性递质作用于突触后膜的相应受体,使某些离子通道开放(主要是钠、钾离子通道),突触后膜对Na+和K+的通透性增大,但Na+内流大于K+外流,故发生净内向电流(向膜内流向的正电荷多于向膜外流向的正电荷,故膜内的正电荷增加,膜内电位升高),导致后膜出现局部去极化。
慢EPSP最早在牛蛙交感神经节中被记录到,后来发现ī存在于中枢神经系统。慢EPSP的潜伏期为100~500ms,可持续数秒至数十秒,如在交感神经节记录到的慢EPSP可持续30 s。慢EPSP通常由膜的K+电导降低而引起。在交感神经节,K+电导的降低由乙酰胆碱激活M型胆碱能受体所触发。在交感神经节还发现有一种迟慢EPSP,其潜伏期为1~5 s,持续时间可达10~30 min。迟慢EPSP的形成也与膜的K+电导降低有关,而有关递质则可能是促性腺激素释放激素或与之酷似的肽类物质。
(2)抑制性突触后电位:突触后膜在某种神经递质作用下产生的局部超极化电位变化称为抑制性突触后电位(inhibitory postsynaptic potential,IPSP)。如来自伸肌肌梭的传入冲动在兴奋脊髓伸肌运动神经元的同时,通过抑制性中间神经元抑制脊髓屈肌运动神经元。若电刺激伸肌肌梭的传入纤维,屈肌运动神经元膜将出现超极化(图2-15A、2-15C)。这是一种快IPSP。其机制是抑制性中间神经元释放的抑制性递质作用于突触后膜,使后膜中的氯通道开放,引起外向电流(内向负电流,Cl-由于浓度梯度从细胞外进入细胞内,引起细胞内负电荷增加,膜内电位降低到超过静息电位),结果使突触后膜发生超极化。此外,IPSP的形成还可能与突触后膜钾通道的开放或钠通道和钙通道的关闭有关。
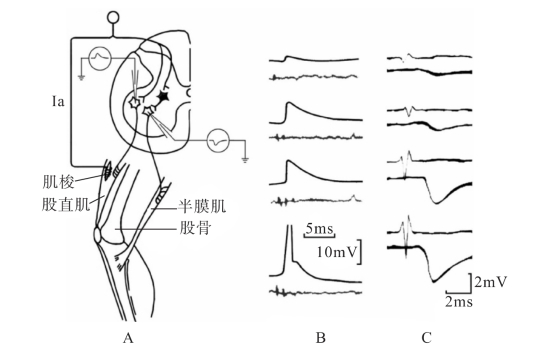
图2-15 兴奋性突触后电位(EPSP)和抑制性突触后电位(IPSP)
A.电位记录:图中记录电极插入支配股直肌(伸肌)的脊髓前角运动神经元胞体内,以适当强度电刺激相应的后根传入纤维,在该运动神经元内可记录到EPSP,如果电极插入支配半膜肌(屈肌)的运动神经元内,则可记录到IPSP,黑色神经元为抑制性中间神经元;B.EPSP:在一定范围内加大刺激强度,EPSP的去极化程度随之增大(上面三个记录),当去极化达到阈电位时,即可爆发动作电位(最下面一个记录),上线为神经元胞内电位记录,下线为后根传入神经电位记录;C.IPSP:当刺激强度逐渐加大时,IPSP的超极化程度随之增大(自上而下),上线为后根传入神经电位记录,下线为神经元胞内电位记录。
在自主神经节和大脑皮层神经元可记录到慢IPSP,其潜伏期和持续时间与慢EPSP相似,发生在交感神经节的慢IPSP持续约2秒。慢IPSP通常由膜的K+电导增高而产生。引起交感神经节慢IPSP的递质可能是多巴胺,由一种特殊的中间神经元释放。
由上面我们可以看到神经系统当需完成某项功能的时候,参与完成的神经元就会接受到较多的兴奋性神经递质,发生EPSP,这些神经元就容易兴奋而发挥其应有的功能;反过来,与完成该项功能相悖的神经元,主要接受抑制性神经递质,产生IPSP,这些神经元发生超极化,比静息时更难以兴奋,最大限度的使其不能阻碍该项功能的实施从而保证参与神经元完成其功能。
此外,无论是EPSP,还是IPSP,都有快慢之分,快的EPSP和IPSP能够使该项功能迅速启动,而慢EPSP和IPSP却保证该项功能持续作用。
4.动作电位在突触后神经元的产生
在前面已经述及,大家一定要清楚两点:第一,突触后膜局部发生EPSP并不是该神经元就已经兴奋,而是该神经元容易兴奋,同理发生IPSP的神经元也不是就一定不能兴奋,当刺激强度足够大时,它们也会兴奋;第二,每一个神经元在胞体和树突部位有上万计的突触,而产生的突触后电位既有EPSP,也有IPSP,因此,突触后神经元胞体就好比是个整合器,突触后膜上电位改变的总趋势取决于同时或几乎同时产生的EPSP和IPSP的代数和。当总趋势为超极化时,突触后神经元表现为抑制;而当突触后膜去极化并达到阈电位水平时,即爆发动作电位。
但动作电位并不是首先在胞体发生,运动神经元和中间神经元发生在轴突起始段(轴丘),有髓鞘的感觉神经元发生在轴突的第一个郎飞结处。这是因为电压门控钠通道在这些部位的质膜中密度较大,而在胞体和树突膜中则很少分布(图2-16)。动作电位一旦爆发便可沿轴突传向末梢而完成兴奋传导。产生的动作电位还可以逆向传到胞体,其意义可能在于去除神经元此次兴奋前不同程度的去极化或超极化,使其状态得到一次刷新。因为神经元在经历一次兴奋后,即进入绝对不应期,只有当绝对不应期结束后,神经元才能接受新的刺激而再次兴奋。

图2-16 动作电位在突触后神经元产生的示意图
A.当突触后神经元的树突接受突触前末梢的兴奋性传递时,在靠近该突触的树突膜和胞体膜上可记录到不同幅度的EPSP,表明EPSP随传播距离增大而衰减,而在轴突始段可记录到动作电位,虽然EPSP在传到始段时更小(图中未显示),但EPSP在始段足以达到阈电位而爆发动作电位;B.电压门控钠通道的密度在轴突始段和每个郎飞结处明显高于胞体和树突,所以在树突和胞体只能产生EPSP,而在轴突始段才能爆发动作电位。(图片来自《生理学》第8版)
5.突触的可塑性
突触可塑性(synaptic plasticity)是指突触的形态和功能可发生较持久改变的特性或现象;但从生理学的角度看,突触的可塑性主要是指突触传递率发生变化。突触的可塑性普遍存在于中枢神经系统中,与未成熟神经系统的发育以及成熟后的学习、记忆与脑的其他高级功能活动密切相关。突触的可塑性主要有以下3种形式:
(1)短时程突触可塑性。重复刺激突触前神经元可引发突触强度的短时性改变。突触强度增大的可塑性包括易化和增强,突触强度减小的可塑性则称为压抑。易化一般可以持续数十至数百毫秒,增强和压抑一般都能持续几秒钟。若给予强直刺激可以产生强直后增强,强直后增强(posttetanic potentiation,PTP)就属于这种形式的突触可塑性,它是在接受一短串高频刺激(即强直刺激)后产生的,通常可持续数分钟,最长可持续1 h或1 h以上。强直刺激可使大量Ca2+进入突触前末梢内,由于进入末梢内的Ca2+需要较长时间才能进入细胞内的钙库,如滑面内质网和线粒体等,且末梢内这些钙库可出现暂时性Ca2+饱和,使轴浆内游离Ca2+暂时蓄积,故轴浆内Ca2+的可出现暂时性高浓度。而对Ca2+敏感的酶,如Ca2+-CaM依赖的蛋白激酶Ⅱ可因轴浆内高Ca2+而被激活,进而促进突触囊泡的动员,轴浆内高Ca2+也能加速Rab3对囊泡的摆渡,最终造成的结果使递质持续大量释放,导致突触后电位持续增强。
(2)习惯化和敏感化。习惯化(habituation)和敏感化(sensitization)都是学习的简单形式,习惯化通常由反复的平和刺激而引起,刺激刚开始时通常有新奇感并引起一定的反应,但随着刺激的重复,便对该刺激习以为常而不予以再重视。习惯化的产生是由于突触前末梢钙通道逐渐失活,Ca2+内流逐渐减少,因而递质释放逐渐减少所致。相反,敏感化则是对原有刺激反应增强和延长的一种表现,一般由伤害性刺激所触发,一次或多次外加伤害性刺激可使平和刺激所引起的反应增强。敏感化则因突触前末梢膜中钙通道开放时间增长,Ca2+内流增多,致使末梢递质释放增多而引起,实质上是突触前易化。一般认为,习惯化和敏感化都是短时程的,但有时也可持续数小时或数周,其长时程反应则可能与某些蛋白的合成以及突触结构的改变有关。
(3)长时程增强和长时程压抑。
①长时程增强:长时程增强(long-term potentiation,LTP)是指突触前神经元在短时间内受到快速重复的刺激后,在突触后神经元快速形成的持续时间较长的EPSP增强,表现为潜伏期缩短、幅度增高、斜率加大。与强直后增强相比,LTP的持续时间要长得多,最长可达数日;且由突触后神经元胞质内Ca2+增加,而非突触前末梢轴浆Ca2+增加而引起。LTP可见于神经系统的许多部位,尤其多见于与学习记忆有关的脑区(如海马),已被公认是脊椎动物学习和记忆的细胞学基础。不同部位的LTP具有不同的产生机制:
LTP在海马有苔鲜纤维LTP和Schaffer侧支LTP两种形式。前者发生于突触前,其机制尚不清楚,可能与c AMP和一种超极化激活的阳离子通道(hyperpolarization-activated channel,Ih)有关。后者发生于突触后,其产生机制是:当低频刺激Schaffer侧支时,突触前末梢释放少量谷氨酸递质,后者与海马CA1区神经元树突膜(突触后膜)中的谷氨酸促离子型AMPA受体结合,使AMPA受体通道开放,Na+内流,产生一定幅度的EPSP,此时另一种谷氨酸促离子型NMDA受体通道因Mg2+阻塞于通道内而不能开放;当给予高频(50Hz)刺激时,突触前末梢释放大量的谷氨酸递质,使突触后膜产生的EPSP幅度增大,导致阻塞于NMDA受体通道中的Mg2+移出,然后Ca2+和Na+得以进入突触后神经元;进入突触后神经元的Ca2+则激活Ca2+-CaM依赖的蛋白激酶Ⅱ,进而促使AMPA受体通道磷酸化而增加其电导,还将储存于胞质中的AMPA受体转移到突触后膜中而增加其密度,使突触后反应增强;此外,可能还有化学性信号(可能是花生四烯酸和氧化亚氮)自突触后神经元产生,逆向作用于突触前神经元,引起谷氨酸的长时程量子式释放(图2-17)。

图2-17 海马Schaffer侧支长时程增强产生机制的示意图
CaM:钙调蛋白;CaM KⅡ:Ca2+-CaM依赖的蛋白激酶Ⅱ;Glu:谷氨酸(引自Ganong《医学生理学概论》第22版)
②长时程压抑:长时程压抑(long-term depression,LTD)是指突触强度的长时程减弱。LTD也ī存在于中枢神经系统。在海马,若给予等量的低频(1Hz)刺激,LTD可在产生LTP的同一突触被引出,此时突触后胞质内Ca2+浓度轻度升高。胞质内Ca2+浓度轻度升高时蛋白磷酸酶优先被激活,结果使AMPA受体去磷酸化而电导降低,突触后膜中AMPA受体的数∞减少,从而产生LTD(图2-17)。LTD有多种形式,不同部位不同形式的LTD,其发生机制也不同,有的LTD依赖谷氨酸促代谢型受体(mGluR),而多数LTD则需要大麻素(cannabinoid)受体的激活。
持续时间更长的LTP和LTD还涉及蛋白合成以及突触和树突棘的结构改变。
五、神经递质
所谓神经递质,从字面不难理解它的含义,就是传递神经信息的物质。而在生理学中,神经递质还有更严格的界定,它应当同时满足下列5点:
①突触前神经元应具有合成递质的前体和酶系统,并能合成该递质;②递质储存于突触囊泡内,当兴奋冲动抵达末梢时,囊泡内的递质能释放至突触间隙;③递质释出后经突触间隙作用于突触后膜中的特异受体而发挥其生理作用。人为施加递质至突触后神经元或效应细胞旁,应能引起相同的生理效应;④存在能使该递质失活的酶或其他失活方式(如重摄取);⑤有特异的受体激动剂和拮抗剂,能分别模拟或阻断相应递质的突触传递作用。同时满足上述5个条件的物质,就可以鉴定为神经递质,但现在发现有些物质(如CO、NO等)虽不完全满足上述经典递质的5个条件,但所起的作用与递质完全相同,故也将它们视为神经递质。
人类迄今为止,被鉴定的神经递质已超过100多种,将已知的主要的神经递质按其化学性质进行分类(见表2-1):
表2-1 人类主要神经递质的分类

*为一类物质的总称
认识和了解人体主要的神经递质及其受体的功能作用,对于理解神经系统的功能作用、脑的高级功能以及临床用药(主要是受体激动剂和抑制剂的使用)都有其重要的意义。
1.乙酰胆碱及其受体
乙酰胆碱(acetylcholine,Ach)是胆碱的乙酰酯。以Ach为递质的神经元称为胆碱能神经元(cholinergic neuron)。胆碱能神经元在中枢分布极为ī,如脊髓前角运动神经元、丘脑腹侧后部的特异性感觉投射神经元等,都是胆碱能神经元。脑干网状结构上行激动系统的各个环节,纹状体、前脑基底核、边缘系统的梨状区、杏仁核、海马等部位也都有胆碱能神经元。以Ach为递质的神经纤维称为胆碱能纤维(cholinergic fiber)。在外周,支配骨骼肌的运动神经纤维、所有自主神经节前纤维、大多数副交感节后纤维(少数释放肽类或嘌吟类递质的纤维除外)、少数交感节后纤维(如支配多数小汗腺的纤维和支配骨骼肌血管的舒血管纤维)都属于胆碱能纤维。
能与Ach特异性结合的受体称为胆碱能受体(cholinergic receptor)。根据其药理学特性,胆碱能受体可分为毒蕈碱受体(muscarinic receptor,M receptor)和烟碱受体(nicotinic receptor,N receptor)两类,它们因分别能与天然植物中的毒蕈碱和烟碱结合并产生两类不同的生物效应(即毒蕈碱样和烟碱样作用,见以下章节)而得名。这两类受体ī分布于中枢和周围神经系统。分布有胆碱能受体的中枢神经元称为胆碱能敏感神经元。在外周,M受体分布于大多数副交感节后纤维(除少数释放肽类或嘌吟类递质的纤维外)支配的效应细胞、交感节后纤维支配的汗腺和骨骼肌血管的平滑肌细胞膜上。由不同基因编码的5种M受体亚型(M1-M5)已被克隆,均为G蛋白耦联受体。有资料显示,M1受体在脑内含量颇丰,M2受体主要分布于心脏,M3和M4受体存在于多种平滑肌上,M4受体还见于胰腺腺泡和胰岛组织,介导胰酶和胰岛素的分泌,M5受体的情况不详。N受体可分为N1和N2受体两种亚型,N1受体分布于中枢神经系统和自主神经节后神经元上,因而又称神经元型烟碱受体(neuron-type nicotinic receptor);N2受体则位于骨骼肌神经-肌接头处的终板膜中,所以也称肌肉型烟碱受体(muscle-type nicotinic receptor)。两种N受体都是促离子型受体,具有递质门控特性,也称N型Ach受体阳离子通道。
中枢胆碱能系统参与几乎所有的中枢神经系统功能,包括学习和记忆、觉醒与睡眠、感觉与运动、内脏活动以及情绪等多方面的调节。而周围胆碱能系统则主要涉及自主神经系统和骨骼肌活动的调节。M受体激活时的效应包括心脏活动抑制,支气管平滑肌、胃肠平滑肌、膀胱逼尿肌、虹膜环行肌收缩,消化腺、汗腺分泌增加和骨骼肌血管舒张等。这些作用统称为毒蕈碱样作用(muscarine-like action),简称M样作用,可被M受体拮抗剂阿托品(atropine)阻断。在自主神经节,小剂量Ach能激活N1受体而兴奋节后神经元,也能激活N2受体而使骨骼肌收缩,但大剂量Ach则可阻断自主神经节的突触传递。这些作用统称为烟碱样作用(nicotine-like action),简称N样作用,它不能被阿托品阻断,但能被筒箭毒碱(tubocurarine)、美卡拉明(mecamylamine)、六烃季铵(hexamethonium)、戈拉碘铵(gallamine triethiodide)、十烃季铵(decamethonium)等阻断。目前尚缺乏非常特异的N1和N2受体拮抗剂。美卡拉明主要拮抗N1受体,可被用作自主神经节阻断剂,产生抗高血压效应,六烃季铵也主要拮抗N1受体;上述其他N受体拮抗剂则主要拮抗N2受体,常被用作肌松药。
2.单胺类递质及其受体
单胺类递质包括去甲肾上腺素、肾上腺素、多巴胺、5-羟色胺和组胺等,其中前三者属于儿茶酚胺(catecholamine)类,即含邻苯二酚结构的胺类。
(1)去甲肾上腺素和肾上腺素及其受体。作为神经递质,去甲肾上腺素(norepinephrine,NE或noradrenaline,NA)分布于中枢和周围神经系统,而肾上腺素(epinephrine,E或adrenaline)仅分布于中枢神经系统,它在外周属肾上腺髓质释放的一种内分泌激素。
在中枢,以NE为递质的神经元称为去甲肾上腺素能神经元。其胞体绝大多数位于低位脑干,尤其是中脑网状结构、脑桥的蓝斑以及延髓网状结构的腹外侧部分。其纤维投射分上行部分、下行部分和支配低位脑干部分。上行部分投射到大脑皮层、边缘前脑和下丘脑;下行部分投射至脊髓后角的胶质区、侧角和前角;支配低位脑干部分分布在低位脑干内部。以E为递质的神经元称为肾上腺素能神经元,其胞体主要分布在延髓,其纤维投射也有上行和下行部分。在外周,NE是多数交感节后纤维(除支配汗腺和骨骼肌血管的交感胆碱能纤维外)释放的递质,以NE为递质的神经纤维称为肾上腺素能纤维(adrenergic fiber)。
能与NE和E结合的受体称为肾上腺素能受体(adrenergic receptor),ī分布于中枢和周围神经系统。这类受体可分为α型肾上腺素能受体(简称α受体)和β型肾上腺素能受体(简称β受体)。α受体又有α1和α2受体两种亚型,α2受体主要分布于突触前膜,属于突触前受体;β受体也有β1、β2和β3受体三种亚型。所有肾上腺素能受体均属G蛋白耦联受体。在外周,多数交感节后纤维末梢支配的效应细胞上都有肾上腺素能受体,但在同一种效应细胞上不一定都有α和β受体,有的仅有α受体,有的仅有β受体,也有的两种受体都有。例如,在心肌主要存在β受体;在血管平滑肌上则有α和β两种受体,但在皮肤、肾、胃肠的血管平滑肌上以α受体为主,而在骨骼肌和肝脏的血管则以β受体为主。酚妥拉明(phentolamine)能阻断α受体,包括α1和α2受体,但主要阻断α1受体。哌唑嗪(prazosin)和育亨宾(yohimbine)分别选择性阻断α1和α2受体。普萘洛尔(propranolol,心得安)能阻断β受体,但对β1和β2受体无选择性。阿替洛尔(atenolol)和美托洛尔(metoprolol)主要阻断β1受体,而丁氧胺(butoxamine)则主要阻断β2受体。
中枢NE及其受体的作用涉及心血管活动、精神情绪活动、体温、摄食和觉醒等方面的调节,而E及其受体的作用则主要参与心血管活动的调节。在外周,NE对α受体的作用较强,对β受体的作用较弱。一般而言,NE与α受体(主要是α1受体)结合后产生的平滑肌效应主要是兴奋性的,包括血管、子宫、虹膜辐射状肌等的收缩,但也有抑制性的,如小肠舒张(为α2受体);NE与β受体(主要是β2受体)结合后产生的平滑肌效应则为抑制性的,包括血管、子宫、小肠、支气管等的舒张,但与心肌β1受体结合所产生的效应却是兴奋性的。β3受体主要分布于脂肪组织,与脂肪分解有关。在外周作为内分泌激素的E也通过α和β受体发挥作用,与NE不同的是它对这两类受体的作用都很强。
临床上用α2受体激动剂绿压啶(clonidine,可乐定)可治疗高血压。过去曾认为是通过对突触前α2受体的激活,减少中枢NE释放而起作用的;后来发现其分子结构与咪唑啉(imidazoline)十分相似,且它与咪唑啉受体的亲和力明显高于α2受体,结果导致在延髓心血管中枢发现具有降压效应的咪唑啉受体。
(2)多巴胺及其受体。多巴胺(dopamine,DA)是哺乳动物脑内单胺能神经递质中相对较新的成员,主要存在于中枢神经系统,主要包括黑质—纹状体、中脑—边缘前脑、结节—漏斗三条通路。黑质—纹状体通路与运动调节有关,中脑腹侧被盖—边缘前脑伏隔核通路与奖赏行为和成瘾有关,而结节—漏斗通路则主要参与垂体内分泌活动的调节。正电子发射断层扫描(PET)显示,正常人基底神经节内多巴胺受体数量随年龄的增长而逐渐减少,以男性更为显著。已发现并克隆出D1-D5五种多巴胺受体,它们都是G蛋白耦联受体。中枢多巴胺系统主要参与对躯体运动、精神情绪、垂体内分泌和心血管活动等的调节。
(3)5-羟色胺及其受体。5-羟色胺(serotonin或5-hydroxytrytamine,5-HT)浓度最高是在血小板及胃肠道的肠嗜铬样细胞和肌间神经丛。在中枢,5-HT能神经元胞体主要集中于低位脑干的中缝核内,由此发出的纤维可上行至下丘脑、边缘系统、新皮层和小脑;也可下行到脊髓,还有一部分纤维分布在低位脑干内部。中枢5-HT系统的功能十分复杂,涉及痛觉、精神情绪、睡眠、体温、性行为、垂体内分泌等多种功能活动的调节;而外周5-HT系统主要与消化系统功能和血小板聚集等有关。
(4)组胺及其受体。组胺(histamine)能神经元的胞体集中于下丘脑后部的结节乳头核内,其纤维到达中枢几乎所有部位,包括大脑皮层和脊髓。此外,组胺还存在于组织肥大细胞和胃粘膜的肠嗜铬细胞中。组胺的三种受体H1、H2和H3受体广泛存在于中枢和局围神经系统中。多数H3受体为突触前受体,通过Gī介导抑制组胺或其他递质的释放。组胺与H1受体结合后能激活磷脂酶C,而与H2受体结合后则能提高细胞内cAMP的浓度。中枢组胺系统可能与觉醒、性行为、腺垂体激素的分泌、血压、饮水和痛觉等调节有关。
3.氨基酸类递质及其受体
(1)兴奋性氨基酸类递质及其受体。这类递质主要有谷氨酸和门冬氨酸。谷氨酸(glutamicacid或glutamate,Glu)是脑和脊髓内主要的兴奋性递质,在大脑皮层和脊髓背侧部分含量相对较高;门冬氨酸(aspartic acid或aspartate,Asp)则多见于视皮层的锥体细胞和多棘星状细胞。
谷氨酸受体ī分布于中枢神经系统中,它们可分为促离子型受体(ionotropic receptor)和促代谢型受体(metabotropic recePtor)两类。促离子型受体可再分为海人藻酸(kainic acid或kainate,KA)受体、AMPA(α-amino-3-hydroxy-5-methyl-4-isoxazole propionate)受体和NMDA受体(N-methyl-D-aspartate receptor)3种类型。目前已有多种亚型被鉴定,已知KA有5种、AMPA有4种,而NMDA则有6种。KA受体和AMPA受体过去合称为非NMDA型受体,它们对谷氨酸的反应较快,其通道的电导却较低,尤其是KA受体。KA受体主要对Na+和K+通透,部分KA受体位于分泌γ-氨基丁酸的突触前末梢膜中。常见的AMPA受体有两种,一种是单一的钠通道,另一种除通透Na+外,也允许Ca2+通透。NMDA受体对谷氨酸的反应较慢,其通道的电导却相对较高,对Na+、K+、Ca2+都通透。此外,NMDA受体还具有以下特点:①膜外侧有甘氨酸结合受点,甘氨酸与之结合为谷氨酸产生兴奋效应所必需;②当谷氨酸与NMDA受体结合时通道开放,但通道在静息电位水平因通道内侧某一受点与Mg2+结合而被阻塞,只有当膜去极化达到一定水平时,Mg2+从通道内移出,阻塞方可解除;③通道内某些受点可与苯环利定(phencyclidine,PCP)和氯胺酮(ketamine)等致精神障碍的药物结合而使通道变构,从而降低对Na+、K+、Ca2+等的通透性。多数谷氨酸敏感神经元上同时存在NMDA和AMPA受体。NMDA受体在海马的密度颇高,与LTP的产生密切相关。谷氨酸促代谢型受体(mGluR)已有11种亚型被鉴定。mGluR在突触前和突触后神经元上均有分布,可能参与突触可塑性。若敲除mGluR1基因,可严重损害运动协调和空间认知的能力。但谷氨酸受体过度激活可造成Ca2+大量内流或细胞内储存的Ca2+释放而导致神经元死亡。目前对门冬氨酸的研究资料还较少。
(2)抑制性氨基酸类递质及其受体:这类递质主要包括γ-氨基丁酸和甘氨酸。γ-氨基丁酸(γ-aminobutyric acid,GABA)是脑内主要的抑制性递质,在大脑皮层浅层和小脑皮层浦肯野细胞层含量较高。甘氨酸(glycine,Gly)则主要分布于脊髓和脑干中。
GABA受体可分为GABAA、GABAB和GABAC受体3类。GABAA和GABAB受体ī分布于中枢神经系统,而GABAC受体则主要位于视网膜和视觉通路中。GABAA和GABAC受体属于促离子型受体,其通道都是氯通道,激活时都增加Cl-内流。所不同的是:GABAA受体的组成较复杂,是由10多种不同的亚单位组合成的五聚体,GABAC受体的组成则较简单,是由3种不同的p亚单位组合成的五聚体;与GABAB受体相比,GABAC受体对GABA的敏感性较高,激活时通道开放较缓慢而持久,且不易脱敏。GABAB受体属于促代谢型受体,在突触前和突触后均有分布。突触前GABAB受体被激活后,可通过相耦联的Gī增加K+外流,减少Ca2+内流而使递质释放减少;突触后GABAB受体激活后,则可通过Gī抑制腺苷酸环化酶,激活钾通道,增加K+外流。在突触后,无论是Cl-内流增加(通过激活GABAA和GABAC受体)还是K+外流增加(通过激活GABAB受体),都能引起突触后膜超极化而产生IPSP。
甘氨酸受体为促离子型受体,与GABAA受体相同,其通道也是氯通道,通道开放时允许Cl-和其他单价阴离子进入膜内,引起突触后膜超极化而产生IPSP。甘氨酸受体可被士的宁(strychnine)阻断。此外,甘氨酸也能结合于NMDA受体,产生兴奋效应,且为谷氨酸兴奋NMDA受体所必需。
4.神经肽及其受体
神经肽(neuropeptide)是指分布于神经系统的起信息传递或调节信息传递效率的肽类物质。神经肽主要有以下几类。
(1)速激肽。哺乳动物的速激肽包括P物质(substance)。P物质在脊髓初级传入纤维中含量丰富,可能是慢痛传入通路中第一级突触的调质,它在黑质-纹状体通路中的浓度也很高,而在下丘脑则可能起神经内分泌调节作用。在外周,P物质可引起肠平滑肌收缩,血管舒张和血压下降等效应。
(2)阿片肽。目前已有20多种有活性的阿片肽(opioid peptide)被鉴定,其中最主要的是内啡肽、脑啡肽和强啡肽三大族。内啡肽中主要是β-内啡肽,多见于腺垂体、下丘脑、杏仁核、丘脑、脑干和脊髓等处,对缓解机体应激反应具有重要作用。脑啡肽主要有甲硫脑啡肽和亮脑啡肽两种,在脑内分布ī,在纹状体、下丘脑、苍白球、杏仁核、延髓和脊髓中浓度较高。强啡肽主要有强啡肽A和B两种分子,强啡肽在脑内的分布与脑啡肽有较多重叠,但其浓度低于脑啡肽。已确定的阿片受体有μ、κ和δ受体,均为G蛋白耦联受体,均通过降低c AMP而发挥作用。这些受体除在脑内分布外,几乎遍及全身,对多种阿片肽均具有亲和力。由于配体和受体之间作用的相互交叉,且亲和力的高低不等,因此产生的效应十分复杂。激活μ受体可增加K+电导,引起中枢神经元和初级传入纤维超极化,产生镇痛、镇静、便秘、欣快、呼吸抑制、缩瞳、促生长激素和催乳素分泌等作用;激活κ受体可引起钙通道关闭,产生镇痛、利尿、镇静、焦虑和缩瞳等表现;激活δ受体也可使钙通道关闭,产生镇痛效应。近年来又相继发现与已知所有阿片受体亲和力很低的孤儿受体及其内源性配体孤啡肽,以及μ受体真正的自然配体内吗啡肽。孤啡肽及其受体的作用是对抗吗啡的镇痛效应,内吗啡肽对μ受体的亲和力较对κ和δ受体的亲和力分别强15000和4000倍。
(3)下丘脑及垂体神经肽。下丘脑调节肽(hypothalamic regulatory peptides,HRP)中许多或全部激素及其受体可见于下丘脑以外的脑区和周围神经系统,提示它们可能以神经递质的方式发挥调节作用。如生长抑素(somatostatin,SST)存在于许多脑区参与感觉、运动和认知功能等调节。已发现SSTR1-SSTR5 5种生长抑素受体,它们都与G蛋白耦联,并通过降低c AMP而引起不同生理效应。其中SSTR2受体可能介导认知功能和抑制生长激素的分泌,而SSTR5受体则可能参与胰岛素分泌的抑制性调节。促肾上腺皮质激素释放激素(CRH)及其受体也存在于大脑皮层、橄榄-小脑通路等处,促甲状腺激素释放激素(TRH)在大脑皮层、海马、脊髓前角和视网膜中的含量也很高。此外,室旁核含缩宫素和血管升压素的神经元发出的轴突除向神经垂体投射外,也向脑干和脊髓投射,具有调节交感和副交感神经活动的作用,并能抑制痛觉。
(4)脑-肠肽。脑-肠肽是一种分布于消化道和脑的肽类物质。脑内含多种不同肽链长度的缩胆囊素(CCK),以CCK-8为主,主要分布于大脑皮层、纹状体、杏仁核、下丘脑和中脑等处。CCK在脑内具有抑制摄食行为等多种作用。17肽和34肽促胃液素、神经降压素、甘丙肽、促胃液素释放肽和血管活性肠肽(VIP)也可见于脑内。存在于血管运动神经纤维的VIP具有舒血管作用,许多胆碱能神经元中共存有VIP和Ach,在某些腺体分泌中具有协调作用。此外,引起胃容受性舒张的迷走神经纤维释放的递质也可能是VIP。
(5)其他肽类递质。中枢神经系统中还发现多种其他肽类物质,如缓激肽、血管紧张素Ⅱ、内皮素、心房钠尿肽、降钙素基因相关肽、神经肽Y等,这些肽类物质都可由神经元释放而兴奋或抑制其他神经元,并参与神经系统的调节活动,因而均可认作神经递质。
5.嘌吟类递质及其受体
嘌吟类递质主要有腺苷和ATP,腺苷在中枢通常起抑制性作用,如咖啡和茶的中枢兴奋作用就是由于咖啡因和茶碱阻断腺苷受体而产生的;腺苷还能舒张脑血管。腺苷也有中枢兴奋作用,这与激活不同的受体亚型有关。腺苷受体也ī分布于外周而产生多种效应,如能舒张心脏冠状小动脉,收缩肾小球球外系膜细胞,参与管-球反馈等。ATP具有ī的突触传递效应,在自主神经(包括交感和副交感)系统中常与其他递质共存和共释放,参与对血管、心肌、膀胱、肠平滑肌等的活动调节;在脑内ATP常共存于含单胺类或氨基酸类递质的神经元中。研究表明,ATP介导自主神经系统的快速突触反应和缰核的快反应,可能末梢在释放ATP的同时也将可溶性核苷酸酶一起释出,使ATP在产生传递效应后被迅速清除。此外,ATP在痛觉传入中具有重要作用。
6.气体分子类神经递质
(1)氧化亚氮。体内的氧化亚氮(NO)来源于其前体物质L-精氨酸,由氧化亚氮合酶(NOS)催化而形成。与经典递质不同的是,NO不储存于突触囊泡内,不以出胞形式释放,也不与靶细胞膜上特异性受体结合,而是以扩散的方式到达邻近靶细胞,直接结合并激活一种可溶性鸟苷酸环化酶,使胞质内cGMP水平升高而产生生物效应。NOS在脑内分布ī,以小脑、上丘、下丘、嗅球内含量最高,其次是大脑皮层、海马、终纹等区。NOS与NMDA受体的分布一致,提示两者在功能上有密切联系。NO在中枢参与LTP和LTD等突触可塑性。此外,NO具有神经毒作用、除介入谷氨酸(通过NMDA受体)引起的神经毒外,它还与超氧自由基发生反应,生成过氧亚硝酸和二氧化氮等活性氮(RNS)。当NO生成过多时,可产生大量活性氮而导致神经细胞死亡。
(2)一氧化碳。一氧化碳(CO)在血红素代谢过程中由血红素氧合酶(hemeoxygenase,HO)的催化而生成。HO有HO-1和HO-2两种异构体,前者存在于神经胶质细胞和少数神经元中,肝和脾中浓度很高;后者在小脑和海马神经元中浓度很高。CO的作用与NO相似,也通过激活鸟苷酸环化酶而发挥其生物效应。
有报道神经细胞膜中存在12次跨膜的前列腺素转运体。前列腺素可能通过改变c AMP水平来调制神经元的活动,而不是作为一种递质发挥作用。此外,有许多类固激素能影响脑的功能,故称为神经活性类固醇。循环血中的类固醇激素极易进入中枢,脑内神经元上也存在许多性激素和肾上腺糖皮质激素的受体。除了作用于核受体外,这些神经活性类固醇还可产生快速效应,很可能是由膜受体介导的。有证据显示,一些比较简单的类固醇前体能在脑内转化为具有生物活性的神经活性类固醇。已知黄体酮能促进髓鞘的形成,但大多数类固醇对脑功能的调节仍有待进一步研究。
通过以上的描述,大家应该明白,突触前神经元通过释放递质作用于突触后神经元,神经递质的种类终究有限。突触后神经元由于存在不同的受体,同样的神经递质,作用于不同受体的神经元,却表现出不同的功能,由此也就决定了神经元功能的多样性。故此,通过突触结构释放不同的递质再作用于不同受体的突触后神经元,可以使神经系统表现出多种多样的功能特性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















